7.18: Vinylhalogeniden en Arylhalogeniden
nucleofiele substitutie in de arylhalogeniden
we zullen de structuur van chloorbenzeen in detail bestuderen. Broombenzeen en jodobenzeen zijn precies hetzelfde. De eenvoudigste manier om de structuur van chloorbenzeen te tekenen is:
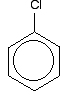
om chloorbenzeen goed te begrijpen, moet u iets dieper graven. Er is een interactie tussen de gedelokaliseerde elektronen in de benzeenring en één van de eenzame paren op het chlooratoom. Dit overlapt met het gedelokaliseerde ringelektronsysteem . . .
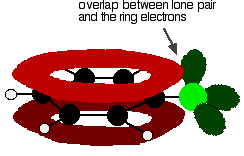
om een structuur als deze te geven:
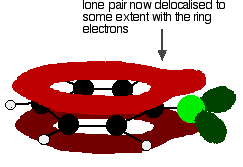
deze delokalisatie is geenszins volledig, maar heeft wel een significant effect op de eigenschappen van zowel de koolstof-chloorbinding als de polariteit van het molecuul. De delokalisatie introduceert wat extra binding tussen de koolstof en het chloor, waardoor de binding sterker wordt. Dit heeft een belangrijk effect op de reacties van verbindingen zoals chloorbenzeen.
er is ook enige beweging van elektronen weg van het chloor naar de ring. Chloor is vrij elektronegatief en trekt gewoonlijk elektronen in de koolstof-chloorbinding naar zich toe. In dit geval wordt dit tot op zekere hoogte gecompenseerd door de beweging van elektronen terug naar de ring in de delokalisatie. Het molecuul is minder polair dan je anders had verwacht.
eenvoudige arylhalogeniden zoals chloorbenzeen zijn zeer resistent tegen nucleofiele substitutie. Het is mogelijk om het chloor te vervangen door-OH, maar alleen onder zeer zware industriële omstandigheden-bijvoorbeeld bij 200°C en 200 atmosferen. In het lab komen deze reacties niet voor. Er zijn twee redenen hiervoor-afhankelijk van welke van de bovenstaande mechanismen je het over hebt.
- de extra sterkte van de koolstof-halogeenbinding in arylhalogeniden: de koolstof-chloorbinding in chloorbenzeen is sterker dan je zou verwachten. Er is een interactie tussen een van de eenzame paren op het chlooratoom en de gedelokaliseerde ringelektronen, en dit versterkt de binding. Beide mechanismen hierboven impliceren het breken van de koolstof-halogeenbinding in een bepaald stadium. Hoe moeilijker het is om te breken, hoe trager de reactie zal zijn.
- afstoting door de ringelektronen: Dit is alleen van toepassing als het hydroxide-ion het chloorbenzeen aanviel met een mechanisme zoals hierboven beschreven. In dat mechanisme tast het hydroxide-ion de licht positieve koolstof aan waar het halogeenatoom aan vastzit.Als het halogeenatoom aan een benzeenring is bevestigd, wordt het binnenkomende hydroxide-ion geconfronteerd met de gedelokaliseerde ringelektronen boven en onder dat koolstofatoom. Het negatieve hydroxide ion wordt gewoon afgestoten. Dat specifieke mechanisme is gewoon een non-starter!