SF6 molekulární geometrie, Lewisova struktura, tvar a polarita
hexafluorid síry nebo SF6 je anorganický skleníkový plyn. Je nehořlavý, bez zápachu a bezbarvý a je vynikajícím izolátorem. Jedná se o hypervalentní oktaedrální molekulu, která byla zajímavým tématem rozhovoru mezi nadšenci chemie.
Henri Moissan objevil existenci SF6. Mimochodem, je také objevitelem fluoru. Standardní způsob syntézy SF6 je vystavit S8 na F2. Tato metoda způsobuje tvorbu několika fluoridů síry, ale ty mohou být eliminovány zahříváním a následným použitím NaOH k odstranění dalších molekul SF4.
SF6 nelze použít ihned po syntéze. Musí být vyčištěn, aby se zbavil všech reaktivních fluoridů. Poté musí projít pyrolýzou.
Tady v tomto blogu se budeme učit, Lewis Struktura SF6 a jeho vazebné úhly, Molekulární geometrie a tvar, který nám může pomoci pochopit fyzikální vlastnosti této molekuly.
| Name of molecule | Sulphur Hexafluoride ( SF6) |
| No of Valence Electrons in the molecule | 48 |
| Hybridization of SF6 | sp3d2 hybridization |
| Bond Angles | 90 degrees |
| Molecular Geometry of SF6 | Octahedral |
Contents
SF6 Valence Electrons
To determine the Lewis Struktura jakékoliv molekuly, musíme nejprve znát celkový počet valenčních elektronů. Zde zjistíme celkový počet valenčních elektronů pro SF6 přidáním valenčních elektronů pro atomy síry i fluoru.
Celkový počet valenčních elektronů v SF6 – Valenční elektrony Síry + Valenčních elektronů Fluoru
Síra má šest valenčních elektronů.
fluor má sedm valenčních elektronů, ale protože v této molekule je šest atomů fluoru, vynásobíme toto číslo 6.
= 6 + 7*6
= 6 + 42
= 48 valenční elektrony
Tak SF6 má 48 valenční elektrony, které nám pomohou nakreslit Lewis Dot Struktura SF6.
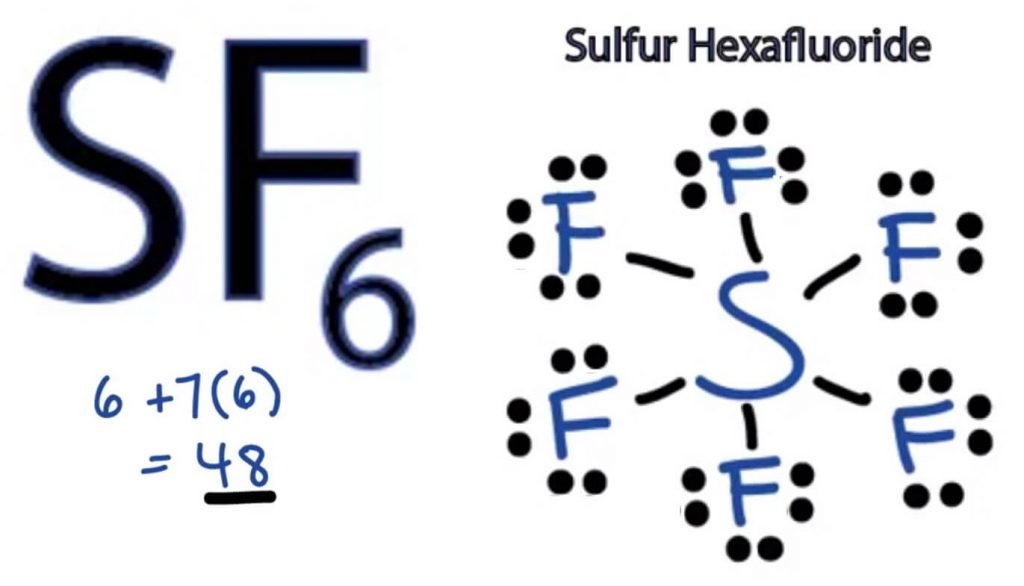
SF6 Lewis Struktura
Lewis Dot struktura molekuly je schématické znázornění atomů podílí na formování struktury a její jednotlivé valenční elektrony. Tato struktura nám pomáhá znát vazby v molekule a uspořádání elektronů v ní.
atom síry zaujme centrální polohu, protože je méně elektronegativní než fluor. Umístěte jej do středu a všechny atomy fluoru kolem něj takto:
atom fluoru potřebuje pouze jeden valenční elektron, aby dokončil svůj oktet. Protože každý atom dodržuje pravidlo oktetu, aby dosáhl stabilní struktury, atom fluoru bude sdílet jeden valenční elektron atomu síry. Tak, Síry bude sdílet šest z jeho valenčních elektronů s atomy fluoru, které v důsledku tvoří šest jednoduché vazby mezi S a F.
V Lewis Struktura, ukážeme dluhopisů ve struktuře tím, že kreslí rovnou čáru mezi dvěma atomy. Takže všechny tyto vazby zabírají 12 valenčních elektronů ze 48.
umístěte všechny zbývající valenční elektrony kolem atomů fluoru a zkontrolujte, zda jsou oktety všech atomů fluoru úplné.
jakmile to uděláte, uvidíte valenční elektrony ve vnějších pláštích všech atomů fluoru, ale síra má ve svém vnějším plášti více než 8 elektronů. To je proto, že to je výjimka octet roli a může rozšířit své orbitální ubytovat více elektronů.
Toto je tedy správná Lewisova struktura SF6.
SF6 Hybridizace
Teď, když víme, Lewis Struktura SF6, můžeme nyní určit atomů hybridizace v molekule. Zde, jak síra sdílí své elektrony s atomy fluoru, podíváme se na její hybridizaci.
elektronická konfigurace SF6 v základním stavu je 3s23p4. Ale když sdílí elektrony a je ve vzrušeném stavu, elektronové páry v orbitálech 3s i 3p se nepárují. Tyto elektrony se pohybují, aby vyplnily vyšší volné 3D orbitaly. Výsledkem je vytvoření šesti hybridních orbitalů(jeden z 3s, tři z 3p a dva 3d). Tyto hybridní orbitaly jsou ty, které pojmou sdílené elektrony. Tyto orbitaly se překrývají s 2p orbitaly atomu fluoru, když atomy síry a fluoru tvoří vazby. Těchto šest orbitalů je v šesti směrech osmistěnného tvaru.
proto má hexafluorid síry hybridizaci sp3d2.
SF6 úhel vazby
Jak síra sdílí své valenční elektrony se 6 atomy fluoru, vidíme, že všech šest elektronů atomu síry je sdíleno za vzniku vazeb. Úhel vazby F-S-F je 90 stupňů.
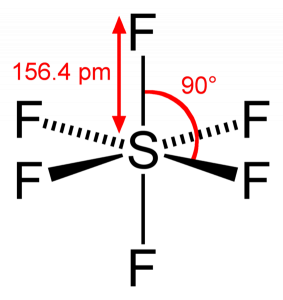
SF6 Molekulární Geometrie
Když se podíváme na Hexafluorid Síry molekula Síry je v centrální poloze s atomy fluoru uspořádány symetricky kolem něj. Atomy jsou umístěny v oktaedrická vzor, který dělá molekulární geometrie SF6 je oktaedrická.
SF6 Tvar
při Pohledu na molekulární geometrie molekuly, můžeme říci, že molekula SF6 má oktaedrická tvar jako má osm stran. Centrální atom se však váže se šesti atomy fluoru, tvar SF6 je oktaedrální.

je SF6 polární nebo nepolární?
SF6 je nepolární molekula. Je to proto, že teorie VSEPR říká, že když je šest atomů fluoru uspořádáno symetricky kolem atomu síry, dipóly vazby jsou zrušeny. Výsledkem je nepolární molekula.

má také stejné vlastnosti jako nepolární molekuly, jako je nerozpustný ve vodě a rozpustný v nepolárních organických rozpouštědlech.
Závěrečné shrnutí
Abychom to shrnuli tento článek, můžeme říci, že v Lewis dot struktura SF6, všechny valenční elektrony jsou použité což ve výsledku tvoří šest jednoduché vazby mezi S-F s ne osamělý párů elektronů.
hybridizace síry v této molekule je sp3d2 s úhly vazby 90 stupňů.
molekulární geometrie SF6 je oktaedrální a je to nepolární molekula.