etiket: MEGACE ES-megestrolacetatsuspension
klinisk farmakologi
der er flere analysemetoder, der anvendes til at estimere plasmakoncentrationer af megestrolacetat, herunder gaskromatografi-massefragmentografi (GC-MF), højtryksvæskekromatografi (HPLC) og radioimmunoassay (RIA). GC-MF-og HPLC-metoderne er specifikke for megestrolacetat og giver ækvivalente koncentrationer. RIA-metoden reagerer på megestrolacetatmetabolitter og er derfor ikke-specifik og indikerer højere koncentrationer end GC-MF-og HPLC-metoderne. Plasmakoncentrationer afhænger ikke kun af den anvendte metode, men også af tarm-og leverinaktivering af lægemidlet, som kan påvirkes af faktorer som tarmkanalmotilitet, tarmbakterier, administreret antibiotika, kropsvægt, diæt og leverfunktion.
virkningsmekanisme
flere efterforskere har rapporteret om den appetitforbedrende egenskab ved megestrolacetat og dets mulige anvendelse i kakeksi. Den præcise mekanisme, hvormed megestrolacetat producerer effekter i anoreksi og kakeksi, er ukendt på nuværende tidspunkt.
Farmakokinetiske egenskaber:
plasmakoncentrationer af megestrolacetat efter administration af 625 mg (125 mg/mL) Megace porøs suspension er ækvivalente under foderbetingelser til 800 mg (40 mg/mL) megestrolacetat oral suspension (se figur nedenfor).
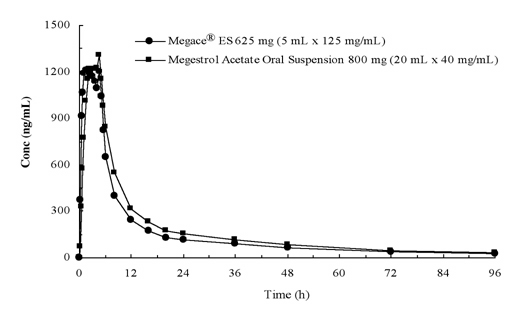
for at karakterisere dosisproportionaliteten af Megace crane ES blev der udført farmakokinetiske undersøgelser på tværs af en række doser, når de blev administreret under faste og fodrede betingelser. Farmakokinetikken for megestrol var lineær i doseringsintervallet mellem 150 mg og 675 mg efter administration af Megace kur ES uanset måltidstilstand. Cmaks og AUC under et måltid med højt fedtindhold blev øget med henholdsvis 48% og 36% sammenlignet med dem under fastende efter administration af 625 mg Megace karrus ES (tabel 1). Imidlertid øgede et måltid med højt fedtindhold signifikant AUC og Cmaks af megestrol til henholdsvis 2 gange og 7 gange sammenlignet med dem under fastende tilstand efter administration af 800 mg i den oprindelige formulering. Der var ingen forskel i sikkerheden efter administration i fed tilstand, derfor kunne Megace karrus ES tages uden hensyn til måltider.
|
*megestrol acetate oral suspension |
||||||||||||||||
| Table 1 – Pharmacokinetic Studies Conducted with Megace® ES | ||||||||||||||||
| Amount Dosed | 150 mg | 250 mg | 375 mg | 450 mg | 575 mg | 625 mg | 675 mg | 800 mg* | ||||||||
| Dose | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 20 mL | ||||||||
| Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | |
| Cmax (ng/mL) | 412 | 379 | 647 | 588 | 810 | 958 | 955 | 1079 | – | 1421 | 1133 | 1618 | 1044 | 1616 | 187 | 1364 |
| AUC0-∞ (ng∙h/mL) | 3058 | 3889 | 5194 | 6328 | 7238 | 12193 | 9483 | 11800 | – | 14743 | 12095 | 16268 | 11879 | 17029 | 8942 | 18625 |
| Tmax (h) | 1.74 | 3.80 | 1.58 | 3.38 | 1.56 | 3.42 | 1.74 | 3.16 | – | 3.75 | 1.72 | 2.91 | 1.96 | 2.76 | 5.89 | 3.85 |
plasma steady state farmakokinetik af megestrolacetat blev evalueret hos 10 voksne, kakektiske mandlige patienter med erhvervet immundefektsyndrom (AIDS) og et ufrivilligt vægttab større end 10% af baseline. Patienterne fik orale enkeltdoser på 800 mg/dag megestrolacetat oral suspension i 21 dage. Plasmakoncentrationsdata opnået på dag 21 blev evalueret i op til 48 timer efter den sidste dosis.den gennemsnitlige (1SD) maksimale plasmakoncentration (Cmaks) af megestrolacetat var 753 (539) ng/mL. Det gennemsnitlige areal under koncentrationstidskurven (AUC) var 10476 (7788) ng h/mL. Median Tmaks værdi var fem timer. Syv ud af 10 patienter steg i vægt på tre uger.
derudover blev 24 voksne, asymptomatiske HIV-seropositive mandlige forsøgspersoner doseret en gang dagligt med 750 mg megestrolacetat oral suspension. Behandlingen blev administreret i 14 dage. De gennemsnitlige Cmaks-og AUC-værdier var hhv.490 (g238) ng/mL og 6779 (g3048) hhv. ng/mL. Den gennemsnitlige Tmaks-værdi var tre timer. Den gennemsnitlige Cmaks-værdi var 202 (101) ng / mL. Den gennemsnitlige % af fluktuationsværdien var 107 (kr. 40).Megestrolacetatmetabolitter, som blev identificeret i urinen, udgjorde 5% til 8% af den indgivne dosis. Åndedrætsudskillelse som mærket kulsyre og fedtopbevaring kan have tegnet sig for mindst en del af den radioaktivitet, der ikke findes i urin og afføring.
Elimination
den vigtigste rute for lægemiddeleliminering hos mennesker er urin. Når radioaktivt mærket megestrolacetat blev administreret til mennesker i doser på 4 til 90 mg, varierede urinudskillelsen inden for 10 dage fra 56,5% til 78,4% (gennemsnit 66,4%) og fækal udskillelse varierede fra 7,7% til 30,3% (gennemsnit 19,8%). Den samlede genfundne radioaktivitet varierede mellem 83,1% og 94,7% (gennemsnit 86,2%).
særlige populationer
farmakokinetikken af megestrolacetat er ikke undersøgt i nogen specielle populationer.
DYRFARMAKOLOGI og / eller toksikologi
langtidsbehandling med Megace karrus ES (megestrolacetat) kan øge risikoen for luftvejsinfektioner. En tendens til øget hyppighed af luftvejsinfektioner, nedsat lymfocyttal og øget neutrofiltal blev observeret i et toårigt kronisk toksicitets-/karcinogenicitetsstudie af megestrolacetat udført på rotter.
beskrivelse af kliniske studier
megestrolacetat oral suspension i en dosis på 800 mg/20 mL svarer til 625 mg / 5 mL Megace-kur ES. Den kliniske effekt af megestrolacetat oral suspension blev vurderet i to kliniske forsøg. Den ene var et multicenter, randomiseret, dobbeltblindt, placebokontrolleret studie, der sammenlignede megestrolacetat (MA) ved doser på 100 mg, 400 mg og 800 mg dagligt versus placebo hos AIDS-patienter med anoreksi/kakeksi og signifikant vægttab. Af de 270 patienter, der deltog i studiet, opfyldte 195 alle inklusions – / eksklusionskriterier, havde mindst to yderligere vægtmålinger efter baseline over en 12 ugers periode eller havde en vægtmåling efter baseline, men faldt ud for terapeutisk svigt. Procentdelen af patienterne, der fik fem eller flere pund ved maksimal vægtøgning i 12 studieuger, var statistisk signifikant større for de 800 mg (64%) og 400 mg (57%) ma-behandlede grupper end for placebogruppen (24%). Gennemsnitlig vægt steg fra baseline til sidste evaluering i 12 studieuger i den 800 mg MA-behandlede gruppe med 7.8 pund, 400 mg MA-gruppen med 4,2 pund, 100 mg MA-gruppen med 1,9 pund og faldt i placebogruppen med 1,6 Pund. Gennemsnitlige vægtændringer efter 4, 8 og 12 uger for patienter, der kan vurderes for effekt i de to kliniske forsøg, vises grafisk. Ændringer i kropssammensætning i løbet af de 12 studieuger målt ved bioelektrisk impedansanalyse viste stigninger i kropsvægt uden vand i de MA-behandlede grupper (Se tabel over kliniske studier). Derudover udviklede eller forværredes ødem hos kun 3 patienter.
større procentdele af MA-behandlede patienter i 800 mg-gruppen (89%), 400 mg-gruppen (68%) og 100 mg-gruppen (72%) end i placebogruppen (50%) viste en forbedring af appetitten ved den sidste evaluering i løbet af de 12 studieuger. Der blev observeret en statistisk signifikant forskel mellem den 800 mg ma-behandlede gruppe og placebogruppen i ændringen i kalorieindtag fra baseline til tidspunktet for maksimal vægtændring. Patienter blev bedt om at vurdere vægtændring, appetit, udseende og generel opfattelse af velvære i en 9 spørgsmålsundersøgelse. Ved maksimal vægtændring gav kun den 800 mg MA-behandlede gruppe svar, der var statistisk signifikant mere gunstige for alle spørgsmål sammenlignet med den placebobehandlede gruppe. Et dosisrespons blev noteret i undersøgelsen med positive responser, der korrelerede med højere dosis for alle spørgsmål.
det andet forsøg var et multicenter, randomiseret, dobbeltblindt, placebokontrolleret studie, der sammenlignede megestrolacetat 800 mg/dag versus placebo hos AIDS-patienter med anoreksi / kakeksi og signifikant vægttab. Af de 100 patienter, der deltog i studiet, opfyldte 65 alle inklusions – / eksklusionskriterier, havde mindst to yderligere vægtmålinger efter baseline over en 12 ugers periode eller havde en vægtmåling efter baseline, men faldt ud for terapeutisk svigt. Patienter i den 800 mg ma-behandlede gruppe havde en statistisk signifikant større stigning i gennemsnitlig maksimal vægtændring end patienter i placebogruppen. Fra baseline til studieuge 12 steg den gennemsnitlige vægt med 11,2 pund i den MA-behandlede gruppe og faldt 2,1 pund i placebogruppen. Ændringer i kropssammensætning målt ved bioelektrisk impedansanalyse viste stigninger i ikke-vandvægt i den MA-behandlede gruppe (Se tabel over kliniske studier). Intet ødem blev rapporteret i den MA-behandlede gruppe. En større procentdel af MA-behandlede patienter (67%) end placebobehandlede patienter (38%) viste en forbedring af appetitten ved den sidste evaluering i løbet af de 12 studieuger; denne forskel var statistisk signifikant. Der var ingen statistisk signifikante forskelle mellem behandlingsgrupper i gennemsnitlig kalorieændring eller i daglig kaloriindtagelse til tiden til maksimal vægtændring. I den samme 9 spørgsmålsundersøgelse, der blev henvist til i det første forsøg, viste patienternes vurderinger af vægtændring, appetit, udseende og generel opfattelse af velvære stigninger i gennemsnitsscore hos MA-behandlede patienter sammenlignet med placebogruppen.
i begge forsøg tolererede patienterne lægemidlet godt, og der blev ikke set nogen statistisk signifikante forskelle mellem behandlingsgrupperne med hensyn til laboratorieanormaliteter, nye opportunistiske infektioner, lymfocyttal, T4-tællinger, T8-tællinger eller hudreaktivitet test (se ADVERSEREAKTIONS afsnit).
| Megestrol Acetate Oral Suspension Clinical Efficacy Trials | |||||||
| Trial 1 | Trial 2 | ||||||
| Study Accrual Dates | Study Accrual Dates | ||||||
| 11/88 to 12/90 | 5/89 to 4/91 | ||||||
| Megestrol Acetate, mg/day | 0 | 100 | 400 | 800 | 0 | 800 | |
| Entered Patients | 38 | 82 | 75 | 75 | 48 | 52 | |
| Evaluable Patients | 28 | 61 | 53 | 53 | 29 | 36 | |
| Mean Change in Weight (lb.) | |||||||
| Baseline to 12 Weeks | 0.0 | 2.9 | 9.3 | 10.7 | -2.1 | 11.2 | |
| % Patients ≥ 5 Pound Gain | |||||||
| At Last Evaluation in 12 weeks | 21 | 44 | 57 | 64 | 28 | 47 | |
| Mean Changes in Body Composition: | |||||||
| Fat Body Mass (lb.) | 0.0 | 2.2 | 2.9 | 5.5 | 1.5 | 5.7 | |
| Lean Body Mass (lb.) | -1.7 | -0.3 | 1.5 | 2.5 | -1.6 | -0.6 | |
| Water (liters) | -1.3 | -0.3 | 0.0 | 0.0 | -0.1 | -0.1 | |
| % Patients With Improved Appetite: | |||||||
| At Time of Maximum Weight Change | 50 | 72 | 72 | 93 | 48 | 69 | |
| At Last Evaluation in 12 Weeks | 50 | 72 | 68 | 89 | 38 | 67 | |
| Mean Change in Daily Caloric Intake: | |||||||
| Baseline to Time of Maximum Weight Change | -107 | 326 | 308 | 646 | 30 | 464 | |
| *Based on bioelectrical impedance analysis determinations at last evaluation in 12 weeks |
Presented below are the results of mean weight changes for patients evaluable for efficacy in trials 1 and 2.