Triphenylphosphin
PPh3 wird häufig in der organischen Synthese verwendet. Die Eigenschaften, die seine Verwendung leiten, sind seine Nukleophilie und sein reduzierender Charakter. Die Nukleophilie von PPh3 wird durch seine Reaktivität gegenüber elektrophilen Alkenen wie Michael-Akzeptoren und Alkylhalogeniden angezeigt. Es wird auch bei der Synthese von Biarylverbindungen wie der Suzuki-Reaktion verwendet.
quaternisierungbearbeiten
PPh3 verbindet sich mit Alkylhalogeniden zu Phosphoniumsalzen. Der Ablauf der Quaternisierungsreaktion folgt dem üblichen Muster, wobei benzylische und allylische Halogenide besonders effiziente Reaktionspartner sind:
PPh3 + CH3I → +I−
Diese Salze, die oft als kristalline Feststoffe isoliert werden können, reagieren mit starken Basen zu Yliden:
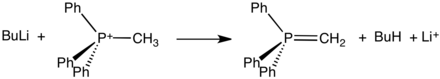
Solche Ylide sind Schlüsselreagenzien in den Wittig-Reaktionen, die zur Umwandlung von Aldehyden und Ketonen in Alkene verwendet werden.
Arylhalogenide quaternieren PPh3 zu Tetraphenylphosphoniumsalzen:
PPh3 + PhBr → Br
Die Reaktion erfordert jedoch erhöhte Temperaturen und Metallkatalysatoren.
Mitsunobu-Reaktionbearbeiten
Bei der Mitsunobu-Reaktion wandelt eine Mischung aus Triphenylphosphin und Diisopropylazodicarboxylat („DIAD“ oder sein Diethylanalogon, TOT) einen Alkohol und eine Carbonsäure in einen Ester um. Das DIAD wird reduziert, da es als Wasserstoffakzeptor dient, und das PPh3 wird zu OPPh3 oxidiert.
Appel-Reaktionbearbeiten
Bei der Appel-Reaktion wird eine Mischung aus PPh3 und CX4 (X = Cl, Br) verwendet, um Alkohole in Alkylhalogenide umzuwandeln. Triphenylphosphinoxid (OPPh3) ist ein Nebenprodukt.
PPh3 + CBr4 + RCH2OH → OPPh3 + RCH2Br + HCBr3
Diese Reaktion beginnt mit einem nukleophilen Angriff von PPh3 auf CBr4, einer Erweiterung der oben aufgeführten Quaternisierungsreaktion.
Desoxygenierungbearbeiten
Die leichte Oxygenierung von PPh3 wird bei seiner Verwendung zur Desoxygenierung organischer Peroxide ausgenutzt, was im Allgemeinen unter Beibehaltung der Konfiguration auftritt:
PPh3 + RO2H → OPPh3 + ROH (R = Alkyl)
Es wird auch für die Zersetzung von organischen Ozoniden zu Ketonen und Aldehyden verwendet, obwohl Dimethylsulfid für die Reaktion als Nebenprodukt beliebter ist, wird Dimethylsulfoxid leichter von der Reaktionsmischung getrennt als Triphenylphosphinoxid. Aromatische N-Oxide werden bei Raumtemperatur unter Bestrahlung in hoher Ausbeute zum entsprechenden Amin reduziert:
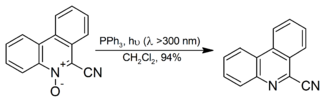
sulfonierungbearbeiten
Die Sulfonierung von PPh3 ergibt tris(3-sulfophenyl) phosphin, P(C6H4-3-SO3−)3 (TPPTS), das üblicherweise als Trinatriumsalz isoliert wird. Im Gegensatz zu PPh3 ist TPPTS wasserlöslich, ebenso wie seine Metallderivate. Rhodiumkomplexe von TPPTS werden in bestimmten industriellen Hydroformylierungsreaktionen verwendet.

Reduktion zu Diphenylphosphidedit
Lithium in THF sowie Na oder K reagieren mit PPh3 zu Ph2PM (M = Li, Na, K). Diese Salze sind vielseitige Vorläufer von tertiären Phosphinen. Beispielsweise reagieren 1,2-Dibromethan und Ph2PM zu Ph2PCH2CH2PPh2. Schwache Säuren wie Ammoniumchlorid wandeln pH Um2PM (M = Li, Na, K) in Diphenylphosphin:
(C6H5)2PM + H2O → (C6H5)2PH + MOH
Übergangsmetallkomplexedit
Triphenylphosphin bindet gut an die meisten Übergangsmetalle, insbesondere an die mittleren und späten Übergangsmetalle der Gruppen 7-10. In Bezug auf die sterische Masse weist PPh3 einen Tolman-Kegelwinkel von 145 ° auf, der zwischen denen von P (C6H11) 3 (170 °) und P (CH3) 3 (115 °) liegt. In einer frühen Anwendung in der Homogenkatalyse wurde NiBr2(PPh3)2 von Walter Reppe zur Synthese von Acrylatestern aus Alkinen, Kohlenmonoxid und Alkoholen verwendet. Die Verwendung von PPh3 wurde durch seine Verwendung im Hydroformylierungskatalysator RhH (PPh3) 3 (CO) populär gemacht.