Een speciale suiker: hoe siaalzuur invloed heeft op metabolisme, gezondheid en ziekte
we wemelen van microben die leven op oppervlakken buiten en in ons lichaam. Ons begrip van het darmmicrobioom in het bijzonder verbetert snel aangezien wij beginnen te losmaken hoe complexe microbiële gemeenschappen met ons dieet, met andere microben en met onze celoppervlakken in wisselwerking staan. Hoewel veel chemicaliën belangrijk zijn in dit milieu, richten we ons hier op sialische zuren als een kritische set moleculen die veel van deze interacties ondersteunen en invloed hebben op metabolisme, gezondheid en ziekte.
het meest voorkomende siaalzuur, N-acetyl-neuraminezuur (Neu5Ac) (Fig. 1) is een relatief eenvoudig suikerzuur dat, afgezien van zijn lading, er niets intrinsiek ongewoons aan heeft. Nochtans, wanneer cellen andere cellen contacteren gebruiken zij vaak molecules die op het oppervlak worden getoond, en dit is waar sialic zuren zo belangrijk worden, aangezien zij gewoonlijk de eindsuikers op de gastheerglycanen zijn die proteã nen en lipiden peper die op celoppervlakken zitten. Cel-oppervlak of afgescheiden mucine glycoproteïnen zijn goede voorbeelden van sialic zuur-gecoate structuren die microben kunnen tegenkomen op mucosale oppervlakken, zoals de respiratoire of gastro-intestinale (GI) tract. Deze unieke positie als ‘meet and greet’ molecuul voor andere menselijke cellen, bacteriële cellen en virussen plaatst de sialic zuren in het middelpunt van vele belangrijke processen.
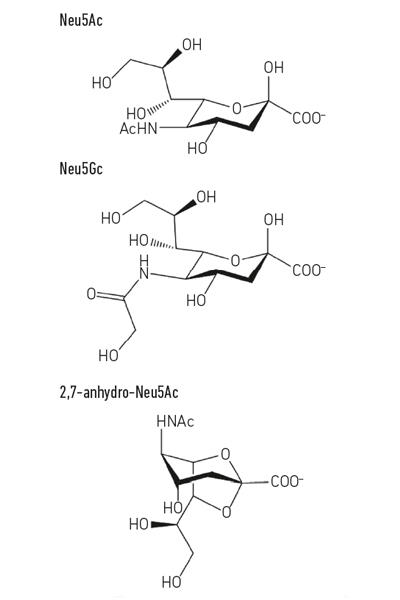
- Fig. 1. Voorbeeld van siaalzuurderivaten. Merk op dat het n-glycolyl-neurnaminezuur (Neu5Gc) niet kan worden gemaakt door mensen, een biochemisch verschil dat ons onderscheidt van andere mensapen, maar kan worden opgenomen in onze celoppervlakken wanneer verkregen uit het dieet.
- met suiker bedekte pathogenen
- Cross-feeding – het delen van de snoepjes rond
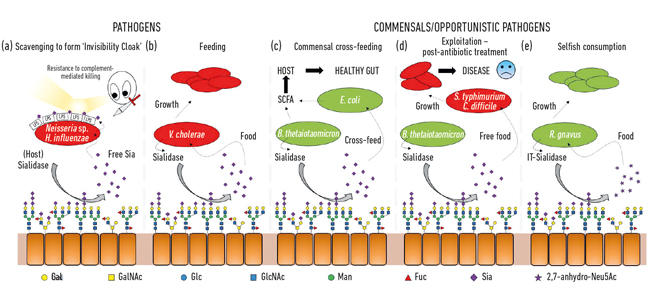
- Fig. 2. Beeldverhaalillustratie van de diverse interactie tussen bacteriën en sialic zuren huidig als eindsuikers op een waaier van gastheerglycanen. Deze worden gesplitst door sialidasen en meestal omgezet in vrij Neu5Ac met uitzondering van de IT-sialidase die 2,7-anhydro-Neu5Ac vrijmaakt. Vrij siaalzuur dat door gastheer of pathogene sialidasen vrijkomt, kan vervolgens door ziekteverwekkers worden gebruikt als onzichtbaarheidsmantel (a) of als voedermiddel (b). Het kruis voeden kan tussen leden van de darmmicrobiota of tussen commensale en pathogene bacteriën voorkomen die dezelfde niche delen (c, d) terwijl andere bacteriën zelfzuchtige mechanismen hebben ontwikkeld om sialic zuur voor hun eigen consumptie te reserveren (e).
- het bijhouden van uw eigen snoepjes
- virussen krijgen toegang tot de act
- verder lezen
- Andrew Bell
- Emmanuele Severi
- Nathalie Juge
- Gavin H. Thomas
- Waarom is microbiologie belangrijk?
- welk advies zou u geven aan iemand die in dit veld begint?
Fig. 1. Voorbeeld van siaalzuurderivaten. Merk op dat het n-glycolyl-neurnaminezuur (Neu5Gc) niet kan worden gemaakt door mensen, een biochemisch verschil dat ons onderscheidt van andere mensapen, maar kan worden opgenomen in onze celoppervlakken wanneer verkregen uit het dieet.
met suiker bedekte pathogenen
een van de eerste microbiële functies van siaalzuur was verbonden met het vermogen van sommige pathogenen om te koloniseren en vervolgens ziekte bij de mens te veroorzaken. De ex-voorzitter van de Microbiology Society, Professor Harry Smith FRS, werkzaam aan de Universiteit van Birmingham, was een pionier in dit werk met Neisseria gonorroe. Toen wetenschappers in zijn groep de bug direct uit het lichaam isoleren, was het resistent tegen het doden door menselijk serum (complementgemedieerde doden), maar als de bugs in het lab voor een paar generaties werden gekweekt, ging deze bescherming verloren en werden de cellen gedood door het serum. Zijn groep had ontdekt dat deze pathogenen siaalzuur uit de gastheer stelen en het gebruiken om hun eigen celoppervlak te bedekken om ze te humaniseren. Omdat ze dit siaalzuur echter alleen kunnen opvangen, betekent de afwezigheid ervan in groeimedia dat er geen siaalzuur meer wordt toegevoegd, zodat ze snel deze ‘serumbescherming’ verliezen en worden gedood. Het blijkt dat een aantal andere stiekeme bugs vergelijkbare strategieën gebruiken om hun eigen onzichtbaarheidsmantel te genereren met behulp van siaalzuur, zoals Neisseria meningitidis, Campylobacter jejuni of Haemophilus influenzae( Fig. 2a)
Cross-feeding – het delen van de snoepjes rond
sialic zuren worden niet alleen gebruikt door ziekteverwekkers als onzichtbaarheidsmantel, maar zijn ook vrij goed voedsel voor bacteriën, omdat ze zowel koolstof als stikstof leveren en kunnen worden gebruikt als energiebron. Eerder onderzoek toonde aan dat ziekteverwekkers zoals Vibrio cholerae graag sialische zuren aten en dat op zich belangrijk was voor een succesvolle kolonisatie van de gastheer (Fig. 2b).
in de darm komt een belangrijke bron van siaalzuur uit mucines, de belangrijkste structurele componenten van de slijmlaag die het epitheel oppervlak bedekt. De meest blootgestelde laag van slijm is de habitat van verschillende commensale bacteriën, die hebben geleerd hoe te smullen op mucine eiwitten, waar suikers maken 80% van hun massa. Vanuit een eenvoudig topologisch perspectief worden de sialic zuren, als eindsuikers, eerst geoogst, waardoor de onderliggende suikers worden blootgelegd die vervolgens ook kunnen worden vrijgegeven en gegeten. Met de komst van het volgende-generatie rangschikken, hebben wij kennis over de microben die in dit gebied leven opgedaan, en velen hebben genen voor sialic zure opname en het daaropvolgende katabolisme. Wat spannend was, was de ontdekking dat sommige commensale anaëroben, zoals Bacteroides thetaiotaomicron, sialidasen afscheiden om het siaalzuur vrij te geven, maar geen transporters en katabole genen hebben om het daadwerkelijk te gebruiken. Dit schijnbaar altruïstische gebaar is nodig voor de bacteriën om toegang te krijgen tot de onderliggende suikers en ondersteunt een proces van metabolische cross-voeding aan andere insecten die in de slijm niche leven, zoals commensale Escherichia coli stammen die geen sialidase hebben, maar goed zijn in het eten van vrij siaalzuur (Fig. 2c). Dit concept wordt nu erkend als een belangrijk aspect van kolonisatie en niche-adaptatie. Een briljant voorbeeld hiervan werd beschreven door de groep van Justin Sonnenburg van Stanford University, met behulp van een muismodel met een eenvoudige gedefinieerde darm microbiota. Na behandeling met antibiotica werden veel van de sialic-zuur-etende bacteriën weggevaagd, resulterend in de accumulatie van vrij sialic zuur in de darm. Wanneer vervolgens uitgedaagd met pathogenen zoals Salmonella typhimurium of Clostridium difficile, zouden deze pathogenen profiteren van het vrije siaalzuur als voedingsstof (Fig. 2d). De mutantstammen van ziekteverwekkers die de transporters of katabole genen ontbraken hadden geen voordeel, makend een directe verbinding met ziekteverwekkeruitgroei wanneer de microbiële gemeenschap van de darm wordt verstoord. Daarom werden mechanismen voorgesteld om de pool van vrij siaalzuur in de darm te verminderen als onderdeel van een nieuwe infectiebestrijdingsstrategie.
Fig. 2. Beeldverhaalillustratie van de diverse interactie tussen bacteriën en sialic zuren huidig als eindsuikers op een waaier van gastheerglycanen. Deze worden gesplitst door sialidasen en meestal omgezet in vrij Neu5Ac met uitzondering van de IT-sialidase die 2,7-anhydro-Neu5Ac vrijmaakt. Vrij siaalzuur dat door gastheer of pathogene sialidasen vrijkomt, kan vervolgens door ziekteverwekkers worden gebruikt als onzichtbaarheidsmantel (a) of als voedermiddel (b). Het kruis voeden kan tussen leden van de darmmicrobiota of tussen commensale en pathogene bacteriën voorkomen die dezelfde niche delen (c, d) terwijl andere bacteriën zelfzuchtige mechanismen hebben ontwikkeld om sialic zuur voor hun eigen consumptie te reserveren (e).
het bijhouden van uw eigen snoepjes
terwijl veel vroege sialomicrobiologie zich richtte op pathogenen, is meer recent onderzoek gericht op de commensale bacteriën die in dezelfde niche leven. De hedendaagse studies op het gebied van de darmmicrobiota laten zien hoe fel de concurrentie voor Neu5Ac in onze darmen is en hoe het de balans tussen pathogenen en commensalen kan doen veranderen. Wat als een bepaalde bacterie siaalzuur kan afgeven in een vorm die alleen hij kan bereiken? Onderzoek in de Juge-groep in Norwich toonde aan dat de darmsymbiont Ruminococcus gnavus daartoe geëvolueerd is door gebruik te maken van een speciaal type sialidase, een intramoleculaire trans-sialidase (IT-sialidase), die 2,7-anhydro-Neu5Ac vrijmaakt (zie Fig. 1) in plaats van Neu5Ac. Door een methode te ontwikkelen om zuivere 2,7-anhydro-Neu5Ac te synthetiseren, toonden ze aan dat R. gnavus stammen konden groeien op 2,7-anhydro-Neu5Ac als enige koolstofbron. Naast het domein dat de enzymatische reactie katalyseert, omvatten IT-sialidases een koolhydraatbindend domein dat helpt om de binding van IT-sialidase aan siaalzuurrijke mucines te bemiddelen. In vivo, kan dit een mechanisme dat helpt richten de bacteriën naar sialic zure rijke gebieden van de GI-tract begunstigen, daarom bevorderend bacteriële kolonisatie binnen de slijmlaag. Eenmaal gelegen op de juiste plaats, de IT-sialidase splijt siaalzuur uit de terminale ketens van mucines en geeft het in een vorm, 2,7-anhydro-Neu5Ac, dat R. gnavus kan gebruiken als zijn eigen bron van voedsel, in plaats van het delen van Neu5Ac met andere bacteriën bewonen de slijm niche, met inbegrip van pathogenen (Fig. 2e). Dit mechanisme biedt een concurrentievoordeel ten opzichte van andere sialic-zuur – etende bacteriën bewonen de slijm niche, door het verstrekken van een bron van voedingsstoffen die het bij voorkeur kan toegang. Daarnaast kan R. gnavus ook helpen bij het verminderen van de uitgroei van enterische pathogenen door het niveau van Neu5Ac in de mucosale omgeving te verlagen, waardoor wegen worden geopend voor een nieuwe therapeutische strategie in een tijdperk van toenemende antibioticaresistentie.
virussen krijgen toegang tot de act
virussen gebruiken ook sialische zuren als sleutelmoleculen tijdens hun infectiecyclus, het meest bekende influenzavirus. De eerste gehechtheid is de eerste belangrijke stap aangezien sialic zuren als receptoren voor het virus op ademhalingsepitheliaale cellen functioneren. Het type koppeling van het siaalzuur aan de onderliggende suikers in de glycanen controleert vaak het gastheerbereik van influenzavirussen, en pandemische stammen hebben vaak adhesieproteïne (hemagglutinine) dat de humane vormen van siaalzuurhechting herkent en dus bijzonder virulent zijn. Sialic zuur is belangrijk in het laatste stadium in de virale levenscyclus aangezien de versie van de besmette cel splitsing van sialic zuren van de oppervlakte van de gastheercel vereist. Dit wordt gekatalyseerd door een viraal enzym genaamd sialidase (of neuraminidase). Remming van dit enzym door structurele analogen van siaalzuur, geformuleerd in Tamiflu® (oseltamivirfosfaat) en Zanamivir, zijn onze frontlinie behandeling voor influenza en zijn een triomf van structuur/functie geïnspireerd geneesmiddel ontwerp.
concluderend is het duidelijk dat sialic zuren kritische moleculen zijn in veel processen waarin microbiële cellen en virussen interageren met zoogdierceloppervlakken. In dit korte artikel hebben we enkele van deze besproken om een idee te geven van de centrale functies van deze suikers in communicatie, stealth, kolonisatie en metabolisme in verschillende aspecten van gezondheid en ziekte. Sialic zuren zijn beschreven als de belangrijkste chemische stoffen in de wereld en zullen ongetwijfeld meer over de evolutie van de mens en hun interactie met hun microben blijven onthullen.
verder lezen
Thomas, GH. Acquisitie van siaalzuur in bacteriën-één substraat, veel transporters. Biochem Soc Trans 2016; 44: 760-765.
Ng KM, Ferreyra JA, Higginbottom SK, Lynch JB, Kashyap PC et al. Microbiota-bevrijde gastheersuikers vergemakkelijken post-antibiotische uitbreiding van enterische ziekteverwekkers. Natuur 2013; 502: 96-99.
Owen CD, Tailford LE, Monaco S, Šuligoj T, Vaux L et al. Het ontrafelen van de specificiteit en het mechanisme van de herkenning van siaalzuur door de darmsymbiont Ruminococcus gnavus. Nat Commun 2017; 8: 2196.Tailford LE, Owen CD, Walshaw J, Crost EH, Hardy-Goddard J, Le Gall G, De Vos WM, Taylor GL, Juge N. Discovery of intramolecular trans-sialidases in human gut microbiota suggests novel mechanisms of mucosal adaptation. Nat Commun 2015; 6: 7624.
Juge N, Tailford L, Owen CD. Sialidasen van darmbacteriën: een mini-review. Biochem Soc Trans 2016; 44: 166-175.

Andrew Bell
Quadram Institute Bioscience, Norwich Research Park, NR4 7UQ, UK
Andrew Bell is een postdoctorale student op de afdeling Gut microben en gezondheid van het Quadram Institute die de impact bestudeert van een nieuw mechanisme van het metabolisme van sialinezuur op de gut homeostase. Hij behaalde zijn BSc in biochemie aan de Universiteit van East Anglia en werkte 2 jaar bij het John Innes Centre over chlorofylmetabolisme in pea (Pisum sativum) voordat hij in 2015 bij Nathalie Juge ‘ s groep aan het Quadram Institute kwam voor zijn doctoraal werk.

Emmanuele Severi
Department of Biology, University of York, Wentworth Way, York YO10 5DD, UK
@emm_severi
Emmanuele Severi is een post-doctoral research associate in the Department of Biology aan de Universiteit van York en werkt in het laboratorium van prof. Gavin Thomas. Hij heeft op verschillende momenten in zijn carrière gewerkt aan het transport en de stofwisseling van siaalzuur en is sinds 2002 lid van de Vereniging.

Nathalie Juge
Quadram Institute Bioscience, Norwich Research Park, NR4 7UQ, UK
Nathalie Juge is een onderzoeksleider aan het Quadram Institute Bioscience (QIB) in Norwich, plaatsvervangend leider van het Institute Strategic Programme, the Gut microben and Health (GMH), en ereprofessor aan de School of Biological Sciences, University of East Anglia. Ze leidt een onderzoeksgroep over de glycobiologie van gastheer-microbe interacties in de darm met een focus op mucine-afgeleid siaalzuurmetabolisme door de darmmicrobiota (https://quadram.ac.uk/nathalie-juge).

Gavin H. Thomas
Department of Biology, University of York, Wentworth Way, York YO10 5DD, UK
@GavinHThomas
Gavin H. Thomas is een prof.in de afdeling biologie van de Universiteit van York en heeft meer dan een decennium gewerkt aan bacterieel siaalzuurtransport en katabolisme. Hij is lid van de Society sinds 1995, was redacteur van Microbiology Today (2003-2006), diende in de Raad in dezelfde periode, diende in het Communicatiecomité (2012-2015) en het Equality & Diversity committee (2013-2015). Hij was redacteur, Senior Editor en is nu Adjunct-hoofdredacteur van het toonaangevende tijdschrift Microbiologie van de Society (http://thomaslabyork.weebly.com).
Waarom is microbiologie belangrijk?
Gavin: Het is belangrijk voor onze gezondheid – pas nu beginnen we echt de moleculaire samenstelling en functie van ons microbioom te begrijpen, die waarschijnlijk invloed heeft op ons lichaam op verschillende manieren.
welk advies zou u geven aan iemand die in dit veld begint?
Gavin: lees op grote schaal en verder dan ‘je bug’ – microben kunnen vrijwel alles doen en hebben meestal meerdere verschillende manieren uitgevonden om het te doen!
afbeeldingen: H3N2 influenzavirusdeeltjes. CDC / Science fotobibliotheek.
Fig. 1. Andrew Bell.
Fig. 2. Emmanuele Severi.