Células gliales de la Retina por Helga Kolb
Helga Kolb
Tres tipos básicos de células gliales se encuentran en la retina humana, las células Muller, la astroglia y la microglia. Todas fueron descritas para la retina por Cajal hace más de cien años (1892).
1. Celdas Muller.
Las células de Muller son la célula glial principal de la retina. Forman estructuras arquitectónicas de soporte que se extienden radialmente a través del grosor de la retina y son los límites de la retina en la membrana limitante externa e interna, respectivamente. Una comprensión completa de la forma de una célula de Muller se ve mejor después de la tinción de Golgi, como se muestra originalmente en Cajal (1892) a continuación.
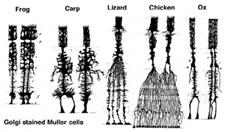
Fig. 1. Células Muller teñidas de Golgi
Los cuerpos de células Muller se sientan en la capa nuclear interna y proyectan procesos irregularmente gruesos y delgados en cualquier dirección hacia la membrana limitadora externa y hacia la membrana limitadora interna. Los procesos celulares de Muller se insinúan entre los cuerpos celulares de las neuronas en las capas nucleares y los grupos envolventes de procesos neuronales en las capas plexiformes (Fig. 1). De hecho, a los procesos neuronales de la retina solo se les permite el contacto directo, sin envolver los procesos celulares de Muller, en sus sinapsis.
Una sola célula progenitora da lugar a células Muller y neuronas retinianas(Turner y Cepko, 1987), aunque aparentemente en dos fases. Las neuronas de fase más temprana nacidas en el margen apical del neuroepitelio adyacente al epitelio pigmentario producen neuronas primarias que consisten en células cónicas, células horizontales y células ganglionares (Fig. 2, derecha). La segunda fase de células nacidas también en los márgenes apicales produce células Muller y fotorreceptores de bastones, células bipolares y células amacrinas (Reichenbach y Robinson, 1995) (Fig. 2, izquierda). Todas las neuronas en desarrollo y las células de Muller tienen que migrar hacia adentro a su posición final y se cree que los procesos y troncos de las células de Muller guían gran parte de las migraciones neuronales y dirigen las diferenciaciones neuronales.
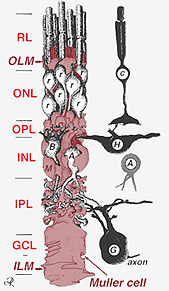
Fig. 2. Dibujo esquemático en 3D de la relación entre la célula de Muller y otras neuronas retinianas
Las uniones que forman la membrana limitante externa se encuentran entre las células de Muller y otras células de Muller y las células fotorreceptoras como desmosomas resistentes o adherentes de zonula. En algunas especies, las uniones gap (asociaciones de membrana especializadas y canales que permiten el paso de pequeñas moléculas e iones) o las uniones apretadas forman parte de estas uniones de células Muller (Miller y Dowling, 1970), pero no es así en especies de mamíferos donde nunca se ha observado un acoplamiento de tinte (Robinson et al., 1993; Reichenbach y Robinson, 1995). La superficie de la célula de Muller frente al epitelio pigmentario y el espacio subretiniano se expande por muchas proyecciones de la membrana de la célula de Muller conocidas como vellosidades apicales. La membrana limitante interna, por otro lado, está formada por el extremo cónico de la célula Muller, pero aquí no se ven uniones especializadas. Las células de Muller también se forman en las patas finales de los grandes vasos sanguíneos de la retina en la superficie interna de la retina. La superficie de la membrana celular Muller frente al vítreo está cubierta con un material mucopolisacárido y, por lo tanto, forma una verdadera membrana basal.
Las células Muller contienen glucógeno, mitocondrias y filamentos intermedios que son inmunoreativos de la vimentina y, en cierta medida, de la proteína ácida fibrilar glial (GFAP). Estos últimos filamentos se encuentran normalmente en la mitad interna de las células de Muller retinianas y sus patas finales (Fig. 3, izquierda), pero después de un traumatismo en la retina, como un desprendimiento de retina, tanto la vimentina como la GFAP se regulan masivamente y se encuentran en toda la célula (Fig. 3, derecha) (Guerin et al., 1990; Fisher y Lewis, 1995).
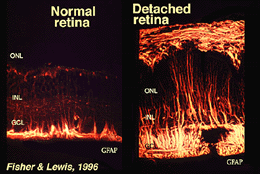
Fig. 3. Inmunorreactividad GFAP en células de Muller
Las células de Muller tienen una gama de funciones que son vitales para la salud de las neuronas de la retina. Las células de Muller funcionan en una relación simbiótica con las neuronas (para una excelente revisión ver Reichenbach y Robinson, 1995). Por lo tanto, las funciones de las células Muller incluyen:
- Suministrar productos finales de metabolismo anaeróbico (descomposición del glucógeno) para alimentar el metabolismo aeróbico en las células nerviosas.
- Limpian los productos de desecho neuronales, como el dióxido de carbono y el amoníaco, y reciclan los transmisores de aminoácidos usados.
- Protegen a las neuronas de la exposición a un exceso de neurotransmisores, como el glutamato, utilizando mecanismos de captación bien desarrollados para reciclar este transmisor. Se caracterizan particularmente por la presencia de altas concentraciones de glutamina sintasa.
- Pueden estar involucrados tanto en la fagocitosis de desechos neuronales como en la liberación de sustancias neuroactivas como GABA, taurina y dopamina.
- Se cree que sintetizan ácido retinoico a partir del retinol (se sabe que el ácido retinoico es importante en el desarrollo del ojo y el sistema nervioso) (Edwards, 1994)
- Controlan la homeostasis y protegen a las neuronas de cambios perjudiciales en su entorno iónico al tomar K+ extracelular y redistribuirlo.
- Contribuyen a la generación de la onda b del electrorretinograma (ERG) (Miller y Dowling, 1970; Newman y Odette, 1984), el componente P3 lento del ERG (Karwoski y Proenza, 1977) y la respuesta de umbral escotópico (STR) (Frishman y Steinberg, 1989). Lo hacen mediante la regulación de la distribución de K+ a través del borde vítreo de la retina, a través de toda la retina y localmente en la capa plexiforme interna de la retina (Fig. 4, de Reichenbach y Robinson, 1995, adaptado de Newman, 1989).

Fig. 4. Regulación de K + por células de Muller en células de Muller
2. Astrocitos.
Los astrocitos no son células gliales del neuroepitelio retiniano, sino que ingresan a la retina en desarrollo desde el cerebro a lo largo del nervio óptico en desarrollo (Stone y Dreher, 1987; Chan-Ling, 1994). Tienen una morfología característica de un cuerpo celular aplanado y una serie fibrosa de procesos radiantes. Los filamentos intermedios llenan sus procesos y, por lo tanto, se tiñen drásticamente con anticuerpos contra GFAP (Schnitzer, 1988). Los cuerpos y procesos celulares de los astrocitos están restringidos casi por completo a la capa de fibra nerviosa de la retina. Su morfología cambia de la periferia a la cabeza del nervio óptico: de una forma estrellada simétrica en la retina periférica (Figs. 5a y b) (Schitzer, 1988) a extremadamente alargado cerca del nervio óptico (Fig. 6 y 7).
 Fig. 5a. Astrocitos en retina periférica. Schnitzer, 1988 |
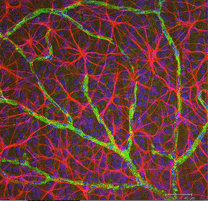 Fig. 5b. Astrocitos (rojos) en la retina de rata entre células ganglionares (azules) y asociados con vasos sanguíneos (verdes). Cortesía de Laura Fernández-Sánchez y Nicolás Cuenca |
En la tinción inmunocitoquímica (Fig. 5b) y en inyecciones intracelulares de PRH (Fig. 7) los astrocitos manchados exhiben claramente procesos alineados a lo largo de los axones de las células ganglionares que corren a través de la capa de fibra nerviosa. En la distribución, los astrocitos alcanzan su pico en la cabeza del nervio óptico y tienen una disminución bastante uniforme en la densidad de los anillos radiantes de la cabeza del nervio. No están presentes en la fóvea avascular u ora serrata.
 Fig. 6. Astrocitos en la retina central. Schnitzer, 1988 |
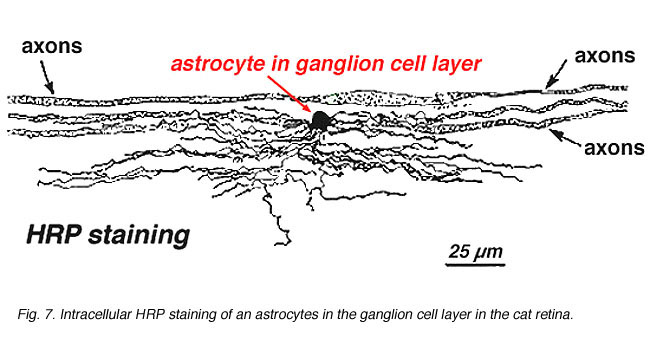 Fig. 7. Astrocitos en retina de gato teñidos por inyección intracelular de PRH. Cortesía de Ralph Nelson. |
Los astrocitos gruesos y delgados se han distinguido sobre la base de la tinción con anticuerpos contra la GFAP (Trevino et al., 1996). Así, los astrocitos están dispuestos sobre la superficie de los haces de axones de las células ganglionares a medida que avanzan hacia la cabeza del nervio óptico formando un tubo a través del cual corren los axones (Fig. 8). Se han descrito uniones Gap y uniones zonula adherens entre procesos astrocíticos en retina de gato (Höllander et al., 1991).
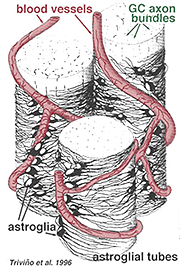
Fig. 8. Bloque 3-D de astrocitos dispuestos sobre la superficie de los haces de axones de células ganglionares
Los vasos sanguíneos que corren dentro y entre los haces de células ganglionares también están cubiertos por ambos procesos e incluso un cuerpo celular ocasional de un astrocito. La función de los astrocitos que envuelven los axones de las células ganglionares y la relación con los vasos sanguíneos de la capa de fibra nerviosa sugiere que son vainas gliales axonales y vasculares y parte de una barrera hematoencefálica. Al igual que las células Muller, se sabe que contienen abundante glucógeno y pueden formar un servicio nutritivo para proporcionar glucosa a las neuronas. Además, probablemente desempeñan un papel en la homeostasis iónica en la regulación de los niveles extracelulares de potasio y el metabolismo de neurotransmisores como el GABA.
3. Células microgliales.
El tercer tipo de células gliales es supuestamente de origen mesodérmico y, por lo tanto, estrictamente hablando, no son neurogliales como lo son los astrocitos y las células Muller. Entran en la retina coincidiendo con los precursores mesenquimatosos de los vasos sanguíneos retinianos en desarrollo (Chan-Ling, 1994). Las células microgliales son ubicuas en la retina humana y se encuentran en cada capa de la retina.
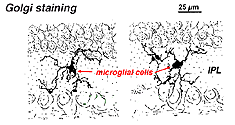
En la retina manchada de Golgi parecen formas extrañas y multipolares con cuerpos de células pequeñas y procesos cortos irregulares. De hecho, en las preparaciones de Golgi a veces se las ha confundido con células nerviosas, especialmente cuando se encuentran en una capa nuclear con una sola orientación de sus procesos en la capa plexiforme.
Fig. 9. La tinción de Golgi de células microgliales
Las células microgliales pueden ser de dos tipos. Se cree que una forma ingresa a la retina en las primeras etapas de desarrollo desde el mesénquima del nervio óptico y permanece latente en las capas retinianas durante gran parte de la vida de la retina. La otra forma de microglía parece ser células de transmisión sanguínea, posiblemente originadas de pericitos de vasos (Boycott y Hopkins, 1981; Gallego, 1986). Ambos tipos pueden ser estimulados a una función macrofágica después de un trauma en la retina, y luego participan en la fagocitosis de neuronas retinianas degeneradas.

Fig. 10a. Célula microglial teñida de lectina de Chan-Lin, 1994.
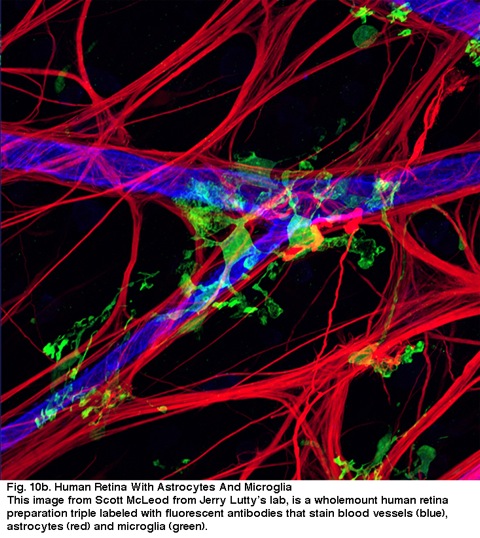
Fig. 10b. Retina humana con Astrocitos y Microglía. Esta imagen de Scott McLeod, del laboratorio de Jerry Lutty, es una preparación completa de retina humana de triple lanel con anticuerpos fluorescentes que tiñen los vasos sanguíneos (azules), los astrocitos (rojos) y la microglía (verde).
4. Referencia.
Boicot BB, Hopkins JM. Microglía en la retina de monos y otros mamíferos; su distinción de otros tipos de glía y células horizontales. Neurociencia.1981;6:679–688.
Cajal SR. En: Thorpe SA, Glickstein M, traductores. 1892. La estructura de la retina. Springfield (IL): Thomas; 1972.
Chan-Ling T. Interacciones gliales, neuronales y vasculares en la retina de los mamíferos. Prog. Ret. Eye Res. 1994; 13: 357-389.
Edwards RB. Biosíntesis del ácido retinoico por células gliales de Müller: ¿un modelo para el sistema nervioso central? Prog. Ret. Eye Res. 1994; 13: 231-242.
Fisher SK, Lewis GP. Fotorreceptores y más allá: efectos celulares y moleculares del desprendimiento de retina.2do Simposio de Ciencias Visuales de la Gran Cuenca, II, University of Utah Press. 1995
Frishman LJ, Steinberg RH. Aumentos de o evocados por la luz en la porción proximal de la retina del gato adaptada a la oscuridad. J Neurofisiol. 1989;61:1233–1243.
Gallego A. Estudios comparativos sobre células horizontales y una nota sobre células microgliales. Prog. Ret. Res. 1986; 5: 165-206.Guerin CJ, Anderson DH, Fisher SK. Los cambios en el inmunomarcaje de filamentos intermedios se producen en respuesta al desprendimiento de retina y al reenganche en primates.Invertir. Oftal. Vis. Sci. 1990;31:1474–1482.
Karwoski CJ, Proenza LM. Relación entre las respuestas de las células de Muller, un potencial transretiniano local y el flujo de potasio. J Neurofisiol. 1977;40:244–259.
Miller RF, Dowling JE. Respuestas intracelulares de las células Muller (gliales) de la retina mudpuppy: su relación con la onda b del electrorretinograma. J Neurofisiol.1970;33:323–341.
Newman EA, Odette LL. Modelo de generación de ondas b de electrorretinograma: una prueba de la hipótesis K+. J Neurofisiol. 1984;51:164–182.
EA de Newman. Electrofisiología de las células gliales de la retina. Prog. Ret. Res. 1989; 8: 153-172.
Reichenbach A, Robinson SR. Compromiso de las células de Müller en la retina externa. En: Djamgoz MBA, Archer SN, Vallerga S, editores. Neurobiología y aspectos clínicos de la retina externa. London: Chapman & Hall; 1995. p. 395-416.Robinson SR, Hampson ECGM, Munro MN, Vaney DI. Acoplamiento unidireccional de uniones de separación entre neuroglia. Proc. Austr. Neurociencia. Soc. 1993;3:167.
Schnitzer J. Astrocitos en retina de mamíferos. Prog. Ret. Res. 1988; 7: 209-232.
Stone J, Makarov F, Hollander H. The glial ensheathment of the soma and axon hillock of retinal ganglion cells. Vis Neurosci. 12:273–279.
Stone J, Dreher Z. Relación entre astrocitos, células ganglionares y vasculatura de la retina. J Comp Neurolog. 1987;255:35–49.
Trivino A, Ramirez JM, Salazar JJ, Ramirez AI, Garcia-Sanchez J. Estudio inmunohistoquímico de astroglia de cabeza de nervio óptico humano. Visión Res. 1996; 36: 2015-2028.
Turner DL, Cepko CL. Un progenitor común para las neuronas y la glía persiste en la retina de rata al final del desarrollo. Naturaleza. 1987;328:131–136.