Etiqueta: Suspensión de acetato de MEGACE ES – megestrol
FARMACOLOGÍA CLÍNICA
Existen varios métodos analíticos utilizados para estimar las concentraciones plasmáticas de acetato de megestrol, incluida la cromatografía de gases-fragmentografía de masa (GC-MF), la cromatografía líquida de alta presión (HPLC) y el radioinmunoanálisis (RIA). Los métodos GC-MF y HPLC son específicos para acetato de megestrol y concentraciones equivalentes de rendimiento. El método RIA reacciona a los metabolitos de acetato de megestrol y, por lo tanto, es inespecífico e indica concentraciones más altas que los métodos GC-MF y HPLC. Las concentraciones plasmáticas dependen, no solo del método utilizado, sino también de la inactivación intestinal y hepática del fármaco, que puede verse afectada por factores como la motilidad del tracto intestinal, las bacterias intestinales, los antibióticos administrados, el peso corporal, la dieta y la función hepática.
Mecanismo de acción
Varios investigadores han informado sobre la propiedad de aumento del apetito del acetato de megestrol y su posible uso en caquexia. El mecanismo preciso por el cual el acetato de megestrol produce efectos en la anorexia y la caquexia se desconoce en la actualidad.
Propiedades farmacocinéticas:
Las concentraciones plasmáticas de acetato de megestrol después de la administración de 625 mg (125 mg/ml) de suspensión oral de Megace® ES son equivalentes en condiciones de alimentación a 800 mg (40 mg/ml) de suspensión oral de acetato de megestrol (ver figura a continuación).
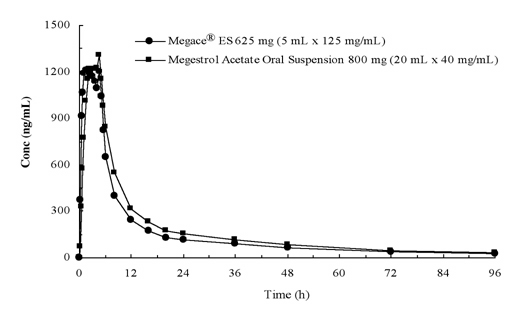
Con el fin de caracterizar la proporcionalidad de la dosis de Megace® ES, se realizaron estudios farmacocinéticos en un rango de dosis cuando se administraron en condiciones de ayuno y alimentación. La farmacocinética de megestrol fue lineal en el rango de dosificación entre 150 mg y 675 mg después de la administración de Megace® ES, independientemente del estado de las comidas. La Cmax y el AUC en una comida rica en grasas aumentaron en un 48% y un 36%, respectivamente, en comparación con aquellos en ayunas después de la administración de 625 mg de Megace® ES (Tabla 1). Sin embargo, una comida rica en grasas aumentó significativamente el AUC y la Cmax de megestrol a 2 y 7 veces, respectivamente, en comparación con aquellos en ayunas después de la administración de 800 mg en la formulación original. No hubo diferencia en la seguridad después de la administración en el estado de alimentación, por lo tanto, Megace® ES se podía tomar sin tener en cuenta las comidas.
|
*megestrol acetate oral suspension |
||||||||||||||||
| Table 1 – Pharmacokinetic Studies Conducted with Megace® ES | ||||||||||||||||
| Amount Dosed | 150 mg | 250 mg | 375 mg | 450 mg | 575 mg | 625 mg | 675 mg | 800 mg* | ||||||||
| Dose | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 20 mL | ||||||||
| Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | |
| Cmax (ng/mL) | 412 | 379 | 647 | 588 | 810 | 958 | 955 | 1079 | – | 1421 | 1133 | 1618 | 1044 | 1616 | 187 | 1364 |
| AUC0-∞ (ng∙h/mL) | 3058 | 3889 | 5194 | 6328 | 7238 | 12193 | 9483 | 11800 | – | 14743 | 12095 | 16268 | 11879 | 17029 | 8942 | 18625 |
| Tmax (h) | 1.74 | 3.80 | 1.58 | 3.38 | 1.56 | 3.42 | 1.74 | 3.16 | – | 3.75 | 1.72 | 2.91 | 1.96 | 2.76 | 5.89 | 3.85 |
Se evaluó la farmacocinética plasmática en estado estacionario del acetato de megestrol en 10 pacientes adultos varones caquécticos con síndrome de inmunodeficiencia adquirida (SIDA) y una pérdida de peso involuntaria superior al 10% del valor basal. Los pacientes recibieron dosis orales únicas de 800 mg/día de suspensión oral de acetato de megestrol durante 21 días. Los datos de concentración plasmática obtenidos el día 21 se evaluaron hasta 48 horas después de la última dosis.
La concentración plasmática máxima (Cmax) media (±1SD) de acetato de megestrol fue de 753 (±539) ng/ml. El área media bajo la curva de concentración-tiempo (AUC) fue de 10.476 (±7.788) ng x h/ml. La mediana del valor de Tmax fue de cinco horas. Siete de cada 10 pacientes aumentaron de peso en tres semanas.
Además, se administró una dosis diaria de 750 mg de suspensión oral de acetato de megestrol a 24 hombres adultos, asintomáticos seropositivos al VIH. El tratamiento se administró durante 14 días. Los valores medios de Cmax y AUC fueron de 490 (±238) ng/ml y 6779 (±3048) hr x ng/ml, respectivamente. La mediana del valor de Tmax fue de tres horas. El valor medio de Cmax fue de 202 (±101) ng/ml. El porcentaje medio del valor de fluctuación fue de 107 (±40).
Metabolismo
Los metabolitos de acetato de megestrol identificados en la orina constituyeron del 5% al 8% de la dosis administrada. La excreción respiratoria como dióxido de carbono marcado y el almacenamiento de grasa pueden haber representado al menos parte de la radiactividad que no se encuentra en la orina y las heces.
Eliminación
La principal vía de eliminación de fármacos en humanos es la orina. Cuando se administró acetato de megestrol radiomarcado a seres humanos en dosis de 4 a 90 mg, la excreción urinaria en 10 días osciló entre el 56,5% y el 78,4% (media del 66,4%) y la excreción fecal entre el 7,7% y el 30,3% (media del 19,8%). La radiactividad total recuperada varió entre el 83,1% y el 94,7% (media del 86,2%).
Poblaciones especiales
No se ha estudiado la farmacocinética del acetato de megestrol en ninguna población especial.
FARMACOLOGÍA Y/O TOXICOLOGÍA ANIMAL
El tratamiento a largo plazo con Megace ® ES (acetato de megestrol) puede aumentar el riesgo de infecciones respiratorias. Se observó una tendencia al aumento de la frecuencia de infecciones respiratorias, disminución del recuento de linfocitos y aumento del recuento de neutrófilos en un estudio de toxicidad/carcinogenicidad crónica de dos años con acetato de megestrol realizado en ratas.
DESCRIPCIÓN DE LOS ESTUDIOS CLÍNICOS
La suspensión oral de acetato de Megestrol a una dosis de 800 mg/20 ml equivale a 625 mg/5 ml de Megace ® ES. La eficacia clínica de la suspensión oral de acetato de megestrol se evaluó en dos ensayos clínicos. Uno fue un estudio multicéntrico, aleatorizado, doble ciego, controlado con placebo que comparó acetato de megestrol (MA) en dosis de 100 mg, 400 mg y 800 mg por día versus placebo en pacientes de SIDA con anorexia/caquexia y pérdida de peso significativa. De los 270 pacientes incluidos en el estudio, 195 cumplieron todos los criterios de inclusión/exclusión, tuvieron al menos dos mediciones adicionales de peso después de la línea de base durante un período de 12 semanas o tuvieron una medición de peso después de la línea de base, pero abandonaron el estudio por fracaso terapéutico. El porcentaje de pacientes que aumentaron cinco o más libras al aumento máximo de peso en 12 semanas de estudio fue estadísticamente significativamente mayor para los grupos tratados con MA de 800 mg (64%) y 400 mg (57%) que para el grupo de placebo (24%). El peso medio aumentó desde el valor basal hasta la última evaluación en 12 semanas de estudio en el grupo tratado con 800 mg de MA en 7.8 libras, el grupo de 400 mg de MA en 4.2 libras, el grupo de 100 mg de MA en 1.9 libras y disminuyó en el grupo de placebo en 1.6 libras. Se muestran gráficamente los cambios medios de peso a las 4, 8 y 12 semanas en pacientes evaluables en cuanto a la eficacia en los dos ensayos clínicos. Los cambios en la composición corporal durante las 12 semanas del estudio, medidos mediante el análisis de impedancia bioeléctrica, mostraron aumentos en el peso corporal sin agua en los grupos tratados con MA (ver tabla de estudios clínicos). Además, el edema se desarrolló o empeoró en solo 3 pacientes.
Mayores porcentajes de pacientes tratados con MA en el grupo de 800 mg (89%), el grupo de 400 mg (68%) y el grupo de 100 mg (72%), que en el grupo de placebo (50%), mostraron una mejoría en el apetito en la última evaluación durante las 12 semanas del estudio. Se observó una diferencia estadísticamente significativa entre el grupo tratado con 800 mg de MA y el grupo tratado con placebo en el cambio en la ingesta calórica desde el valor basal hasta el momento del cambio de peso máximo. Se pidió a los pacientes que evaluaran el cambio de peso, el apetito, la apariencia y la percepción general de bienestar en una encuesta de 9 preguntas. Al cambio de peso máximo, solo el grupo tratado con 800 mg de MA dio respuestas que fueron estadísticamente significativamente más favorables a todas las preguntas en comparación con el grupo tratado con placebo. En la encuesta se observó una respuesta a la dosis con respuestas positivas correlacionadas con una dosis más alta para todas las preguntas.
El segundo ensayo fue un estudio multicéntrico, aleatorizado, doble ciego, controlado con placebo que comparó acetato de megestrol 800 mg/día versus placebo en pacientes con SIDA con anorexia/caquexia y pérdida de peso significativa. De los 100 pacientes incluidos en el estudio, 65 cumplieron todos los criterios de inclusión/exclusión, tuvieron al menos dos mediciones adicionales de peso después de la línea de base durante un período de 12 semanas o tuvieron una medición de peso después de la línea de base, pero abandonaron por fracaso terapéutico. Los pacientes del grupo tratado con 800 mg de MA tuvieron un aumento estadísticamente significativo mayor en el cambio de peso máximo medio que los pacientes del grupo placebo. Desde el inicio hasta la semana 12 del estudio, el peso medio aumentó en 11,2 libras en el grupo tratado con MA y disminuyó en 2,1 libras en el grupo de placebo. Los cambios en la composición corporal medidos por el análisis de impedancia bioeléctrica mostraron aumentos en el peso no acuoso en el grupo tratado con MA (ver tabla de estudios clínicos). No se notificó edema en el grupo tratado con MA. Un porcentaje mayor de pacientes tratados con AM (67%) que de pacientes tratados con placebo (38%) mostró una mejoría en el apetito en la última evaluación durante las 12 semanas del estudio; esta diferencia fue estadísticamente significativa. No hubo diferencias estadísticamente significativas entre los grupos de tratamiento en el cambio calórico medio o en la ingesta calórica diaria en el tiempo hasta el cambio de peso máximo. En la misma encuesta de 9 preguntas a la que se hizo referencia en el primer ensayo, las evaluaciones de los pacientes sobre el cambio de peso, el apetito, la apariencia y la percepción general de bienestar mostraron aumentos en las puntuaciones medias de los pacientes tratados con MA en comparación con el grupo de placebo.
En ambos ensayos, los pacientes toleraron bien el fármaco y no se observaron diferencias estadísticamente significativas entre los grupos de tratamiento con respecto a anomalías de laboratorio, nuevas infecciones oportunistas, recuentos de linfocitos, recuentos de T4, recuentos de T8 o pruebas de reactividad cutánea (consulte la sección REACCIONES ADVERSAS).
| Megestrol Acetate Oral Suspension Clinical Efficacy Trials | |||||||
| Trial 1 | Trial 2 | ||||||
| Study Accrual Dates | Study Accrual Dates | ||||||
| 11/88 to 12/90 | 5/89 to 4/91 | ||||||
| Megestrol Acetate, mg/day | 0 | 100 | 400 | 800 | 0 | 800 | |
| Entered Patients | 38 | 82 | 75 | 75 | 48 | 52 | |
| Evaluable Patients | 28 | 61 | 53 | 53 | 29 | 36 | |
| Mean Change in Weight (lb.) | |||||||
| Baseline to 12 Weeks | 0.0 | 2.9 | 9.3 | 10.7 | -2.1 | 11.2 | |
| % Patients ≥ 5 Pound Gain | |||||||
| At Last Evaluation in 12 weeks | 21 | 44 | 57 | 64 | 28 | 47 | |
| Mean Changes in Body Composition: | |||||||
| Fat Body Mass (lb.) | 0.0 | 2.2 | 2.9 | 5.5 | 1.5 | 5.7 | |
| Lean Body Mass (lb.) | -1.7 | -0.3 | 1.5 | 2.5 | -1.6 | -0.6 | |
| Water (liters) | -1.3 | -0.3 | 0.0 | 0.0 | -0.1 | -0.1 | |
| % Patients With Improved Appetite: | |||||||
| At Time of Maximum Weight Change | 50 | 72 | 72 | 93 | 48 | 69 | |
| At Last Evaluation in 12 Weeks | 50 | 72 | 68 | 89 | 38 | 67 | |
| Mean Change in Daily Caloric Intake: | |||||||
| Baseline to Time of Maximum Weight Change | -107 | 326 | 308 | 646 | 30 | 464 | |
| *Based on bioelectrical impedance analysis determinations at last evaluation in 12 weeks |
Presented below are the results of mean weight changes for patients evaluable for efficacy in trials 1 and 2.