Síndrome de Piernas Inquietas: Un Trastorno Común Infradiagnosticado
US Pharm. 2009;34(1):24-29.
El síndrome de piernas inquietas (SPI) es un trastorno sensomotor común del sistema nervioso central. Se caracteriza por un impulso o necesidad irresistible de mover las extremidades que se produce como resultado de sensaciones incómodas en las extremidades. Aunque el SPI generalmente comienza en las piernas, puede extenderse a otras partes del cuerpo, como los brazos o el torso. Las personas que sufren de SPI a menudo describen el trastorno como una sensación de agua que fluye dentro de las piernas, «insectos en los huesos» o electricidad en las piernas. Estos síntomas pueden estar presentes todo el día, pero por lo general empeoran durante los períodos de inactividad y por la noche. Las personas con SPI generalmente deben mover sus extremidades para aliviar completa o parcialmente las sensaciones incómodas. Por la noche, el RLS a menudo se asocia con movimientos periódicos de las extremidades (PLMs), que pueden causar problemas para dormir y también dificultar la realización de actividades sedentarias, como sentarse cómodamente en un automóvil o en un avión durante períodos prolongados.
La causa del SPI no está clara, pero la investigación sugiere que la actividad de dopamina alterada en el cerebro debido a la insuficiencia de hierro puede inducir el SPI en personas con una predisposición genética. El SPI se puede clasificar como primario o secundario debido a otra afección médica, como enfermedad renal terminal (ESRD) o embarazo. Los agonistas dopaminérgicos como el ropirinol y el pramipexol son terapia de primera línea para el SPI con síntomas diarios. Existen terapias alternativas para casos refractarios o síntomas persistentes. Este artículo explora la prevalencia, la etiología y el diagnóstico del SPI, así como los tratamientos disponibles.
Prevalencia
Los estudios epidemiológicos indican que entre el 7,2% y el 11% de la población general de Europa y América del Norte padece algún tipo de SPI.1,2 Solo en los Estados Unidos, se cree que el SPI afecta a más de 10 millones de adultos y se estima que a 1,5 millones de niños y adolescentes, con tasas similares entre niños y niñas.1,3 Las mujeres son aproximadamente el doble de susceptibles al SPI que los hombres (9% vs. 5,4%).1,2 El SPI es más común en adultos mayores, pero después de los 79 años su incidencia tiende a disminuir.1 Existen casos de SPI clínicamente significativos en 2,7 a 3% de la población.1,2 A pesar de su alta prevalencia, este síndrome sigue estando infradiagnosticado y es preocupante para muchos pacientes.
Etiología
La etiología del SPI no se comprende completamente. Los estudios han demostrado que no es un problema neurodegenerativo estructural, sino que involucra el sistema de dopamina, la estasis homeo de hierro o la genética. La siguiente discusión resume el pensamiento actual sobre cada una de estas tres causas potenciales.
Sistema de dopamina: Los intentos de demostrar que el sistema de dopamina es anormal en personas con SPI no han dado resultados definitivos. Los hallazgos de estudios de neuroimagen sugieren disfunción de la dopamina, en lugar de insuficiencia.4 La implicación de la dopamina en el SPI está respaldada por la respuesta clínica a los agonistas dopaminérgicos en el tratamiento del SPI primario.Se desconoce el mecanismo de acción exacto de los agonistas dopaminérgicos para aliviar los síntomas del SPI.
Homeostasis del hierro: Un estudio de autopsia demostró una reducción de las reservas de hierro en la sustancia negra de pacientes con SPI.7 Por lo tanto, una posible causa de RLS podría ser la incapacidad del cerebro para mantener niveles normales de hierro. El hierro también es un cofactor en la producción de dopamina. Otro estudio demostró un posible vínculo entre el deterioro de la homeostasis del hierro y la disfunción de la dopamina.8 Se necesitan más estudios para determinar el papel del hierro en el SPI.
Genética: La experiencia clínica ha demostrado una fuerte conexión familiar en el SPI. Se han notificado varios loci hasta la fecha, pero aún no se ha identificado un gen causante de la enfermedad.9,10 Generalmente se acepta que el RLS sigue un modo de herencia autosómico dominante que requiere que solo un padre afectado pase el rasgo a la descendencia. Se necesitan más estudios genéticos para arrojar luz sobre el genotipo de los enfermos de SPI.
Diagnóstico
El diagnóstico de SPI se basa enteramente en entrevistas con el paciente y el historial de síntomas. Los criterios diagnósticos fueron establecidos en 1995 por el International Restless Legs Study Group (IRLSSG) y revisados en 200311,12.Se dividen en criterios esenciales, de apoyo y asociados (TABLA 1). Los cuatro criterios esenciales deben estar presentes para establecer un diagnóstico de SPI. Las características clínicas de apoyo ayudan en el diagnóstico de casos más complicados. Las características asociadas están presentes en la mayoría de los casos de SPI y pueden guiar aún más a los médicos en el diagnóstico.

RLS primario
El RLS primario se ha identificado con un inicio de síntomas más insidioso que el RLS secundario. Es más común en personas menores de 40 años. Estos pacientes también tienen más probabilidades de tener otros miembros de la familia con el trastorno. Un paso crítico en el tratamiento de pacientes con SPI primario es establecer la frecuencia y gravedad de sus síntomas. Un algoritmo de tratamiento divide el SPI primario en tres categorías de acuerdo con la gravedad de los sintomáticos13:
El SPI intermitente requiere tratamiento ocasional de los síntomas, pero no es lo suficientemente grave como para requerir terapia medicamentosa diaria. Las personas con SPI intermitente tienen síntomas más leves y son más fáciles de tratar. El tratamiento sin medicamentos suele ser el enfoque de primera línea preferido.
El SPI diario se caracteriza por síntomas persistentes que deben manejarse con terapia medicamentosa diaria. La terapia farmacológica es el tratamiento de elección.
El SPR refractario es el SPR diario que no responde al tratamiento con al menos un fármaco de primera línea a la dosis habitual. Se debe cumplir al menos uno de los siguientes criterios: incapacidad para lograr una respuesta adecuada a la medicación; respuesta insatisfactoria a lo largo del tiempo a pesar de los aumentos de dosis del agente preferido; efectos secundarios intolerables; y empeoramiento de los síntomas a pesar de dosis adicionales de medicación.
El SPI secundario
El SPI secundario se asocia con un inicio más abrupto y, por lo general, ocurre junto con o como resultado de otra afección, como deficiencia de hierro, ESRD o embarazo. Los síntomas del SPI secundario no se distinguen de los del SPI primario, pero el tratamiento se dirige a la afección subyacente.
Tratamiento del SPI primario
Terapia no farmacológica
En el SPI leve, primero se deben probar abordajes no farmacológicos. En todos los demás casos, la terapia no farmacológica se puede usar además de la terapia farmacológica para aliviar los síntomas sensomotores y los trastornos del sueño. El tratamiento no farmacológico incluye desarrollar buenos hábitos de sueño, como tener un horario de sueño regular, garantizar un ambiente tranquilo y oscuro en el dormitorio y evitar los desencadenantes del síndrome de piernas inquietas (televisión, cafeína, nicotina, alcohol) cerca de la hora de acostarse.13 Se recomiendan actividades mentales de leves a moderadas (videojuegos, rompecabezas) y actividades físicas (tareas domésticas, ejercicio) durante los momentos en que los pacientes son más propensos a presentar síntomas, como por la noche y durante los períodos de inactividad o descanso. Se recomiendan actividades sedentarias como vuelos en avión, viajes largos en automóvil y películas por la mañana, cuando los síntomas del síndrome de piernas inquietas tienden a disminuir en intensidad.
Terapia farmacológica
La terapia farmacológica para el SPI es sintomática. No cura el trastorno, pero maneja sus manifestaciones preocupantes. Los agentes farmacológicos utilizados para el tratamiento del SPI son la levodopa (l-dopa), los agonistas dopaminérgicos, la gabapentina, los opioides y las benzodiacepinas.
l-Dopa: la l-Dopa es un precursor de dopamina. Está formulado junto con el inhibidor de la descarboxilasa carbidopa (Sinemet), que previene la descomposición plasmática periférica de la l-dopa. La carbidopa ayuda a reducir la cantidad de l-dopa necesaria en un 75%. Una vez que la l-dopa cruza la barrera hematoencefálica, se convierte en dopamina. Para la enfermedad de Parkinson, el tratamiento con carbidopa/l-dopa generalmente se inicia con 25 mg / 100 mg tres veces al día; para el SPI intermitente, la combinación de l-dopa y carbidopa se ha utilizado en dosis más bajas según sea necesario debido a su acción inmediata y a la falta de necesidad de ajuste de dosis.Se han investigado 13 formulaciones de liberación sostenida de l-dopa con semividas más largas para su uso alternativo en pacientes que con frecuencia despiertan por los síntomas durante la noche debido a la acción corta de la forma de liberación inmediata.14 Actualmente no hay productos l-dopa de una sola entidad en el mercado estadounidense.
En pacientes con SPI, la l-dopa produce efectos secundarios dopaminérgicos típicos, como náuseas, vómitos, somnolencia, mareos, hipotensión y dolor de cabeza. El efecto secundario más perjudicial, el aumento, impide su uso en el SPI diario.15 El aumento implica un empeoramiento de los síntomas del SPI más temprano en el día después de una dosis nocturna de medicamento, un aumento de la gravedad de los síntomas y la propagación de los síntomas a otras partes del cuerpo, como los brazos o el torso.13
Agonistas dopaminérgicos: Los agonistas dopaminérgicos son terapia de primera línea para el SPI diario.13 Los agonistas no alérgicos, como el ropinirol y el pramipexol, se prefieren a los agonistas ergóticos, como la pergolida y la cabergolina, debido a sus perfiles de efectos secundarios más favorables. La pergolida y la cabergolina, que han demostrado aumentar el riesgo de regurgitación de válvulas cardíacas, actualmente no están disponibles en los Estados Unidos debido a este efecto adverso dañino.16
Ropinirol (Requip) fue el primer medicamento aprobado por la FDA (en 2005) para el tratamiento del SPI primario de moderado a grave. Es un agonista intrínseco completo no alergolínico para los subtipos de receptores de dopamina D2 y D3. Tres ensayos clínicos grandes han demostrado la eficacia y tolerabilidad del ropinirol en el tratamiento del SPI.5,17,18 En los tres estudios, los pacientes fueron aleatorizados a ropinirol o placebo con un programa flexible de ajuste de dosis de 0,25 mg a 4 mg/día, según su tolerancia, tomados una vez al día de una a tres horas antes de acostarse. Los resultados se evaluaron con la Escala Internacional de Clasificación de RLS (IRLS), la medida primaria de los resultados, y la escala de Mejora de las Impresiones Clínicas Globales (CGI-I). El IRLS consta de 10 secciones que evalúan la gravedad de los síntomas sensoriales y motores, los trastornos del sueño, el impacto en las actividades de la vida diaria y el estado de ánimo asociado con el RLS. Con base en el IRLS, los tres ensayos encontraron que el ropinirol redujo de manera efectiva los síntomas centrales del RLS, como la gravedad y frecuencia de los síntomas, así como los problemas para dormir, y aumentó de manera efectiva el bienestar general. Los efectos adversos notificados con más frecuencia fueron náuseas y dolor de cabeza, típicos de los agonistas dopaminérgicos. El aumento no se evaluó formalmente en estos estudios y no se documentaron informes de aumento de la enfermedad.
El pramipexol (Mirapex), aprobado por la FDA en 2006 para el tratamiento del SPI diario de moderado a grave, es otro agonista completo de los receptores D2 y D3 no alergolínicos. La eficacia del pramipexol se evaluó en varios ensayos clínicos.6,19,20 Todos los pacientes recibieron pramipexol (0,125 mg-0,75 mg) según fuera necesario y tolerado o placebo una vez al día, dos o tres horas antes de acostarse. En todos los estudios, las dos medidas de resultado utilizadas para evaluar la eficacia fueron las IRL y el CGI-I. Se observaron mejoras en las medidas subjetivas y objetivas del SPI. Los efectos adversos notificados con frecuencia fueron náuseas, dolor de cabeza y fatiga. El aumento no se evaluó formalmente, aunque algunos informes documentados de aumento con pramipexol aparecieron en estudios retrospectivos.21,22
Otros tratamientos: La gabapentina, las benzodiacepinas y los opioides son agentes de segunda línea útiles que son una terapia alternativa adecuada para los casos de SPI que involucran síntomas específicos, como trastornos continuos del sueño o sensaciones dolorosas en las extremidades.
La mayoría de las investigaciones relacionadas con el SPI se han realizado con el anticonvulsivo gabapentina (Neurontin), que ha demostrado ser útil para el SPI y la neuropatía periférica.23,24 La gabapentina, un análogo estructural del ácido gamma-aminobutírico, funciona reduciendo los síntomas subjetivos del SPI.23 Debido a que puede causar somnolencia, la gabapentina se puede probar como un agente coadyuvante para el SPI que involucra problemas persistentes de sueño.Se necesitan 24 estudios adicionales para examinar los efectos a largo plazo de la monoterapia crónica con gabapentina.
Existen relativamente pocos estudios publicados sobre el uso de benzodiacepinas para el SPI. Solo se ha investigado el clonazepam y el alprazolam en ensayos clínicos. Debido a sus propiedades sedantes, estos dos agentes se han utilizado principalmente para inducir el sueño. Un pequeño estudio de clonazepam mostró que el medicamento era eficaz para el SPI nocturno debido a su capacidad para inducir y mantener el sueño; sin embargo, no redujo el SPI durante el sueño.Según los informes, la mayor incidencia de somnolencia diurna y trastornos cognitivos se relacionó con la acción más prolongada de la droga. En general, las benzodiacepinas se consideran una opción de segunda línea para el SPI que involucra insomnio significativo.26
Se desconoce cómo funcionan los analgésicos opioides en el SPI. En un ensayo clínico retrospectivo de pacientes que recibieron monoterapia a largo plazo con opioides (oxicodona, propoxifeno, codeína o metadona) para el SPI primario, se demostró que los opioides eran muy eficaces para aliviar los síntomas motores y los trastornos del sueño y prácticamente no producían tolerancia ni dependencia física (solo en uno de los 36 pacientes en monoterapia).27 Los autores recomendaron seleccionar un opioide en función de la gravedad de las quejas del paciente. Otro estudio sugirió que el tramadol (Ultram) tiene un menor potencial de abuso y menos efectos secundarios que otros opioides y que debería ser el opioide de elección para el tratamiento del SPI.28 En casos graves y refractarios, se recomienda la metadona oral debido a su larga vida media.29
Tratamiento del SPI secundario
Algunos pacientes desarrollan SPI como consecuencia de otra afección. Hasta el 26% de las mujeres embarazadas se ven afectadas por los síntomas del SPI, especialmente en el tercer trimestre.30 Se presenta una alta prevalencia de SPI en personas con ERT y en personas con deficiencia de hierro.31,32 El tratamiento del SPI secundario se centra en identificar y tratar la causa subyacente. En el embarazo, la terapia se suspende ya que las mujeres experimentan una reversión completa de los síntomas después de dar a luz. El trasplante de riñón, pero no la diálisis, es curativo para el SPI en la ERT. Se puede administrar hierro intravenoso si las reservas de hierro son bajas.33 Los médicos deben evaluar a los pacientes en busca de otras sustancias que tienen el potencial de agravar los síntomas del SPI, como metoclopromuro, todos los neurolépticos, muchos antidepresivos y antihistamínicos. Estos agentes deben interrumpirse, si es posible.
El papel del farmacéutico en el SPI
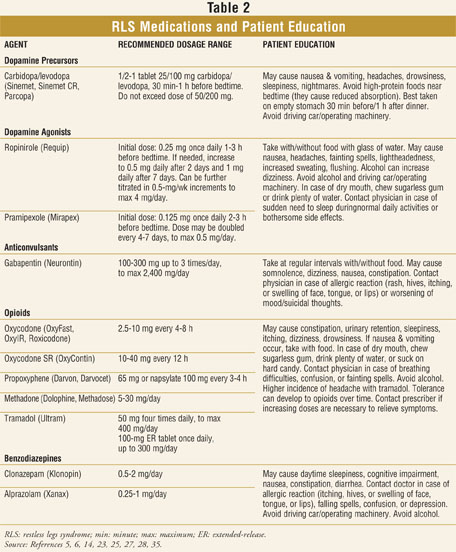
Los farmacéuticos deben conocer y ser capaces de reconocer los signos y síntomas típicos del SPI, como las sensaciones desagradables en las pantorrillas, los muslos, los pies o incluso los brazos. A menudo, los pacientes describen estas sensaciones como» arrastrarse»,» arrastrarse»,» hormigueo»,» nerviosismo»,» estar profundamente arraigado «o » ardor».»Aunque la descripción del SPI puede variar significativamente entre los pacientes, el elemento común es un deseo o necesidad de mover las extremidades que empeora por las noches y causa dificultad para conciliar el sueño o permanecer dormido. Las personas afectadas por el SPI también pueden quejarse de fatiga, estado de ánimo deprimido o falta de concentración.34 Los farmacéuticos pueden considerar recomendar que los pacientes con síntomas de SPI hablen con su médico de atención primaria con respecto a la derivación a un neurólogo o a un especialista del sueño apropiado según la evaluación y recomendación de su médico. También es importante que los farmacéuticos estén familiarizados con los medicamentos más comunes para el SPI y ofrezcan asesoramiento adecuado sobre su uso adecuado y los posibles efectos adversos (TABLA 2).
Existen varios recursos en línea que pueden proporcionar información adicional sobre RLS. La Fundación RLS (www.rls.org) es la mejor fuente general de información de RLS. El sitio contiene una lista de grupos de apoyo, una sala de chat, revisiones actualizadas de los tratamientos de SPI y consejos de expertos. Otros recursos en línea are WE MOVE (www.wemove.org) y Hablar Del Sueño (www.talkaboutsleep.com).
1. Allen RP, Walters AS, Montplaisir J, et al. Prevalencia e impacto del síndrome de piernas inquietas: Estudio de población general en reposo. Arch Intern Med. 2005;165:1286-1292.
2. Hening W, Walters AS, Allen RP, et al. Impacto, diagnóstico y tratamiento del síndrome de piernas inquietas (SPI) en una población de atención primaria: el RESTO (epidemiología, síntomas y tratamiento del SPI) estudio de atención primaria. Medicina para Dormir. 2004;5:237-246.
3. Picchietti D, Allen RP, Walters AS, et al. Síndrome de piernas inquietas: Prevalencia e impacto en niños y adolescentes study estudio de reposo pediátrico. Pediatría. 2007;120:253-266.
4. Wetter TC, Eisensehr I, Trenkwalder C. Estudios de neuroimagen funcional en el síndrome de piernas inquietas. Medicina para Dormir. 2004;5:401-406.
5. Trenkwalder C, García-Borreguero D, Montagna P, et al. Ropinirol en el tratamiento del síndrome de piernas inquietas: resultados del estudio TREAT RLS 1, un estudio aleatorizado, controlado con placebo de 12 semanas de duración en 10 países europeos. J Neurol Neurosurg Psychiatry. 2004;75:92-97.
6. Winkelman JW, Sethi KD, Kushida CA, et al. Eficacia y seguridad del pramipexol en el síndrome de piernas inquietas. Neurología. 2006;67:1034-1039.
7. Connor JR, Boyer PJ, Menzies SL, et al. El examen neuropatológico sugiere un deterioro de la adquisición de hierro en el cerebro en el síndrome de piernas inquietas. Neurología. 2003;61:304-309.
8. Wang X, Wiesinger J, Beard J, et al. La expresión de Thy1 en el cerebro se ve afectada por el hierro y disminuye en el síndrome de piernas inquietas. J Neurol Sci. 2004;220:59-66.
9. Mathias RA, Hening W, Washburn M, et al. Análisis de segregación del síndrome de piernas inquietas: posible evidencia de un gen importante en un estudio familiar utilizando diagnósticos ciegos. Zumbido.
10. Desautels A, Turecki G, Xiong L, et al. Análisis mutacional de la neurotensina en el síndrome de piernas inquietas familiar. Desorden de Movimiento. 2004;19:90-94.
11. Walters AS. Hacia una mejor definición del síndrome de piernas inquietas. Grupo Internacional de Estudio del Síndrome de Piernas Inquietas. Desorden de Movimiento. 1995;10:634-642.12. Allen RP, Picchietti D, Hening WA, et al. Síndrome de piernas inquietas: criterios diagnósticos, consideraciones especiales y epidemiología. Un informe del taller de diagnóstico y epidemiología del síndrome de piernas inquietas en los Institutos Nacionales de la Salud. Medicina para Dormir. 2003;4:101-119.13. Silber MH, Ehrenberg BL, Allen RP, et al. Algoritmo para el manejo del síndrome de piernas inquietas. Proceso de Mayo Clin. 2004;79:916-922.14. Trenkwalder C, Collado Seidel V, Kazenwadel J, et al. Tratamiento de un año con levodopa estándar y de liberación sostenida: ¿tratamiento adecuado a largo plazo del síndrome de piernas inquietas? Desorden de Movimiento.15. Allen RP, Earley CJ. Aumento del síndrome de piernas inquietas con carbidopa / levodopa. Dormir.16. Schade R, Andersohn F, Suissa S, et al. Agonistas dopaminérgicos y el riesgo de regurgitación de válvulas cardíacas. N Engl J Med. 2007;356:29-38.17. Walters AS, Ondo WG, Dreykluft T, et al. El ropinirol es eficaz en el tratamiento del síndrome de piernas inquietas. TRATE RLS 2: un estudio de 12 semanas, doble ciego, aleatorizado, de grupos paralelos y controlado con placebo. Desorden de Movimiento. 2004;19:1414-1423.18. Bogan RK, Fry JM, Schmidt MH, et al. Ropinirol en el tratamiento de pacientes con síndrome de piernas inquietas: un ensayo clínico aleatorizado, doble ciego y controlado con placebo con sede en los Estados Unidos. Proceso de Mayo Clin.19. Oertel WH, Stiasny-Kolster K, Bergtholdt B, et al. Eficacia de pramipexol en el síndrome de piernas inquietas: un estudio multicéntrico, aleatorizado, doble ciego de seis semanas de duración (estudio effect-RLS). Desorden de Movimiento.20. Trenkwalder C, Stiasny-Kolster K, Kupsch A, et al. Retirada controlada de pramipexol después de 6 meses de tratamiento abierto en pacientes con síndrome de piernas inquietas. Desorden de Movimiento.21. Aumento del síndrome de piernas inquietas de Ferini-Strambi L. y tratamiento con pramipexol. Medicina para Dormir.22. Winkelman JW, Johnston L. Aumento y tolerancia con pramipexol a largo plazo para el tratamiento del síndrome de piernas inquietas (SPI). Medicina para Dormir. 2004;5:9-14.23. Happe S, Klösch G, Saletu B, Zeitlhofer J. Tratamiento del síndrome de piernas inquietas idiopático (SPI) con gabapentina. Neurología. 2001;57:1717-1719.24. García-Borreguero D, Larrosa O, de la Llave Y, et al. Tratamiento del síndrome de piernas inquietas con gabapentina: un estudio cruzado doble ciego. Neurología. 2002;59:1573-1579.25. Saletu M, Anderer P, Saletu-Zyhlarz G, et al. Síndrome de piernas inquietas (SPI) y trastorno del movimiento periódico de las extremidades (PLMD): estudios agudos de laboratorio controlados con placebo del sueño con clonazepam. Eur Neuropsicofarmacol. 2001;11:153-161.26. Schenck CH, Mahowald MW. Tratamiento nocturno a largo plazo con benzodiazepinas de parasomnias perjudiciales y otros trastornos del sueño nocturno interrumpido en 170 adultos. Am J Med.27. Walters AS, Winkelmann J, Trenkwalder C, et al. Seguimiento a largo plazo en pacientes con síndrome de piernas inquietas tratados con opioides. Desorden de Movimiento. 2001;16:1105-1109.28. Lauerma H, Markkula J. Tratamiento del síndrome de piernas inquietas con tramadol: un estudio abierto. Psiquiatría J Clin. 1999;60:241-244.29. Ondo WG. Metadona para el síndrome de piernas inquietas refractarias. Desorden de Movimiento. 2005;20:345-348.30. Manconi M, Govoni V, De Vito A, et al. Síndrome de piernas inquietas y embarazo. Neurología.31. Gigli GL, Adorati M, Dolso P, et al. Síndrome de piernas inquietas en enfermedad renal terminal. Medicina para Dormir. 2004;5:309-315.32. Sun ER, Chen CA, Ho G, et al. El hierro y el síndrome de piernas inquietas. Dormir. 1998;21:371-377.33. Earley CJ, Heckler D, Allen RP. Las dosis intravenosas repetidas de hierro proporcionan un tratamiento complementario eficaz del síndrome de piernas inquietas. Medicina para Dormir. 2005;6:301-305.34. Kushida C, Martin M, Nikam P, et al. La carga del síndrome de piernas inquietas en la calidad de vida relacionada con la salud. Qual Life Res. 2007; 16: 617-624.35. Datos& Comparaciones. Datos& Comparaciones 4.0 .www.factsandcomparisons.com Consultado el 31 de agosto de 2008. 2006;62:157-164. 2003;18:1184-1189. 1996;19:205-213. 2006;81:17-27. 2007;22:213-219. 2006;21:1404-1410. 2002; 3 (suppl): S23-S25. 1996;100:333-337. 2004;63:1065-1069.