7.18: Vinyylihalidit ja Aryylihalidit
nukleofiilinen substituutio aryylihalideissa
tarkastelemme hieman tarkemmin klooribentseenin rakennetta. Bromibentseeni ja jodibentseeni ovat aivan samanlaisia. Yksinkertaisin tapa piirtää klooribentseenin rakenne on:
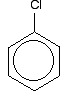
klooribentseenin ymmärtämiseksi oikein on kaivettava vähän syvemmälle. Bentseenirenkaan delokalisoituneiden elektronien ja klooriatomin yhden yksinäisen parin välillä on vuorovaikutus. Tämä on päällekkäistä delokalisoituneen rengaselektronijärjestelmän kanssa . . .
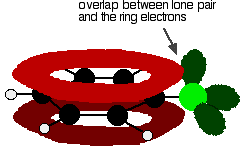
antaa melko tällaisen rakenteen:
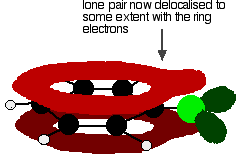
tämä delokalisaatio ei ole suinkaan täydellinen, mutta sillä on merkittävä vaikutus molempien hiili-kloorin ominaisuuksiin sidos ja molekyylin napaisuus. Delokalisaatio tuo ylimääräistä sidosta hiilen ja kloorin välille, mikä tekee sidoksesta vahvemman. Tällä on suuri vaikutus klooribentseenin kaltaisten yhdisteiden reaktioihin.
myös elektroneja liikkuu jonkin verran poispäin kloorista kohti rengasta. Kloori on melko elektronegatiivinen ja vetää yleensä hiili-kloori-sidoksessa olevia elektroneja itseään kohti. Tällöin tämä kompensoituu jossain määrin elektronien siirtymisellä takaisin kohti rengasta delokalisaatiossa. Molekyyli on vähemmän polaarinen kuin muuten olettaisi.
yksinkertaiset aryylihalidit kuten klooribentseeni kestävät hyvin nukleofiilista substituutiota. Kloori on mahdollista korvata-OH: lla, mutta vain erittäin vaikeissa teollisuusolosuhteissa – esimerkiksi 200°C: ssa ja 200 ilmakehässä. Laboratoriossa näitä reaktioita ei tapahdu. Tähän on kaksi syytä – riippuen siitä, mistä edellä mainituista mekanismeista puhut.
- hiili-halogeenisidoksen ylimääräinen vahvuus aryylihalideissa: klooribentseenin hiili-kloorisidos on vahvempi kuin voisi olettaa. Klooriatomin yhden yksinäisen parin ja delokalisoituneen renkaan elektronien välillä on vuorovaikutus, ja tämä vahvistaa sidosta. Molemmissa edellä mainituissa mekanismeissa hiili-halogeenisidos katkeaa jossain vaiheessa. Mitä vaikeampi sitä on murtaa, sitä hitaampi reaktio on.
- renkaan elektronien repulsio: tämä pätee vain, jos hydroksidi-ioni hyökkäsi klooribentseenin kimppuun edellä kuvatun kaltaisella mekanismilla. Tässä mekanismissa hydroksidi-ioni hyökkää hieman positiivisen hiilen kimppuun, johon halogeeniatomi on kiinnittynyt.Jos halogeeniatomi on kiinnittynyt bentseenirenkaaseen, tuleva hydroksidi-ioni kohtaa delokalisoituneet renkaan elektronit kyseisen hiiliatomin ylä-ja alapuolella. Negatiivinen hydroksidi-ioni yksinkertaisesti hylkii. Tämä mekanismi ei yksinkertaisesti käynnisty!