Refissa
yleisnimi: tretinoiini
annosmuoto: kerma
lääketieteellisesti arvosteltu Drugs.com. päivitetty viimeksi 1. huhtikuuta 2020.
- leiskuva
- haittavaikutukset
- annostus
- yhteisvaikutukset
- enemmän
ammatillinen
paikallisesti vain kasvoille.
- Refissa kuvaus
- Refissa – Kliininen farmakologia
- Refissan käyttöaiheet
- kliinisistä tutkimuksista
- vasta-aiheet
- Varoitukset
- varotoimet
- Yleiset
- tiedot potilaille
- Lääkkeiden yhteisvaikutukset
- karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
- raskaus
- Raskauskategoria C
- imettävät äidit
- lapsipotilailla
- geriatrinen käyttö
- haittavaikutukset
- yliannostuksen
- Refissa Annostus ja antotapa
- miten Refissa toimitetaan
- varastointi
- PÄÄNÄYTTÖPANEELI – 40 g putkipakkaus
- lisää Refissasta (tretinoiini ajankohtainen)
- consumer resources
- professional resources
- aiheeseen liittyvää hoito-ohjetta
Refissa kuvaus
Refissa , sisältää vaikuttavana aineena tretinoiinia (retinoidi) pehmentävässä voidepohjassa. Tretinoiini on keltaisesta oranssiin vaihteleva kiteinen jauhe, jolla on tunnusomainen kukkaistuoksu. Tretinoiini liukenee dimetyylisulfoksidiin, liukenee hieman polyetyleeniglykoli 400: aan, oktanoliin ja 100% etanoliin. Se on käytännöllisesti katsoen liukenematon veteen ja mineraaliöljyyn, ja se on liukenematon glyseriiniin. Tretinoiinin Kemiallinen nimi on(all-e)-3,7-dimetyyli-9-(2,6,6-trimetyyli-1-sykloneksen-1-yyli)-2,4,6,8-nonatetraeenihappo. Tretinoiinia kutsutaan myös all – trans-retinoiinihapoksi ja sen molekyylipaino on 300,44. Rakennekaava on esitetty alla.
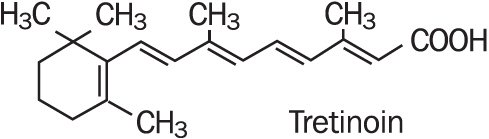
Refissa sisältää tretinoiinia pitoisuutena 0.05% w/w in a water-in-oil emulsion formulation consisting of light mineral oil, sorbitol solution, hydroxyoctacosanyl hydroxystearate; methoxy PEG-22/dodecyl glycol copolymer, PEG-45/dodecyl glycol copolymer, stearoxytrimethylsilane and stearyl alcohol, dimethicone 50 cs, methylparaben, edetate disodium, propylparaben, butylated hydroxytoluene, citric acid monohydrate, and purified water.
Refissa – Kliininen farmakologia
tretinoiinin tarkkaa vaikutusmekanismia ei tunneta, vaikka retinoidien uskotaan vaikuttavan eri epiteelisolujen kasvuun ja erilaistumiseen. Paikallisesti annosteltuna ei kuitenkaan havaittu desmosiinin, hydroksiproliinin eikä elastiini mRNA: n lisääntymistä ihmisen ihossa. Lisäksi ei ole vielä täysin selvitetty, mikä on tuotteen ärsyttävän luonteen merkitys sille käyttöaiheena annettujen myönteisten vaikutusten aikaansaamisessa.
tretinoiinin transdermaalinen imeytyminen erilaisista paikallisista lääkemuodoista vaihteli 1-31% annostellusta annoksesta riippuen siitä, annettiinko sitä terveelle iholle vai ihotautiselle iholle. Kun tretinoiinivoiteen imeytyminen ihon kautta arvioitiin terveillä miespuolisilla koehenkilöillä (N=14) 0, 05% kerta-annostelun jälkeen sekä toistuvien päivittäisten annostelujen jälkeen 28 päivän ajan, tretinoiinin imeytyminen oli alle 2% ja tretinoiinin ja sen päämetaboliittien endogeeniset pitoisuudet säilyivät muuttumattomina.
Refissan käyttöaiheet
(jotta ymmärtäisit täysin tämän tuotteen käyttöaiheet, lue koko merkintöjen käyttö-ja KÄYTTÖOSIO.)
Refissa on tarkoitettu täydentäväksi lääkeaineeksi (KS.alla oleva toinen luetelmakohta) käytettäväksi hienojen ryppyjen, kirjavan hyperpigmentaation ja kasvojen ihon tuntoon liittyvän karheuden lievittämiseen (lievittämiseen) potilailla, jotka eivät saavuta tällaista lievitystä käyttämällä kattavia ihonhoito-ja aurinkosuojaohjelmia (KS. bullet 3, Jos tehoa ei ole osoitettu). Refissa ei poista ryppyjä, korjaa auringon VAURIOITTAMAA ihoa, käännä FOTOAGING tai palauta nuorekkaampaa tai nuorempaa ihon histologista kuviota. Monet potilaat saavuttavat halutut palliatiiviset vaikutukset kasvojen ihon hienoon rypistymiseen, kirjavaan hyperpigmentaatioon ja tuntoon liittyvään karheuteen käyttämällä kattavia ihonhoito-ja auringon välttämisohjelmia, mukaan lukien aurinkovoiteet, suojavaatteet ja pehmittävät voiteet, jotka eivät sisällä tretinoiinia.
- Tretinoin Cream, USP (Emollient) 0.05% : lla ei ole osoitettu olevan lieventävää vaikutusta kroonisen aurinkoaltistuksen merkittäviin merkkeihin, kuten karkeaan tai syvään rypistymiseen, ihon kellastumiseen, lentigiineihin, telangiektasiaan, ihon löystymiseen, keratinosyyttiseen atypiaan, melanosyyttiseen atypiaan tai ihon elastoosiin.
- Refissaa tulee käyttää lääkärin valvonnassa kokonaisvaltaisen ihonhoito-ja auringon välttämisohjelman lisänä, johon kuuluu tehokkaiden aurinkovoiteiden (minimun SPF 15) ja suojavaatteiden käyttö, kun haluttuja tuloksia hienoista rypyistä, kirjavasta hyperpigmentaatiosta ja kasvojen ihon karheudesta ei ole saavutettu pelkästään kattavalla ihonhoito-ja auringon välttämisohjelmalla.
- Refissan tehoa hienojen ryppyjen, kirjavan hyperpigmentaation ja kasvojen ihon tuntoon liittyvän karheuden lievittämisessä ei ole osoitettu yli 50-vuotiailla eikä henkilöillä, joilla on kohtalaisen tai voimakkaasti pigmentoitunut iho. Lisäksi potilaat, joilla oli näkyviä aktiinisia keratooseja ja potilaat, joilla oli ollut ihosyöpä, suljettiin pois Tretinoiinivoiteen, USP: n (Emollient), kliinisistä tutkimuksista 0, 05%: lla. Näin ollen refissan tehokkuutta ja turvallisuutta näissä populaatioissa ei tällä hetkellä tunneta.
- Refissan turvallisuutta tai tehokkuutta aurinkokeratoosien tai ihokasvainten ehkäisyssä tai hoidossa ei ole osoitettu.
- refissan päivittäisen käytön turvallisuutta tai tehoa yli 48 viikon ajan ei ole osoitettu, eikä päivittäistä käyttöä yli 48 viikon ajan ole tutkittu systemaattisesti ja histologisesti riittävissä ja hyvin kontrolloiduissa tutkimuksissa. (KS. varoituksia koskeva kohta.
kliinisistä tutkimuksista
kahdessa riittävässä ja hyvin kontrolloidussa tutkimuksessa oli mukana yhteensä 161 arviointikelpoista potilasta (Alle 50-vuotiaat), joita hoidettiin tretinoiinivoiteella, USP (Emollient) 0, 05%: lla ja 154 arviointikelpoista potilasta, joita hoidettiin emollient-emulsiovoiteella kasvoilla 24 viikon ajan.ja tunto-ihon karheutta. Patients were evaluated at baseline on a 10-point scale, and changes from that baseline rating were categorized as follows:
| No Improvement: | No change or an increase of 1 unit or more | |
| Minimal Improvement: | Reduction of 1 unit | |
| Moderate Improvement: | vähintään 2 yksikön väheneminen |
näissä tutkimuksissa kasvojen ihon hienojen ryppyjen, kirjavan hyperpigmentaation ja tuntoon liittyvän karheuden arveltiin johtuvan useita tekijöitä, joihin kuului luontainen ikääntyminen tai ympäristötekijät, kuten krooninen auringolle altistuminen.
näiden arviointien tulokset ovat seuraavat:
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 36% | 40% | 24% |
| Vehicle + CSP | 62% | 30% | 8% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 35% | 27% | 38% |
| Vehicle + CSP | 53% | 21% | 27% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| * CSP= Comprehensive skin protection and sun avoidance programs included use of sunscreens, protective clothing, and emollient cream. | |||
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 49% | 35% | 16% |
| vehicle + CSP | 67% | 23% | 10% |
suurin osa näiden oireiden paranemisesta havaittiin ensimmäisten 24 hoitoviikon aikana. Sen jälkeen hoito ensisijaisesti piti saavutetun paranemisen ennallaan ensimmäisten 24 viikon aikana.
suurin osa potilaista menettää Refissan lievimmät vaikutukset hienoihin ryppyihin, kirjavaan hyperpigmentaatioon ja kasvojen ihon tuntoon liittyvään karheuteen, kun kattava ihonhoito-ja auringon välttämisohjelma Refissa mukaan lukien lopetetaan; refissan päivittäisen käytön turvallisuutta ja tehokkuutta yli 48 viikon ajan ei kuitenkaan ole osoitettu.
vasta-aiheet
tämä lääke on vasta-aiheinen henkilöille, joilla on aiemmin ollut herkkyysreaktioita jollekin sen komponenteista. Hoito on lopetettava, jos havaitaan yliherkkyyttä jollekin sen sisältämälle aineelle.
Varoitukset
- Refissa on ihoa ärsyttävä aine, eikä pitkäaikaisessa pitkäaikaiskäytössä yli 48 viikkoa jatkuneen ihoärsytyksen tuloksia tunneta. On näyttöä epätyypillisistä muutoksista melanosyyteissä ja keratinosyyteissä ja ihon elastoosin lisääntymisestä joillakin potilailla, joita on hoidettu Tretinoiinivoiteella, USP (Emollient) 0, 05% yli 48 viikon ajan. Näiden havaintojen merkitystä ei tunneta.
- Refissan turvallisuutta ja tehokkuutta henkilöillä, joilla on kohtalaisen tai voimakkaasti pigmentoitunut iho, ei ole osoitettu.
- Refissaa ei tule antaa, jos potilas käyttää myös lääkkeitä, joiden tiedetään olevan valolle herkistäviä (esim.tiatsidit, tetrasykliinit, fluorokinolonit, fentiatsiinit, sulfonamidit), koska valotoksisuus voi lisääntyä.
lisääntyneen palamisalttiuden vuoksi altistumista auringonvalolle (mukaan lukien aurinkolamput) tulee välttää tai minimoida Refissan käytön aikana. Potilaita on varoitettava käyttämästä aurinkovoidetta (vähintään SPF 15) ja suojavaatetusta Refissaa käytettäessä. Potilaita, joilla on auringonpolttama, tulee neuvoa olemaan käyttämättä Refissaa, kunnes hän on täysin toipunut. Potilaiden, jotka saattavat altistua huomattavasti auringonvalolle esimerkiksi ammattinsa vuoksi, ja potilaiden, joilla on luontainen herkkyys auringonvalolle, on noudatettava erityistä varovaisuutta Refissaa käytettäessä ja varmistettava, että pakkausselosteessa kuvattuja varotoimia noudatetaan.
Tretinoiinivoide, USP (pehmentävä aine) 0, 05% tulee pitää poissa silmistä, suusta, nenäkulmista ja limakalvoilta. Paikallinen käyttö voi aiheuttaa vaikeaa paikallista punoitusta, kutinaa, kirvelyä, kirvelyä ja hilseilyä kiinnityskohdassa. Jos paikallisen ärsytyksen aste antaa aihetta, potilaita tulee ohjata käyttämään vähemmän lääkitystä, vähentämään levitystiheyttä, keskeyttämään käyttö väliaikaisesti tai lopettamaan käyttö kokonaan.
Tretinoiinin on raportoitu aiheuttavan vaikeaa ärsytystä eksemaattisella iholla, ja sitä tulee käyttää vain varoen potilailla, joilla on tämä sairaus.
suositeltua suurempien lääkemäärien käyttö ei johda nopeampiin tai parempiin tuloksiin, ja huomattavaa punoitusta, hilseilyä tai epämukavuutta voi esiintyä.
varotoimet
Yleiset
Refissaa tulee käyttää vain kokonaisvaltaisen ihonhoito-ja auringon välttämisohjelman lisänä. (Katso käyttöaiheet ja käyttö-osio.)
Jos kehittyy lääkkeen herkkyys, kemiallinen ärsytys tai systeeminen haittavaikutus, Refissan käyttö tulee lopettaa.
sään ääripäät, kuten tuuli tai kylmä, saattavat ärsyttää Refissaa käyttäviä potilaita enemmän.
tiedot potilaille
katso potilaan pakkausseloste.
Lääkkeiden yhteisvaikutukset
samanaikaisia paikallisia lääkkeitä, lääkkeitä tai hankaavia saippuoita, shampoita, puhdistusaineita, kosmetiikkaa, jolla on voimakas kuivausvaikutus, tuotteita, joiden alkoholipitoisuus on suuri, astringentteja, mausteita tai kalkkia, kestoaaltoliuoksia, elektrolyysiä, karvankarvoja tai vahoja sekä tuotteita, jotka saattavat ärsyttää ihoa, tulee käyttää varoen Refissa-hoitoa saavilla potilailla, koska ne saattavat lisätä refissa-ärsytystä.
Refissaa ei tule antaa, jos potilas käyttää myös lääkkeitä, joiden tiedetään olevan valoherkistäjiä (esim., tiatsidit, tetrasykliinit, fluorokinolonit, fentiatsiinit, sulfonamidit) lisääntyvän valomyrkyllisyyden mahdollisuuden vuoksi.
karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
elinikäisessä ihotutkimuksessa CD-1-hiirillä havaittiin muutamia ihokasvaimia naarashiirillä ja maksakasvaimia uroshiirillä. Näiden löydösten biologinen merkitys ei ole selvä, koska ne tapahtuivat annoksilla, jotka ylittivät tretinoiinin suurimman siedetyn IHOANNOKSEN (MTD), ja koska ne olivat näiden kasvainten luonnollisen esiintyvyyden taustalla tässä hiirikannassa. Viitteitä karsinogeenisuudesta ei havaittu, kun tretinoiinia annettiin paikallisesti annoksella, joka oli 5 kertaa ihmisen suositellun paikallisen kliinisen annoksen keskiarvo. Vertailtaessa eläinten altistusta ihmisen altistukselle ”suositeltu paikallinen kliininen annos ihmiselle” on 500 mg Refissaa päivittäin 50 kg: n painoiselle henkilölle.
tsuburan ja Yamamoton hiirille suorittamassa kroonisessa, kaksivuotisessa a-Vitamiinihapon bioanalyysissä raportoitiin yleistynyttä amyloidikertymää kaikissa ryhmissä käsitellyn ihon tyvikerroksessa. CD-1-hiirillä samanlainen tutkimus raportoi hoidettujen ihokohtien hyalinisoitumista, ja tämän löydöksen esiintyvyys oli uroshiirillä 0/50, 3/50 ja 2/50 ja naarashiirillä 1/50, 0/50, 4/50 ja 2/50 vehikkeliryhmissä 0, 25 mg/kg, 0, 5 mg/kg ja 1 mg/kg.
tutkimukset karvattomilla albiinohiirillä viittaavat siihen, että tretinoiini saattaa voimistaa aurinkosimulaattorin UVB-ja UVA-valon karsinogeenisuuspotentiaalia. Muissa tutkimuksissa, kun tretinoiinilla hoidetut kevyesti pigmentoidut karvattomat hiiret altistettiin syöpää aiheuttaville UVB-valolle, ihokasvainten ilmaantuvuus ja kehitysnopeus joko vähenivät tai vaikutusta ei havaittu. Merkittävästi erilaisten koeolosuhteiden vuoksi näiden erilaisten tietojen tarkka vertailu ei ole tällä hetkellä mahdollista. Vaikka näiden tutkimusten merkitys ihmisillä ei ole selvä, potilaiden tulisi minimoida altistuminen auringolle.
tretinoiinin mutageenista potentiaalia arvioitiin Amesin testissä ja In vivo hiiren mikronukleuskokeessa, jotka molemmat olivat negatiivisia.
ihon segmenttien I ja III tutkimuksia Tretinoiinivoiteella, USP (Emollient) 0, 05% ei ole tehty millään lajilla. Rotilla tehdyissä tutkimuksissa, joissa käytettiin tretinoiinia suun kautta, todettiin vastasyntyneiden elinajan heikkenemistä ja kasvun hidastumista annoksilla, jotka ylittivät 2 mg/kg/vrk (>400 kertaa ihmisen keskimääräinen paikallinen kliininen annos).
raskaus
teratogeeniset vaikutukset
Raskauskategoria C
suun kautta annetun tretinoiinin on osoitettu olevan teratogeeninen rotilla, hiirillä, kaneilla, hamstereilla ja kädellisillä. Se oli teratogeeninen ja fetotoksinen rotilla, kun sitä annettiin suun kautta tai paikallisesti annoksina, jotka olivat 1000-kertaisia ihmisen suositeltuun paikalliseen hoitoannokseen verrattuna. Teratogeenisten annosten vaihtelua eri rotakannoilla on kuitenkin raportoitu. Cynomolgus-apinalla, joka metabolisesti on lähempänä ihmistä tretinoiinin suhteen kuin muilla tutkituilla lajeilla, raportoitiin sikiön epämuodostumia annoksilla 10 mg/kg/vrk tai suuremmilla annoksilla, mutta mitään ei havaittu annoksella 5 mg/kg/vrk (1000 kertaa ihmisen suositellun paikallisen hoitoannoksen keskiarvo), joskin kaikilla annoksilla havaittiin lisääntynyttä luustomuutosta. Annosriippuvaista sikiökuolleisuuden ja abortin lisääntymistä raportoitiin. Samanlaisia tuloksia on raportoitu myös letti-makakeilla.
eläinten TERATOGEENISUUSTESTEISSÄ paikallisesti käytetystä tretinoiinista on saatu epäselvät tulokset. Paikallisen tretinoiinin teratogeenisuudesta (lyhentynyt tai kiertynyt häntä) on näyttöä Wistar-rotilla annoksilla, jotka ovat suurempia kuin 1 mg/kg/vrk (200-kertaisia ihmiselle suositeltuun paikalliseen kliiniseen annokseen verrattuna). Anomalioita (olkaluu: lyhyt 13%, taipunut 6%, päälaen epätäydellisesti luutunut 14%) on raportoitu myös ihon kautta annettaessa 10 mg/kg/vrk.
Uuden-Seelannin valkoisista kaniineista on raportoitu muita raportteja annoksilla, jotka ovat noin 80-kertaisia ihmiselle suositeltuun paikallisesti annettuun annokseen verrattuna ja joilla on todettu kupumaisen pään ja hydrokefalian lisääntymistä, mikä on tyypillistä retinoidien aiheuttamille sikiön epämuodostumille tällä lajilla.
sitä vastoin useat hyvin kontrolloidut eläinkokeet ovat osoittaneet, että ihon kautta annosteltu tretinoiini ei ollut teratogeeninen rotilla 100-kertaisella ja kaniineilla 200-kertaisella ihmisen suositellulla paikallisella hoitoannoksella.
minkä tahansa lääkkeen laajamittaisessa käytössä pieni määrä synnynnäisiä epämuodostumia, jotka liittyvät ajallisesti lääkkeen antoon, on odotettavissa pelkästään sattumalta. Kahden vuosikymmenen aikana on raportoitu kolmattakymmentä tapausta, joissa on ilmennyt tilapäisiä synnynnäisiä epämuodostumia, jotka ovat johtuneet paikallisesti käytettävän tretinoiinin toisen formulaation (Retin-A) kliinisestä käytöstä. Vaikka näistä tapauksista ei ole osoitettu mitään varmaa teratogeenisuuden mallia eikä satunnaista yhteyttä, 5 raportista kuvaa harvinaista syntymävikaluokkaa holoprosenkefaliaa (vikoja, jotka liittyvät etuaivojen epätäydelliseen keskiviivan kehitykseen). Näiden spontaaniraporttien merkitystä sikiöön kohdistuvan riskin kannalta ei tiedetä.
ei-teratogeeniset vaikutukset
ihon kautta tretinoiinin on osoitettu olevan fetotoksinen kaniineilla, kun sitä on annettu annoksina, jotka ovat 100-kertaisia ihmisen suositeltuun paikalliseen kliiniseen annokseen verrattuna. Suun kautta annetun tretinoiinin on todettu olevan sikiötoksinen rotilla, kun sitä on annettu annoksina, jotka ovat 500-kertaisia ihmisen suositeltuun paikalliseen hoitoannokseen verrattuna.
ei kuitenkaan ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia käytöstä raskaana oleville naisille. Refissaa ei pidä käyttää raskauden aikana.
imettävät äidit
ei tiedetä, erittyykö tämä lääke äidinmaitoon. Koska monet lääkkeet erittyvät äidinmaitoon, on noudatettava varovaisuutta annettaessa Refissaa imettäville naisille.
lapsipotilailla
turvallisuutta ja tehoa alle 18-vuotiailla potilailla ei ole osoitettu.
geriatrinen käyttö
turvallisuutta ja tehoa yli 50-vuotiailla ei ole osoitettu.
haittavaikutukset
(KS.varoitukset ja varotoimet kohdat.
kaksoissokkotutkimuksissa, joissa 179 potilasta levitti tretinoiinivoidetta, USP (Emollient) 0, 05% kasvoilleen, tretinoiinivoiteen, USP (Emollient) 0, 05%: iin liittyvät haittavaikutukset rajoittuivat pääasiassa ihoon. Näiden tutkimusten aikana 4% potilaista joutui keskeyttämään tretinoiinivoiteen käytön, USP (Emollient) 0, 05% haittavaikutusten vuoksi. Nämä keskeyttämiset johtuivat ihoärsytyksestä tai siihen liittyvistä ihohaittavaikutuksista.
paikallisia reaktioita, kuten hilseilyä, ihon kuivumista, polttelua, kirvelyä, punoitusta ja kutinaa, raportoitiin lähes kaikilla tutkimushenkilöillä Tretinoiinivoiteen (USP (Emollient)) 0, 05%: n käytön aikana. Nämä löydökset ja oireet olivat yleensä lieviä tai kohtalaisia, ja ne ilmaantuivat yleensä hoidon alkuvaiheessa. Useimmilla potilailla kuivuus, kuorinta ja punoitus uusiutuivat ensimmäisen (24 viikkoa) laskun jälkeen.
yliannostuksen
suositeltua suurempien lääkemäärien käytön ei ole osoitettu johtavan nopeampiin tai parempiin tuloksiin, ja huomattavaa punoitusta, hilseilyä tai epämukavuutta voi esiintyä. Lääkkeen suun kautta nauttiminen voi johtaa samoihin sivuvaikutuksiin kuin ne, jotka liittyvät liialliseen A-vitamiinin saantiin suun kautta.
Refissa Annostus ja antotapa
- Älä käytä Refissaa, jos potilas on raskaana tai yrittää tulla raskaaksi tai jos hänellä on suuri raskauden riski
- Älä käytä Refissaa, jos potilas on auringon polttama tai jos potilaalla on ekseema tai muu krooninen ihosairaus
- Älä käytä Refissaa, jos potilas on luonnostaan herkkä auringonvalolle
- Älä käytä Refissaa, jos potilas käyttää myös lääkkeitä, joiden tiedetään olevan valoherkistäjiä(esim.tiatsidit, tetrasykliinit, fluorokinolonit, fentiatsiinit, sulfonamidit) lisääntyvän valomyrkyllisyyden mahdollisuuden vuoksi.
potilaat tarvitsevat yksityiskohtaisia ohjeita maksimaalisen hyödyn saamiseksi ja kaikkien varotoimien ymmärtämiseksi, jotta tämän valmisteen käyttö olisi mahdollisimman turvallista. Lääkärin tulee tarkistaa potilaan pakkausseloste.
Refissaa tulee levittää kasvoille kerran päivässä ennen vetäytymistä ja käyttää vain sen verran, että koko hoitoalue peittyy kevyesti. Potilaiden tulee pestä kasvonsa varovasti miedolla saippualla, taputella iho kuivaksi ja odottaa 20-30 minuuttia ennen Refissan levittämistä. Potilaan tulee levittää herneen kokoinen määrä kermaa peittämään koko kasvot kevyesti. Emulsiovoidetta levitettäessä on noudatettava erityistä varovaisuutta silmien, korvien, sierainten ja suun välttämiseksi.
Refissan käyttö voi aiheuttaa ohimenevää lämmön tunnetta tai lievää kirvelyä.
kasvojen hienojakoista rypistymistä, kirjavaa hyperpigmentaatiota ja tuntoon liittyvää karheutta saattaa esiintyä vähitellen hoidon aikana. Jopa kuuden kuukauden hoito voi olla tarpeen ennen kuin vaikutukset havaitaan. Suurin osa refissan yhteydessä havaitusta paranemisesta on havaittavissa ensimmäisten 24 hoitoviikon aikana. Sen jälkeen hoito ensisijaisesti ylläpitää paranemista toteutunut ensimmäisen 24 viikkoa.
kun Refissa-hoito lopetetaan, suurin osa potilaista menettää Refissan lievimmät vaikutukset hienoihin ryppyihin, kirjavaan hyperpigmentaatioon ja kasvojen ihon tuntokarheuteen; refissan päivittäisen käytön turvallisuutta ja tehokkuutta yli 48 viikon ajan ei kuitenkaan ole osoitettu.
suositeltua suurempien lääkemäärien käyttö ei välttämättä johda nopeampiin tai parempiin tuloksiin, ja huomattavaa punoitusta, hilseilyä tai epämukavuutta voi esiintyä.
Refissalla hoidetut potilaat voivat käyttää kosmetiikkaa, mutta hoidettavat alueet tulee puhdistaa huolellisesti ennen lääkityksen antamista. (KS. varotoimet kohta.)
miten Refissa toimitetaan
Refissa on saatavilla:
20 g putkia NDC 42851-012-20
40 g putkia NDC 42851-012-40
varastointi
säilytä 20-25°C (68-77°F) . EI SAA JÄÄTYÄ.
vain Rx.
Printed in USA
140904-0118
Valmistaja DPT Laboratories, San Antonio, TX 78215
jakelija zo Skin Health, Inc., Irvine, CA 92618
Refissa®
vain paikallisesti iholle
mikä on tärkeintä tietoa Refissasta ?
Refissa on vakava lääke. Se ei poista ryppyjä tai korjaa auringon vaurioittamaa ihoa. Se voi auttaa hoitamaan hienoja ryppyjä, Täplikäs värimuutoksia ja karkea tunne ihoa, mutta se ei ”paranna” näitä ehtoja. Refissaa tulee käyttää vain terveydenhuollon tarjoajan valvonnassa osana laajaa ihonhoito-ohjelmaa. Tämän ohjelman tulisi sisältää suoran auringonvalon välttäminen (käyttämällä suojavaatteita ja aurinkovoiteita, joiden SPF on vähintään 15) ja muita kosteuttavia kasvovoiteita, jotka eivät sisällä tretinoiinia.
käytä Refissaa vain nukkumaan mennessä. Älä käytä kuivuvia ihonhoitotuotteita. Käytä pienin määrä Refissa tarvitaan ja välttää saada se silmiin, korviin, nenään tai suuhun.
varoitus: Älä käytä Refissaa, jos olet raskaana tai yrität tulla raskaaksi. Vältä auringonvaloa ja muita lääkkeitä, jotka saattavat lisätä herkkyyttäsi auringonvalolle (KS.jäljempänä).
Refissaa ei ole tutkittu yli 50-vuotiailla henkilöillä eikä henkilöillä, joilla on kohtalaisen tai tumman pigmentoitunut iho.
mikä on Refissa?
(What can I expect from Refissa?)
Refissa on vakava lääke, joka voi auttaa hoitamaan, mutta ei ”paranna” hienoja ryppyjä, täplikkäitä ihon värimuutoksia ja karheaa tunnetta ihoa.
tutkimukset osoittavat, että 24 viikon kuluttua noin 30%: lla ihmisistä, jotka käyttivät tretinoiinivoidetta, USP: tä (pehmentävää) 0,05% hienoihin ryppyihin tai täplikkäisiin värimuutoksiin, oli kohtalainen parannus, toisella 35%: lla oli minimaalinen parannus ja 35%: lla ei ollut parannusta. Noin 16% ihmisistä, jotka käyttivät tretinoiini kerma, USP (pehmittävä) 0,05% karkea iho oli kohtalainen parannus, 35% oli minimaalinen parannus, ja 49% ei ollut parannusta. Ei ole näyttöä siitä, että Refissa hoitaa karkeaa ihoa, syviä ryppyjä, kellastuvaa ihoa tai muita ihonhoitoon liittyviä ongelmia.
Refissaa tulee käyttää osana laajaa ihonhoito-ohjelmaa. Tämän ohjelman tulisi sisältää suoran auringonvalon välttäminen (käyttämällä suojavaatteita ja aurinkovoiteita, joiden SPF on vähintään 15) ja muita kosteuttavia kasvovoiteita, jotka eivät sisällä tretinoiinia. Monet ihmiset voivat saavuttaa toivottuja vaikutuksia käyttämällä tätä ohjelmaa käyttämättä Refissa. Älä käytä Refissaa ennen kuin olet kokeillut laajaa ihonhoito-ohjelmaa ilman Refissaa.
Refissaa käytettäessä hienojen ryppyjen, täplikkään ihon värjäytymisen ja karhean ihon paraneminen ei tapahdu välittömästi, vaan se tapahtuu vähitellen ajan myötä. Yleensä saatat huomata joitakin vaikutuksia 3-4 kuukauden kuluttua. Vaikutukset ovat yleensä huomattavimmat noin 6 kuukauden kohdalla, eikä sen jälkeen ole juurikaan tapahtunut parannusta. Jos Refissa lopetetaan, paraneminen heikkenee vähitellen.
refissan turvallisuutta päivittäin yli 48 viikon ajan ei ole osoitettu.
kenen ei pitäisi käyttää Refissaa?
Älä käytä Refissaa, jos olet auringossa tai erittäin herkkä auringolle, jos sinulla on ekseema tai jos ihosi on ärtynyt. Refissa voi aiheuttaa lisääntynyttä ihoärsytystä ja lisääntynyttä alttiutta auringonpolttamille.
koska Refissa saattaa tehdä ihostasi herkemmän auringonvalolle, kerro lääkärillesi, jos käytät myös muita lääkkeitä, jotka lisäävät herkkyyttä auringonvalolle, koska sinun ei pitäisi käyttää Refissaa näiden lääkkeiden kanssa. Näitä ovat muun muassa tiatsidit (käytetään korkean verenpaineen hoitoon), tetrasykliinit, fluorokinolnes tai sulfonamidit (käytetään infektion hoitoon) ja fentiatsiinit (käytetään vakavien emotionaalisten ongelmien hoitoon). Jos käytät reseptilääkkeitä, reseptilääkkeitä tai kasvovoiteita, tarkista terveydenhuollon ammattilaiselta, että niillä ei ole yhteisvaikutuksia Refissan kanssa.
Raskausvaroitus: turvallista käyttöä raskauden aikana ei ole osoitettu. On raportoitu sikiövaurioista koe-eläimillä ja ihmisillä, joille annettiin tretinoiinia suun kautta. Älä käytä Refissaa, jos olet raskaana tai yrität tulla raskaaksi.
ei tiedetä, erittyykö Refissa imeväisille äidinmaidon kautta. Turvallista käyttöä lapsille ei ole osoitettu.
Refissan turvallisuutta ja tehokkuutta ei ole osoitettu yli 50-vuotiailla tai tummemman ihon värityksillä.
Miten minun pitäisi käyttää Refissaa?
sinun tulisi levittää Refissa kasvoillesi kerran päivässä ennen nukkumaanmenoa käyttämällä vain sen verran, että koko hoitoalue peittyy kevyesti. Pese kasvosi kevyesti miedolla saippualla, taputtele iho kuivaksi ja odota 20-30 minuuttia ennen Refissan levittämistä. Levitä herneen kokoinen määrä kermaa peittämään koko kasvosi. Saatat tuntea lämpöä tai hieman kirvelyä, kun Refissa levitetään ensimmäisen kerran.
emulsiovoidetta levitettäessä on oltava erityisen varovainen, jotta vältät silmiä, korvia, sieraimia tai suuta. Refissa voi aiheuttaa voimakasta punoitusta, kutinaa, kirvelyä, kirvelyä ja kuorintaa, jos sitä käytetään näille alueille.
suuremman refissa-annoksen käyttö ei nopeuta tuloksia ja voi aiheuttaa yliannostuksen. Yliannostus voi aiheuttaa ihon punoittamista ja hilseilyä sekä kipua tai epämukavuutta.
voit käyttää kosmetiikkaa Refissan levittämisen jälkeen. Puhdista kasvosi huolellisesti ennen kuin levität Refissaa uudelleen.
Mitä minun pitäisi välttää Refissan käytön aikana?
Refissa lisää herkkyyttä auringonvalolle. Vältä auringonvaloa mahdollisimman paljon. Käytä suojavaatetusta ja aurinkovoidetta, jonka SPF on vähintään 15. Älä ota aurinkoa tai käytä aurinkolamppuja. Jos olet herkkä auringonvalolle tai sinulla on työ, joka vaatii sinua olemaan ulkona auringossa pitkiä aikoja, sinun täytyy noudattaa äärimmäistä varovaisuutta.
Kun käytät Refissaa, vältä tuotteita, jotka voivat kuivattaa tai ärsyttää ihoa. Vältä esimerkiksi iholle levitettäviä tuotteita, jotka sisältävät alkoholia, mausteita tai limettiä. Vältä myös putsareita, karvanpoistoa tai muita tuotteita, jotka voivat ärsyttää ihoa.
mitkä ovat Refissan mahdolliset haittavaikutukset?
yleisimmät haittavaikutukset ovat ihoreaktiot. Kutinaa, punoitusta ja ihon kuivumista on raportoitu. Samoin on palava, kirvelevä ja hilseilevä iho. Nämä ovat useimmiten lieviä ja yleisimpiä hoidon alussa.
Mistä saan lisätietoja?
tässä pakkausselosteessa on yhteenveto tärkeimmistä refissaa koskevista tiedoista. Jos haluat lisätietoja, keskustele lääkärisi tai muun terveydenhuollon tarjoajan kanssa. On myös pakkausseloste kirjoitettu terveydenhuollon ammattilaisille, että apteekkisi voi antaa sinulle.
kysy lääkäriltäsi neuvoa haittavaikutuksista. HAITTAVAIKUTUKSISTA VOI ILMOITTAA FDA: LLE 1-800-FDA-1088: SSA.
PÄÄNÄYTTÖPANEELI – 40 g putkipakkaus
NDC 42851-012-40
117471-0118
Refissa ®
Tretinoin Cream,
USP (pehmittävä) 0.05%
Rx Only
NET WT 40 g
FDA APPROVED

| Refissa TRETINOIN (EMOLLIENT) tretinoin cream |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
Labeler – ZO Skin Health, Inc. (826468527)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| DPT Laboratories, Ltd. | 832224526 | manufacture(42851-012) | |
lisää Refissasta (tretinoiini ajankohtainen)
- haittavaikutukset
- annostustiedot
- lääkkeiden yhteisvaikutukset
- hinnoittelu &kuponkeja
- en Español
- lääkeluokka: ajankohtaiset akneaineet
raskauden tai imetyksen aikana
consumer resources
- potilastiedot
- refissa topical (Advanced Reading)
professional resources
- lääkemääräystiedot
- tretinoine Gel microsphere (FDA)
muut merkit retin-a, Renova, atralin, altreno, … + 2 muuta
aiheeseen liittyvää hoito-ohjetta
- ihon kuvaaminen
lääketieteellinen Vastuuvapauslauseke