Trifenyylifosfiinia
PPh3 käytetään laajalti orgaanisessa synteesissä. Sen käyttöä ohjaavat ominaisuudet ovat sen nukleofiilisyys ja pelkistävä luonne. PPh3: n nukleofiilisuudesta kertoo sen reaktiivisuus elektrofiilisiä alkeeneja, kuten Michael-hyväksyjiä, ja alkyylihalideja kohtaan. Yhdistettä käytetään myös biaryyliyhdisteiden synteeseissä, kuten Suzuki-reaktiossa.
- Kvaternisaatiomedit
- Mitsunobu-reaktiossa trifenyylifosfiinin ja Di-isopropyyliatsodikarboksylaatin (”DIADI” tai sen DIETYYLIANALOGI, kuollut) seos muuttaa alkoholin ja karboksyylihapon esteriksi. DIADI pelkistyy sen toimiessa vetytunnistimena ja PPh3 hapettuu OPPh3: ksi. Appel-reaktiossa käytetään PPh3: n ja CX4: n (X = Cl, Br) seosta alkoholien muuttamiseksi alkyylihalideiksi. Trifenyylifosfiinioksidi (OPPh3) on sivutuote. PPh3 + CBr4 + RCH2OH → OPPh3 + RCH2Br + HCBr3
- Deoksigenationedit
- Sulfonaatioedit
- pelkistyminen DIFENYYLIFOSFIDIDEDITIKSI
- Siirtymämetallikomplekseja
Kvaternisaatiomedit
PPh3 yhdistyy alkyylihalidien kanssa muodostaen fosfoniumsuoloja. Kvaternisaatioreaktion rakenne noudattaa tavallista kaavaa, jossa bentsyyli− ja allyylihalidit ovat erityisen tehokkaita reagoijia:
PPh3 + CH3I → +i –
nämä suolat, jotka voidaan usein eristää kiteisinä kiintoaineina, reagoivat vahvojen emästen kanssa muodostaen ylidejä:
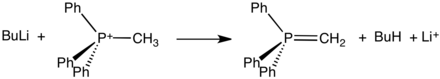
tällaiset ylidit ovat keskeisiä reagensseja Wittig-reaktioissa, joita käytetään aldehydien ja ketonien muuntamiseen alkeeneiksi.
Aryylihalidit kvaternisoituvat PPh3: ksi, jolloin saadaan Tetrafenyylifosfoniumsuoloja:
PPh3 + PhBr → Br
reaktio vaatii kuitenkin kohonneita lämpötiloja ja metallisia katalyyttejä.
Mitsunobu-reaktiossa trifenyylifosfiinin ja Di-isopropyyliatsodikarboksylaatin (”DIADI” tai sen DIETYYLIANALOGI, kuollut) seos muuttaa alkoholin ja karboksyylihapon esteriksi. DIADI pelkistyy sen toimiessa vetytunnistimena ja PPh3 hapettuu OPPh3: ksi.
Appel-reaktiossa käytetään PPh3: n ja CX4: n (X = Cl, Br) seosta alkoholien muuttamiseksi alkyylihalideiksi. Trifenyylifosfiinioksidi (OPPh3) on sivutuote. PPh3 + CBr4 + RCH2OH → OPPh3 + RCH2Br + HCBr3
tämä reaktio alkaa pph3: n nukleofiilisella hyökkäyksellä CBr4: ään, joka on edellä mainitun kvaternisaatioreaktion laajennus.
Deoksigenationedit
PPh3: n helppoa hapetusta hyödynnetään sen käytössä orgaanisten peroksidien deoksigenoinnissa, mikä tapahtuu yleensä konfiguraation säilyessä:
PPh3 + RO2H → OPPh3 + ROH (R = alkyyli)
sitä käytetään myös orgaanisten otsonidien hajottamiseen ketoneiksi ja aldehydeiksi, joskin dimetyylisulfidi on suositumpi reaktiossa sivutuotteena, dimetyylisulfoksidi erotetaan reaktioseoksesta helpommin kuin trifenyylifosfiinioksidi. Aromaattiset N-oksidit pelkistetään vastaavaksi amiiniksi korkeassa saantoasteessa huoneenlämmössä säteilytyksellä:

Sulfonaatioedit
PPh3: n Sulfonaatio antaa Tris(3-sulfofenyyli)fosfiinin, P(C6H4-3-SO3−)3 (TPPTS), yleensä eristettynä trinatriumsuolaksi. Toisin kuin PPh3, TPPTS on vesiliukoinen, samoin sen metallijohdannaiset. TPPT: n rodiumkomplekseja käytetään tietyissä teollisissa hydroformylointireaktioissa.

pelkistyminen DIFENYYLIFOSFIDIDEDITIKSI
Litiumiksi THF: ssä sekä Na tai K reagoivat PPh3: n kanssa, jolloin saadaan Ph2PM (M = Li, Na, K). Nämä suolat ovat monikäyttöisiä esiasteita tertiäärisille fosfiineille. Esimerkiksi 1,2-dibromietaani ja Ph2PM reagoivat antaen Ph2PCH2CH2PPh2. Heikot hapot kuten ammoniumkloridi, muuntavat Ph2PM (M = Li, Na, K) difenyylifosfiiniksi:
(C6H5)2pm + H2O → (C6H5)2PH + MOH
Siirtymämetallikomplekseja
Trifenyylifosfiini sitoutuu hyvin useimpiin siirtymämetalleihin, erityisesti ryhmien 7-10 Keski-ja myöhäissiirtymämetalleihin. Pph3: n Steerisen bulkin Tolman-kartiokulma on 145°, joka on P(C6H11)3: n (170°) ja P(CH3)3: n (115°) kulmien välissä. Homogeenisessa katalyysissä NiBr2 (PPh3) 2: ta käytti Walter Reppe akrylaattiestereiden synteesissä alkyyneistä, hiilimonoksidista ja alkoholeista. PPh3: n käyttö yleistyi, kun sitä käytettiin hydroformylointikatalyytissä RhH(PPh3)3(CO).