VoLumen
yleisnimi: bariumsulfaatti
annosmuoto: oraalisuspensio
Drugs.com. viimeksi päivitetty loka 1, 2020.
- yleiskatsaus
- haittavaikutukset
- ammatillinen
- raskaus
- lisää
annostus
Vastuuvapauslauseke: FDA ei ole todennut tätä lääkettä turvalliseksi ja tehokkaaksi, eikä FDA ole hyväksynyt tätä pakkausmerkintää. Jos haluat lisätietoja hyväksymättömistä huumeista, klikkaa tästä.
- VoLumen kuvaus
- Kliininen farmakologia
- käyttöaiheet ja käyttö
- vasta-aiheet
- Varoitukset
- varotoimet
- Yleiset
- tietoa
- Lääkkeiden yhteisvaikutukset
- käyttö raskauden aikana
- imettävät äidit
- BARIUMSULFAATTIVALMISTEIDEN käyttöön liittyvät haittavaikutukset
- allergiset reaktiot
- yliannostus
- annostus ja antotapa
- suun kautta: maha – suolikanavan merkintä
- säilytys
- miten Volumenia toimitetaan
- More about Volumen (barium sulfate)
- Consumer resources
- hoito-oppaita
VoLumen kuvaus
VoLumen® on bariumsulfaattisuspensio 0, 1% w/v, 0, 1% w / w suun kautta annettuna. Yksi 100 mL sisältää 0, 1 g bariumsulfaattia. Bariumsulfaatti on suuren molekyylitiheytensä vuoksi läpinäkymätön röntgensäteilylle ja toimii siksi positiivisena varjoaineena röntgentutkimuksissa. Vaikuttava aine on bariumsulfaatti ja sen rakennekaava on BaSO4. Bariumsulfaatti esiintyy hienona, valkoisena, hajuttomana, mauttomana, kookkaana jauheena, joka ei sisällä karkeutta. Sen vesisuspensiot ovat neutraaleja litmukselle. Se on käytännöllisesti katsoen liukenematonta veteen, happojen ja emästen liuoksiin sekä orgaanisiin liuottimiin.
inaktiiviset aineet: sitruunahappo, luonnonkumi, bentsoehappo, natriumsitraatti, luonnollinen ja keinotekoinen mustikkamaku, kaliumsorbaatti, puhdistettu vesi, sakariininatrium, simetikoniemulsio, natriumbentsoaatti ja sorbitoli.
Kliininen farmakologia
bariumsulfaatti on suuren molekyylitiheytensä vuoksi läpinäkymätön röntgensäteilylle ja toimii siten positiivisena varjoaineena röntgentutkimuksissa. Bariumsulfaatti on biologisesti inertti ja siksi se ei imeydy tai metaboloidu elimistössä, ja eliminoituu ruoansulatuskanavan muuttumattomana.
käyttöaiheet ja käyttö
tietokonetomografiassa ruoansulatuskanavan samentamiseksi.
vasta-aiheet
tätä valmistetta ei tule käyttää potilaille, joilla on tunnettu tai epäilty ruoansulatuskanavan perforaatio tai yliherkkyys bariumsulfaatille tai jollekin tämän bariumsulfaattimuodon komponentille.
Varoitukset
harvoin on raportoitu anafylaktoidisia vakavia allergisia reaktioita bariumsulfaatin varjoaineiden käytön jälkeen. Vakavien reaktioiden kiireellistä hoitoa varten on oltava käytettävissä asianmukaisesti koulutettu henkilökunta ja tilat, ja niiden on oltava käytettävissä vähintään 30-60 minuuttia annostelun jälkeen, koska viivästyneitä reaktioita voi esiintyä.
varotoimet
Yleiset
diagnostiset toimenpiteet, joihin liittyy röntgensäteitä läpäisemättömien varjoaineiden käyttö, on suoritettava sellaisen henkilöstön johdolla, jolla on tarvittava koulutus ja joka tuntee tarkasti suoritettavan toimenpiteen. Erityistä huomiota on kiinnitettävä aiempaan keuhkoastmaan, atopiaan, josta on osoituksena heinänuha ja ekseema, tai aiempaan varjoaineen aiheuttamaan reaktioon. Varovaisuutta tulee noudattaa käytettäessä radioaktiivista ainetta vaikeasti heikkokuntoisilla potilailla ja potilailla, joilla on selvästi kohonnut verenpaine tai pitkälle edennyt sydänsairaus. Nauttimista barium ei suositella potilaille, joilla on ollut ruokaa aspiraatio. Jos barium-tutkimuksia tarvitaan näillä potilailla tai potilailla, joilla nielemismekanismin eheyttä ei tunneta, on noudatettava varovaisuutta. Jos bariumia imetään kurkunpäähän, on seuraava annostelu keskeytettävä välittömästi.
tietoa
ennen tämän valmisteen antamista bariumsulfaattidiagnostiikkaa käyttäviä potilaita tulee kehottaa:
- kertomaan lääkärilleen, jos he ovat raskaana.
- kerro lääkärillesi, jos he ovat allergisia jollekin lääkkeelle tai ruoalle tai jos heillä on ollut aiempia reaktioita bariumsulfaattivalmisteista tai muista röntgentutkimuksissa käytetyistä varjoaineista (KS.varotoimet-Yleiset).
- kerro lääkärilleen kaikista muista lääkkeistä, joita he parhaillaan käyttävät.
- hakeudu välittömästi lääkärin hoitoon, jos he saavat allergisen reaktion tämän valmisteen käytön jälkeen.
Lääkkeiden yhteisvaikutukset
BARIUMSULFAATTIFORMULAATIOIDEN esiintyminen ruoansulatuskanavassa saattaa muuttaa samanaikaisesti käytettyjen terapeuttisten aineiden imeytymistä. Imeytymisen mahdollisten muutosten minimoimiseksi on harkittava bariumsulfaatin antamista erillään muiden aineiden annostelusta.
käyttö raskauden aikana
säteilyn tiedetään aiheuttavan haittaa kohdussa altistuneelle sikiölle. Siksi röntgenkuvausta tulee käyttää vain, jos lääkäri katsoo, että sen käyttö on välttämätöntä raskaana olevan potilaan hyvinvoinnille.
imettävät äidit
bariumsulfaattivalmisteita voidaan käyttää imetyksen aikana.
BARIUMSULFAATTIVALMISTEIDEN käyttöön liittyvät haittavaikutukset
haittavaikutukset, kuten pahoinvointi, oksentelu, ripuli ja vatsakouristukset, ovat harvinaisia ja yleensä lieviä. Vakavia reaktioita (noin 1: 1 000 000) ja kuolemantapauksia (noin 1: 10 000 000) on esiintynyt. Toimenpidekomplikaatiot ovat harvinaisia, mutta niihin voivat kuulua aspiraatiopneumoniitti, granuloomamuodostus, intravasaatio, embolisaatio ja peritoniitti suolen perforaation jälkeen, vasovagaali ja pyörtyminen jaksot, ja kuolemantapauksia.
allergiset reaktiot
koska allergisten reaktioiden todennäköisyys atooppisilla potilailla on lisääntynyt, on tärkeää, että kaikki tunnetut ja epäillyt allergiat sekä allergian kaltaiset oireet, kuten nuha, keuhkoastma, ekseema ja urtikaria, selvitetään ennen mitään lääketieteellistä toimenpidettä, jossa käytetään näitä valmisteita. Lievä allerginen reaktio on todennäköisesti yleistynyt kutina, punoitus tai urtikaria (noin 1/250 000). Tällaiset reaktiot reagoivat yleensä antihistamiiniin, kuten 50 mg difenhydramiinia tai sen vastaavaa. Harvinaisemmissa tapauksissa voi kehittyä vakavampia reaktioita (noin 1/1 000 000) kurkunpään turvotusta, bronkospasmia tai hypotensiota. Vaikeille reaktioille, jotka saattavat vaatia hätätoimenpiteitä, on usein ominaista perifeerinen vasodilataatio, hypotensio, refleksi takykardia, hengenahdistus, kiihtyneisyys, sekavuus ja syanoosi, joka etenee tajuttomuuteen. Hoito tulee aloittaa välittömästi 0, 3-0, 5 cc ihonalaisella epinefriinillä 1:1000. Jos bronkospasmi on vallitseva, 0, 25-0, 50 grammaa laskimoon annettavaa aminofylliiniä tulee antaa hitaasti. Tarvittavat vasopressorit saattavat olla tarpeen. Adrenokortikosteroidit, vaikka ne annettaisiin laskimoon, eivät vaikuta merkittävästi akuutteihin allergisiin reaktioihin muutaman tunnin ajan. Näiden lääkeaineiden antamista ei tule pitää hätätoimenpiteenä allergisten reaktioiden hoidossa. Pelokkaat potilaat voivat kehittyä heikkous, kalpeus, tinnitus, voimakas hikoilu ja bradykardia annettaessa mitään diagnostisia aineita. Tällaiset reaktiot ovat yleensä ei-allergisia, ja niitä voidaan parhaiten hoitaa antamalla potilaan olla makuulla vielä 10-30 minuuttia tarkkailussa.
yliannostus
harvoissa tapauksissa toistuvan annostelun jälkeen voi esiintyä vaikeita vatsakramppeja, pahoinvointia, oksentelua, ripulia tai ummetusta. Nämä osoitetut vasteet voivat esiintyä sekä fluoroskooppisissa että TT-toimenpiteissä. Oireet ovat ohimeneviä, eikä niitä pidetä vakavina. Oireita voidaan hoitaa tällä hetkellä hyväksyttyjen sairaanhoitostandardien mukaisesti.
annostus ja antotapa
annettavan CT-bariumsulfaattisuspension tilavuus riippuu tutkittavalla alueella(tutkittavilla alueilla) tarvittavan kontrastin asteesta ja laajuudesta sekä käytetystä tekniikasta.
potilaan tulee aloittaa Volumenin® juominen noin 20-30 minuuttia ennen suunniteltua toimenpidettä. On suositeltavaa, että potilas kuluttaa useita pulloja, noin 900 mL – 1,350 mL kokonaistilavuus ennen tentti tai käyttää ohjeiden lääkäri. Parantuneiden mahan merkintöjen vuoksi potilaan on nautittava viimeiset 200 mL juuri ennen kuvausta. Suolen merkintä on johdonmukainen, koska BaSO4: n 0,1%: n pitoisuus on yhdenmukainen. Suolen lumenin merkintää voidaan parantaa lisäämällä nautitun Volumenin® määrää (KS.alla). Muita annostusohjeita voidaan noudattaa tarpeen mukaan. Potilailla, joilla merkintä on ongelmallinen, kuten lihavuus ja viivästynyt kauttakulku, parempi merkintä voi olla mahdollista lisäämällä VoLumen® – valmisteen kokonaistilavuutta 1 800 mL: aan tai neljään (4) pulloon.
säilytys
USP valvottu huoneenlämpötila, 20-25°C (68-77°F). Suojaa jäätymiseltä.
miten Volumenia toimitetaan
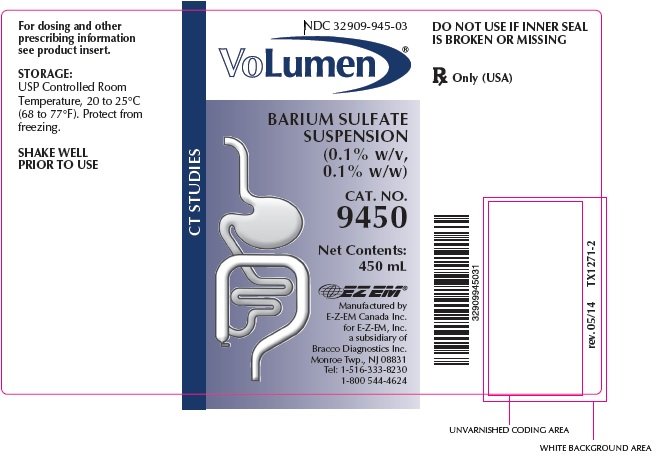
Volumenia® toimitetaan seuraava määrä: 450 mL: n pulloja,
Cat. Nro 9450, NDC 32909-945-03
Rx Only (USA)
ravista hyvin ennen käyttöä
patentti vireillä
valmistanut
E-Z-EM Canada Inc.
for E-Z-EM, Inc.
Bracco Diagnostics Inc: n tytäryhtiö.
Monroe Township, NJ 08831
Tel: 1-516-333-8230 1-800 544-4624
rev. 05/14 TX1272-3 ©2006 E-Z-EM, Inc.
VoLumen-Bariumsulfaattisuspensio
NDC: 32909-945-03
| VoLumen barium sulfate suspension |
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
Labeler – E-Z-EM Canada Inc (204211163)
Registrant – E-Z-EM, INC. (002041226)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| E-Z-EM Canada Inc | 204211163 | PACK(32909-945), ANALYSIS(32909-945), LABEL(32909-945), MANUFACTURE(32909-945) | |
More about Volumen (barium sulfate)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Pricing & Kupongit
- En Español
- 1 Review
- Drug class: ei-jodatut varjoaineet
- Advanced Reading
- Lääkemääräystiedot
- tietokonetomografia
Consumer resources
Professional resources
muut merkit NeuLumEX, Liquid E-Z Paque, HD 200 Plus, Entrobar, … + 30 lisää
hoito-oppaita
lääketieteellinen Vastuuvapauslauseke