Cellules gliales de la Rétine par Helga Kolb
Helga Kolb
Trois types de cellules gliales de base se trouvent dans la rétine humaine, les cellules de Muller, l’astroglie et la microglie. Tous ont été décrits pour la rétine par Cajal il y a plus de cent ans (1892).
1. Cellules de Muller.
Les cellules de Muller sont la principale cellule gliale de la rétine. Ils forment des structures de support architecturales s’étendant radialement sur l’épaisseur de la rétine et constituent les limites de la rétine au niveau de la membrane limitante externe et interne respectivement. Une compréhension complète de la forme d’une cellule de Muller est mieux visible après la coloration de Golgi, comme le montre à l’origine Cajal (1892) ci-dessous.
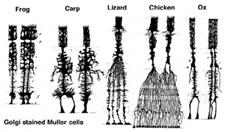
Fig. 1. Cellules de Muller colorées à Golgi
Les corps de cellules de Muller se trouvent dans la couche nucléaire interne et projettent des processus irrégulièrement épais et minces dans les deux sens vers la membrane limitante externe et vers la membrane limitante interne. Les processus cellulaires de Muller s’insinuent entre les corps cellulaires des neurones dans les couches nucléaires et les groupes d’enveloppe des processus neuronaux dans les couches plexiformes (Fig. 1). En fait, les processus neuronaux rétiniens ne sont autorisés que par contact direct, sans envelopper les processus cellulaires de Muller, à leurs synapses.
Une seule cellule progénitrice donne naissance à la fois aux cellules de Muller et aux neurones rétiniens (Turner et Cepko, 1987) bien qu’apparemment en deux phases. Les neurones de phase les plus précoces nés à la marge apicale du neuroépithélium adjacent à l’épithélium pigmentaire produisent des neurones primaires constitués de cellules coniques, de cellules horizontales et de cellules ganglionnaires (Fig. 2, à droite). La deuxième phase de cellules également nées aux marges apicales produit des cellules de Muller et des photorécepteurs bâtonnets, des cellules bipolaires et des cellules amacrine (Reichenbach et Robinson, 1995) (Fig. 2, à gauche). Tous les neurones en développement et les cellules de Muller doivent migrer vers l’intérieur jusqu’à leur position finale et on pense que les processus et les troncs des cellules de Muller guident une grande partie des migrations de neurones et dirigent les différenciations des neurites.
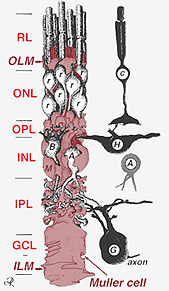
Fig. 2. Dessin schématique en 3D de la relation entre la cellule de Muller et les autres neurones rétiniens
Les jonctions formant la membrane limite externe se trouvent entre les cellules de Muller et les autres cellules de Muller et les cellules photoréceptrices sous forme de desmosomes robustes ou de zonula adherens. Chez certaines espèces, des jonctions lacunaires (associations membranaires spécialisées et canaux permettant le passage de petites molécules et d’ions) ou des jonctions serrées font partie de ces jonctions cellulaires de Muller (Miller et Dowling, 1970), mais ce n’est pas le cas chez les espèces de mammifères où aucun couplage colorant n’a jamais été observé (Robinson et al., 1993; Reichenbach et Robinson, 1995). La surface de la cellule de Muller faisant face à l’épithélium pigmentaire et à l’espace sous-rétinien est élargie par de nombreuses projections de la membrane cellulaire de Muller appelées villosités apicales. La membrane de limitation interne, en revanche, est formée par les pieds d’extrémité coniques de la cellule de Muller mais on ne voit ici aucune jonction spécialisée. Les cellules de Muller forment également des pieds d’extrémité sur les gros vaisseaux sanguins rétiniens à la surface interne de la rétine. La surface de la membrane cellulaire de Muller tournée vers le vitré est recouverte d’un matériau mucopolysaccharidique et forme ainsi une véritable membrane basale.
Les cellules de Muller contiennent du glycogène, des mitochondries et des filaments intermédiaires qui sont immunoréatifs pour la vimentine et, dans une certaine mesure, pour la protéine acide fibrillaire gliale (GFAP). Ces derniers filaments se trouvent normalement dans la moitié interne des cellules de Muller rétiniennes et leurs pieds terminaux (Fig. 3, à gauche), mais à la suite d’un traumatisme de la rétine tel qu’un décollement de la rétine, la vimentine et la GFAP sont massivement régulées à la hausse et se retrouvent dans toute la cellule (Fig. 3, à droite) (Guerin et coll., 1990; Fisher et Lewis, 1995).
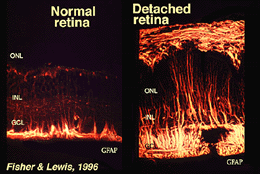
Fig. 3. immunoréactivité GFAP dans les cellules de Muller
Les cellules de Muller ont une gamme de fonctions qui sont toutes vitales pour la santé des neurones rétiniens. Les cellules de Muller fonctionnent dans une relation symbiotique avec les neurones (pour une excellente critique, voir Reichenbach et Robinson, 1995). Ainsi, les fonctions des cellules de Muller comprennent:
- Fournissant des produits finaux du métabolisme anaérobie (dégradation du glycogène) pour alimenter le métabolisme aérobie dans les cellules nerveuses.
- Ils épongent les déchets neuronaux tels que le dioxyde de carbone et l’ammoniac et recyclent les transmetteurs d’acides aminés usés.
- Ils protègent les neurones de l’exposition à des neurotransmetteurs en excès tels que le glutamate en utilisant des mécanismes d’absorption bien développés pour recycler cet émetteur. Ils sont particulièrement caractérisés par la présence de concentrations élevées de glutamine synthase.
- Ils peuvent être impliqués à la fois dans la phagocytose des débris neuronaux et dans la libération de substances neuroactives telles que le GABA, la taurine et la dopamine.
- On pense qu’ils synthétisent l’acide rétinoïque à partir du rétinol (l’acide rétinoïque est connu pour être important dans le développement de l’œil et du système nerveux) (Edwards, 1994)
- Ils contrôlent l’homéostasie et protègent les neurones des changements délétères de leur environnement ionique en prenant le K+ extracellulaire et en le redistribuant.
- Ils contribuent à la génération de l’onde b de l’électrorétinogramme (ERG) (Miller et Dowling, 1970; Newman et Odette, 1984), de la composante P3 lente de l’ERG (Karwoski et Proenza, 1977) et de la réponse au seuil scotopique (STR) (Frishman et Steinberg, 1989). Ils le font par régulation de la distribution de K+ à travers la bordure vitrée rétinienne, à travers toute la rétine et localement dans la couche plexiforme interne de la rétine (Fig. 4, de Reichenbach et Robinson, 1995, adapté de Newman, 1989).

Fig. 4. Régulation de K+ par les cellules de Muller dans les cellules de Muller
2. Astrocytes.
Les astrocytes ne sont pas des cellules gliales du neuroépithélium rétinien, mais pénètrent dans la rétine en développement à partir du cerveau le long du nerf optique en développement (Stone et Dreher, 1987; Chan-Ling 1994). Ils ont une morphologie caractéristique d’un corps cellulaire aplati et une série fibreuse de processus rayonnants. Les filaments intermédiaires remplissent leurs processus et ainsi ils se colorent considérablement avec des anticorps contre le GFAP (Schnitzer, 1988). Les corps et processus des cellules astrocytaires sont presque entièrement limités à la couche de fibres nerveuses de la rétine. Leur morphologie change de la périphérie à la tête du nerf optique : d’une forme étoilée symétrique dans la rétine périphérique (Fig. 5a et b) (Schitzer, 1988) à extrêmement allongé près du nerf optique (Fig. 6 et 7).
 Fig. 5a. Astrocytes dans la rétine périphérique. Schnitzer, 1988 |
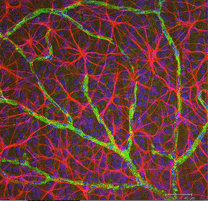 Fig. 5 ter. Astrocytes (rouges) dans la rétine du rat parmi les cellules ganglionnaires (bleues) et associées aux vaisseaux sanguins (vertes). Avec l’aimable autorisation de Laura Fernandez-Sanchez et Nicolas Cuenca |
Dans la coloration immunocytochimique (Fig. 5b) et dans les injections intracellulaires de HRP (Fig. 7) les astrocytes colorés présentent clairement des processus alignés le long des axones des cellules ganglionnaires traversant la couche de fibres nerveuses. Dans la distribution, les astrocytes atteignent leur apogée sur la tête du nerf optique et ont une diminution assez uniforme de la densité des anneaux rayonnants de la tête nerveuse. Ils ne sont pas présents dans la fovéa avasculaire ou l’ora serrata.
 Fig. 6. Astrocytes dans la rétine centrale. Schnitzer, 1988 |
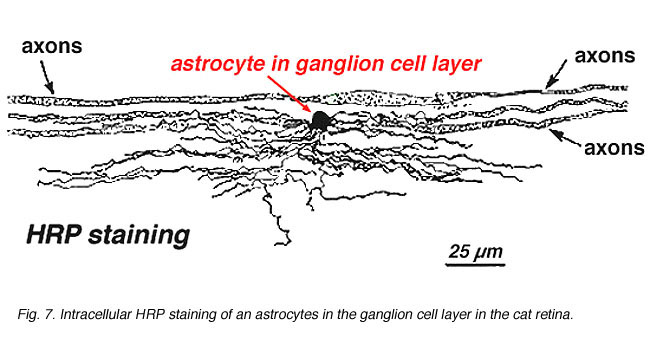 Fig. 7. Astrocytes dans la rétine du chat colorés par injection intracellulaire de HRP. Avec l’aimable autorisation de Ralph Nelson. |
Des astrocytes épais et minces ont été distingués sur la base d’une coloration avec des anticorps dirigés contre le GFAP (Trevino et al., 1996). Ainsi, les astrocytes sont disposés sur la surface des faisceaux d’axones des cellules ganglionnaires lorsqu’ils se dirigent vers la tête du nerf optique formant un tube à travers lequel les axones passent (Fig. 8). Des jonctions gap et des jonctions zonula adherens ont été décrites entre des processus astrocytaires dans la rétine du chat (Höllander et al., 1991).
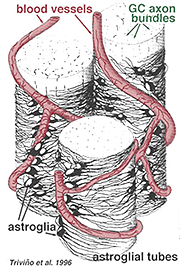
Fig. 8. Bloc d’astrocytes 3-D disposés sur la surface des faisceaux d’axones de cellules ganglionnaires
Les vaisseaux sanguins circulant dans et parmi les faisceaux de cellules ganglionnaires sont également couverts par les deux processus et même un corps cellulaire occasionnel d’un astrocyte. La fonction des astrocytes enveloppant les axones des cellules ganglionnaires et la relation avec les vaisseaux sanguins de la couche de fibres nerveuses suggèrent qu’ils sont des gaines gliales axonales et vasculaires et font partie d’une barrière hémato-encéphalique. Semblables aux cellules de Muller, elles sont connues pour contenir du glycogène abondant et elles peuvent constituer un service nutritif en fournissant du glucose aux neurones. En outre, ils jouent probablement un rôle dans l’homéostasie ionique dans la régulation des niveaux de potassium extracellulaires et du métabolisme des neurotransmetteurs comme le GABA.
3. Cellules microgliales.
Le troisième type de cellules gliales est censé être d’origine mésodermique et donc, à proprement parler, ne sont pas neurogliales comme le sont les astrocytes et les cellules de Muller. Ils pénètrent dans la rétine en coïncidence avec les précurseurs mésenchymateux des vaisseaux sanguins rétiniens en développement (Chan-Ling, 1994). Les cellules microgliales sont omniprésentes dans la rétine humaine et se trouvent dans chaque couche de la rétine.
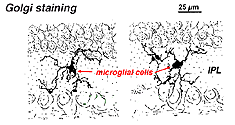
Dans la rétine tachée de Golgi, elles ressemblent à des formes étranges et multipolaires avec de petits corps cellulaires et des processus courts irréguliers. En fait, dans les préparations de Golgi, elles ont parfois été confondues avec des cellules nerveuses, en particulier lorsqu’elles se trouvent dans une couche nucléaire avec une seule orientation de leurs processus dans la couche plexiforme.
Fig. 9. Coloration de Golgi des cellules microgliales
Les cellules microgliales peuvent être de deux types. On pense qu’une forme pénètre dans la rétine aux premiers stades de développement à partir du mésenchyme du nerf optique et reste dormante dans les couches rétiniennes pendant une grande partie de la vie de la rétine. L’autre forme de microglie semble être des cellules transmises par le sang, pouvant provenir de péricytes vasculaires (Boycott et Hopkins, 1981; Gallego, 1986). Les deux types peuvent être stimulés dans une fonction macrophagique après un traumatisme de la rétine, puis ils s’engagent dans une phagocytose des neurones rétiniens en dégénérescence.

Fig. 10 bis. Cellule microgliale tachée de lectine de Chan-Lin, 1994.

Fig. 10b. Rétine humaine avec Astrocytes et Microglie. Cette image de Scott McLeod, du laboratoire de Jerry Lutty, est une préparation complète de la rétine humaine triple lanelée d’anticorps fluorescents qui colorent les vaisseaux sanguins (bleu), les astrocytes (rouge) et la microglie (verte).
4. Référence.
Boycott BB, Hopkins JM. Microglie dans la rétine du singe et d’autres mammifères; sa distinction avec les autres types de cellules glies et horizontales. Neurosciences.1981;6:679–688.
Cajal SR. Dans: Thorpe SA, Glickstein M, traducteurs. 1892. La structure de la rétine. Thomas, 1972.
Chan-Ling T. Interactions gliales, neuronales et vasculaires dans la rétine des mammifères. Prog. Ret. Eye Res. 1994; 13:357-389.
Edwards RB. Biosynthèse de l’acide rétinoïque par les cellules gliales de Müller : un modèle pour le système nerveux central? Prog. Ret. Eye Res. 1994; 13:231-242.
Fisher SK, Lewis GP. Photorécepteurs et au-delà: effets cellulaires et moléculaires du décollement de la rétine.2e Symposium sur les Sciences visuelles du Grand Bassin, II, Presses de l’Université de l’Utah. 1995
Frishman LJ, Steinberg RH. Augmentation de l’o évoquée par la lumière dans la partie proximale de la rétine du chat adaptée à l’obscurité. J Neurophysiol. 1989;61:1233–1243.
Gallego A. Études comparatives sur les cellules horizontales et une note sur les cellules microgliales. Prog. Ret. Rés. 1986; 5:165-206.
Guerin CJ, Anderson DH, Fisher SK. Des modifications de l’immunomarquage des filaments intermédiaires se produisent en réponse au décollement de la rétine et au réattachement chez les primates.Investir. Ophthal. Vis. Sci. 1990;31:1474–1482.
Karwoski CJ, Proenza LM. Relation entre les réponses des cellules de Muller, un potentiel transrétinien local et le flux de potassium. J Neurophysiol. 1977;40:244–259.
Miller RF, Dowling JE. Réponses intracellulaires des cellules de Muller (gliales) de la rétine mudpuppy: leur relation avec l’onde b de l’électrorétinogramme. J Neurophysiol.1970;33:323–341.
Newman EA, Odette LL. Modèle de génération d’ondes b de l’électrorétinogramme: un test de l’hypothèse K +. J Neurophysiol. 1984;51:164–182.
Newman EA. Électrophysiologie des cellules gliales rétiniennes. Prog. Ret. Rés. 1989; 8:153-172.
Reichenbach A, Robinson SR. L’implication des cellules de Müller dans la rétine externe. Dans: Djamgoz MBA, Archer SN, Vallerga S, éditeurs. Neurobiologie et aspects cliniques de la rétine externe. Londres : Chapman &Hall; 1995. p. 395 à 416.
Robinson SR, Hampson ECGM, Munro MN, Vaney DI. Couplage unidirectionnel des jonctions interstitielles entre la neuroglie. Proc. Austr. Neurosci. Soc. 1993;3:167.
Schnitzer J. Astrocytes dans la rétine des mammifères. Prog. Ret. Rés. 1988; 7:209-232.
Pierre J, Makarov F, Hollander H. L’enveloppe gliale du soma et de la butte axonale des cellules ganglionnaires rétiniennes. Vis Neurosci. 12:273–279.
Pierre J, Dreher Z. Relation entre les astrocytes, les cellules ganglionnaires et le système vasculaire de la rétine. J Comp Neurol. 1987;255:35–49.
Trivino A, Ramirez JM, Salazar JJ, Ramirez AI, Garcia-Sanchez J. Étude immunohistochimique de l’astroglie de la tête du nerf optique humain. Vision Rés. 1996; 36: 2015-2028.
Turner DL, Cepko CL. Un progéniteur commun pour les neurones et la glie persiste dans la rétine du rat à la fin du développement. Nature. 1987;328:131–136.