gliacellen van het netvlies door Helga Kolb
Helga Kolb
drie basistypen gliacellen worden gevonden in het menselijke netvlies, Muller cells, astroglia en microglia. Alle werden beschreven voor het netvlies door Cajal meer dan honderd jaar geleden (1892).
1. Muller cells.
Mullercellen zijn de belangrijkste gliacelcel van het netvlies. Zij vormen architecturale steunstructuren die radiaal over de dikte van het netvlies uitstrekken en zijn de grenzen van het netvlies aan het buitenste en binnenste beperkend membraan respectievelijk. Een volledig begrip van de vorm van een Muller cel wordt het best gezien na Golgi kleuring zoals oorspronkelijk getoond door Cajal (1892) hieronder.
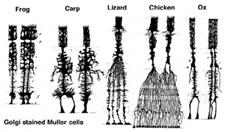
Fig. 1. Golgi gekleurde Muller-cellen
Muller-cellichamen bevinden zich in de binnenste kernlaag en projecteren onregelmatig dikke en dunne processen in beide richtingen naar het buitenste beperkende membraan en naar het binnenste beperkende membraan. Muller-celprocessen insinueren zich tussen cellichamen van de neuronen in de nucleaire lagen en omhullingsgroepen van neurale processen in de plexiforme lagen (Fig. 1). In feite zijn retinale neurale processen alleen toegestaan direct contact, zonder omhullen Muller cel processen, op hun synapsen.
Eén enkele voorlopercel leidt tot zowel Mullercellen als retinale neuronen(Turner en Cepko, 1987), zij het in twee fasen. De vroegste fase neuronen geboren aan de apicale rand van het neuroepitheel grenzend aan het pigment epitheel produceert primaire neuronen bestaande uit kegelcellen, horizontale cellen en ganglion cellen (Fig. 2, rechts). De tweede fase van cellen die ook aan de apicale randen worden geboren, produceert Muller-cellen en staaffotoreceptoren, bipolaire cellen en amacriinecellen (Reichenbach en Robinson, 1995) (Fig. 2, links). Alle zich ontwikkelende neuronen en de Muller-cellen moeten naar binnen migreren naar hun uiteindelijke positie en men denkt dat de Muller-celprocessen en stammen veel van de neuronmigraties begeleiden en de neurietdifferentiaties sturen.
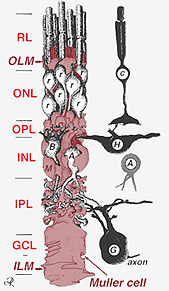
Fig. 2. 3-D schematische tekening van de relatie tussen Muller-cel en andere retinale neuronen
de verbindingen die het buitenste beperkende membraan vormen, zijn tussen Muller-cellen en andere Muller-cellen en fotoreceptorcellen als stevige desmosomen of zonula-adherens. In sommige species gap junctions (gespecialiseerde membraanassociaties en kanalen die de doorgang van kleine moleculen en ionen mogelijk maken) of tight junctions maken deel uit van deze Muller cell junctions (Miller and Dowling, 1970) maar niet zo in zoogdiersoorten waar ooit geen kleurstofkoppeling is waargenomen (Robinson et al., 1993; Reichenbach and Robinson, 1995). Het oppervlak van de Muller-cel tegenover het pigmentepitheel en de subretinale ruimte wordt uitgebreid door vele projecties van het Muller-celmembraan dat als apicale villi wordt bekend. Het binnenste beperkende membraan, daarentegen, wordt gevormd door de kegelvormige eindvoeten van de Muller cel maar er zijn hier geen gespecialiseerde verbindingen te zien. Muller cellen vormen ook endfeet op de grote retinale bloedvaten aan de binnenzijde van het netvlies. Het oppervlak van het membraan van de Muller-cel tegenover het glasvocht is bedekt met een mucopolysaccharide materiaal en vormt zo een echt keldermembraan.
Mullercellen bevatten glycogeen, mitochondriën en intermediaire filamenten die immunoreactief zijn voor vimentine en tot op zekere hoogte voor glialfibrillair zuurproteïne (GFAP). Deze laatste filamenten bevinden zich normaal gesproken in de binnenste helft van de netvliescellen en hun eindvoeten (Fig. 3, links), maar na trauma aan het netvlies zoals netvliesloslating, worden zowel vimentin als GFAP massaal upregulated en gevonden door de cel (Fig. 3, rechts) (Guerin et al., 1990; Fisher and Lewis, 1995).
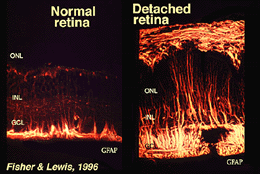
Fig. 3. GFAP immunoreactiviteit in Muller cellen
Muller cellen hebben een reeks functies die alle van vitaal belang zijn voor de gezondheid van de retinale neuronen. Muller cellen functioneren in een symbiotische relatie met de neuronen (voor een uitstekend overzicht zie Reichenbach and Robinson, 1995). Muller celfuncties omvatten dus:
- het leveren van eindproducten van anaeroob metabolisme (afbraak van glycogeen) aan brandstof aërobe metabolisme in de zenuwcellen.
- ze ruimen neurale afvalproducten zoals kooldioxide en ammoniak op en recyclen gebruikte aminozuurtransmitters.
- zij beschermen neuronen tegen blootstelling aan overmatige neurotransmitters zoals glutamaat door gebruik te maken van goed ontwikkelde opnamemechanismen om deze zender te recyclen. Ze worden vooral gekenmerkt door de aanwezigheid van hoge concentraties glutaminesynthase.
- zij kunnen betrokken zijn bij zowel fagocytose van neuronaal puin als afgifte van neuroactieve stoffen zoals GABA, taurine en dopamine.men denkt dat ze retinoïnezuur synthetiseren uit retinol (van retinoïnezuur is bekend dat het belangrijk is voor de ontwikkeling van het oog en het zenuwstelsel) (Edwards, 1994)
- ze controleren de homeostase en beschermen neuronen tegen schadelijke veranderingen in hun Ionische omgeving door extracellulair K+ op te nemen en het te herverdelen.ze dragen bij aan de generatie van de electroretinogram (ERG) b-wave (Miller en Dowling, 1970; Newman en Odette, 1984), de langzame P3-component van de ERG (Karwoski en Proenza, 1977) en de scotopic threshold response (Str) (Frishman en Steinberg, 1989). Zij doen dit door regulatie van K + verdeling over het netvlies glasachtig grens, over het gehele netvlies en lokaal in de binnenste plexiform laag van het netvlies (Fig. 4, uit Reichenbach en Robinson, 1995, aangepast uit Newman, 1989).

Fig. 4. Regulatie van K + door Muller-cellen in Muller-cellen
2. Astrocyten.
astrocyten zijn geen gliacellen van het retinale neuroepitheel, maar komen vanuit de hersenen langs de zich ontwikkelende oogzenuw het zich ontwikkelende netvlies binnen (Stone and Dreher, 1987; Chan-Ling 1994). Ze hebben een karakteristieke morfologie van een afgeplat cellichaam en een vezelige reeks van uitstralende processen. Intermediaire filamenten vullen hun processen en zo vlekken zij dramatisch met antilichamen tegen GFAP (Schnitzer, 1988). Astrocyte cel lichamen en processen zijn bijna volledig beperkt tot de zenuwvezel laag van het netvlies. Hun morfologie verandert van de periferie naar de oogzenuwkop: van een symmetrische stervorm in het perifere netvlies (Fig. 5a en b) (Schitzer, 1988) tot extreem langgerekt in de buurt van de oogzenuw (Fig. 6 en 7).
 Fig. 5a. astrocyten in perifeer netvlies. Schnitzer, 1988 |
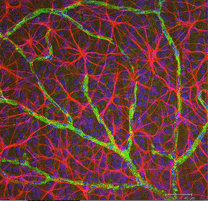 Fig. 5b. Astrocyten (rood) in rat retina onder ganglion cellen (blauw) en geassocieerd met bloedvaten (groen). Met dank aan Laura Fernandez-Sanchez en Nicolas Cuenca |
In immunocytochemische kleuring (Fig. 5b) en bij HRP intracellulaire injecties (Fig. 7) de gekleurde astrocyten vertonen duidelijk processen die langs de axonen van de ganglioncel worden uitgelijnd die door de zenuwvezellaag stromen. In distributie, astrocyten bereiken hun piek op de oogzenuw hoofd en hebben een vrij uniforme daling in dichtheid in uitstralende ringen van de zenuwkop. Ze zijn niet aanwezig in de avasculaire fovea of ora serrata.
 Fig. 6. Astrocyten in het centrale netvlies. Schnitzer, 1988 |
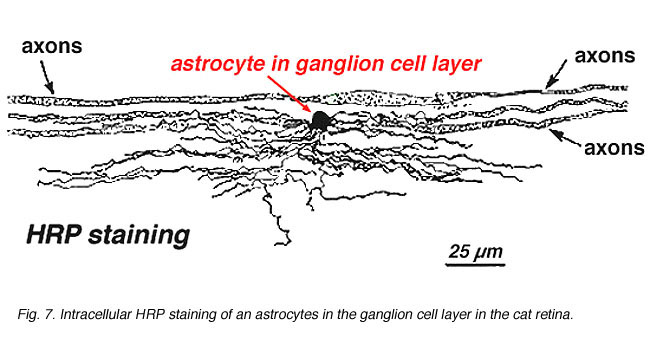 Fig. 7. Astrocyten in kat retina gekleurd door intracellulaire injectie van HRP. Met dank aan Ralph Nelson. |
dikke en dunne astrocyten zijn onderscheiden op basis van kleuring met antilichamen tegen GFAP (Trevino et al., 1996). Zo zijn astrocyten gerangschikt over het oppervlak van de ganglion cel Axon bundels als ze koers in de oogzenuw kop vormen een buis waardoor de axonen lopen (Fig. 8). Gap junctions en zonula adherens junctions zijn beschreven tussen astrocytische processen in cat retina (Höllander et al., 1991).
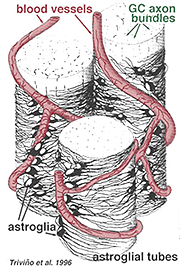
Fig. 8. 3-D – Blok astrocyten gerangschikt over het oppervlak van ganglioncel-Axon-bundels
de bloedvaten die in en tussen de ganglioncelbundels lopen, worden ook door beide processen en zelfs een incidenteel cellichaam van een astrocyt bedekt. De functie van astrocyten die ganglioncelaxonen omhullen en de relatie met bloedvaten van de zenuwvezellaag suggereren dat ze axonale en vasculaire glialscheden zijn en deel uitmaken van een bloed-hersenbarrière. Gelijkaardig aan Muller cellen, zijn zij gekend om overvloedig glycogeen te bevatten en zij kunnen een voedende dienst in het verstrekken van glucose aan de neuronen vormen. Bovendien dienen zij waarschijnlijk een rol in Ionische homeostase in het regelen van extracellulaire kaliumniveaus en metabolisme van neurotransmitters zoals GABA.
3. Microgliale cellen.
het derde gliaceltype is vermoedelijk van mesodermale oorsprong en is dus strikt genomen niet neurogliaal, net als de astrocyten en Muller-cellen. Ze komen het netvlies binnen samen met de mesenchymale voorlopers van de bloedvaten van het netvlies in ontwikkeling (Chan-Ling, 1994). Microgliale cellen zijn alomtegenwoordig in het menselijke netvlies wordt gevonden in elke laag van het netvlies.
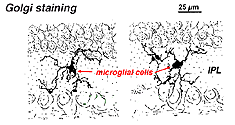
in Golgi-gekleurd netvlies zien ze eruit als vreemde, multipolaire vormen met kleine cellichamen en onregelmatige korte processen. In feite zijn ze in Golgi-preparaten soms verward met zenuwcellen, met name wanneer ze in een kernlaag liggen met één enkele oriëntatie van hun processen in de plexiforme laag.
Fig. 9. Golgi kleuring van microgliale cellen
microgliale cellen kan van twee typen zijn. Een vorm wordt gedacht aan het netvlies in te voeren in de vroege stadia van de ontwikkeling van de oogzenuw mesenchyme en liggen slapend in de retinale lagen voor een groot deel van het leven van het netvlies. De andere vorm van microglia lijken bloed-overgedragen cellen te zijn, mogelijk afkomstig van pericyten (Boycott and Hopkins, 1981; Gallego, 1986). Beide types kunnen in een macrophagic functie na trauma aan het netvlies worden bevorderd, en dan nemen zij in fagocytose van degenererende netvliesneuronen in dienst.

Fig. 10 bis. Lectine-gekleurde microgliale cel uit Chan-Lin, 1994.
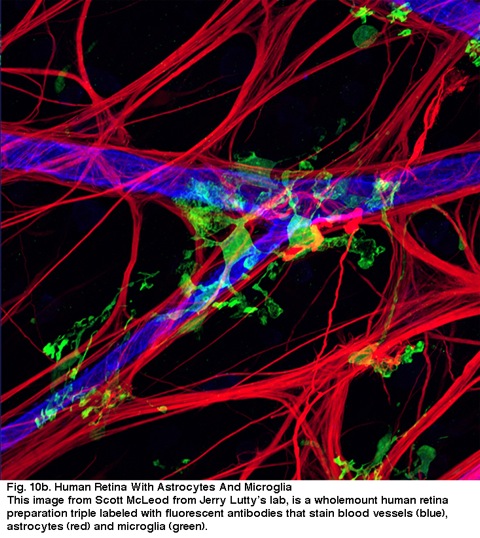
Fig. 10b. menselijk netvlies met astrocyten en Microglia. Dit beeld van Scott McLeod van Jerry Lutty ‘ s lab, is een wholemount menselijke retina voorbereiding triple laneled met fluorescerende antilichamen die vlekken bloedvaten (blauw), astrocyten (rood) en microglia (groen).
4. Verwijzingen.
Boycott BB, Hopkins JM. Microglia in het netvlies van apen en andere zoogdieren; het onderscheid van andere soorten glia en horizontale cellen. Neurowetenschap.1981;6:679–688.
Cajal SR. In: Thorpe SA, Glickstein M, vertalers. 1892. De structuur van het netvlies. Springfield (IL): Thomas; 1972.
Chan-Ling T. gliale, neuronale en vasculaire interacties in het netvlies van zoogdieren. Prog. Ret. Eye Res. 1994; 13: 357-389.
Edwards RB. Biosynthese van retinoïnezuur door Müller gliacellen: een model voor het centrale zenuwstelsel? Prog. Ret. Eye Res. 1994; 13: 231-242.
Fisher SK, Lewis GP. Fotoreceptoren en verder: cellulaire en moleculaire effecten van netvliesloslating.2nd Great Basin Visual Science Symposium, II, University Of Utah Press. 1995
Frishman LJ, Steinberg RH. Door licht opgewekte toename van o in het proximale gedeelte van het voor het donker aangepaste netvlies van de kat. J Neurophysiol. 1989;61:1233–1243.
Gallego A. vergelijkende studies over horizontale cellen en een opmerking over microgliale cellen. Prog. Ret. Res. 1986; 5: 165-206.
Guerin CJ, Anderson DH, Fisher SK. Veranderingen in intermediaire filamentimmunolabeling treden op als reactie op loslating van het netvlies en het opnieuw bevestigen bij primaten.Investeren. Oogheelkunde. Vis. Sci. 1990;31:1474–1482.
Karwoski CJ, Proenza LM. Relatie tussen Muller cel reacties, een lokale transretinale potentieel, en kalium flux. J Neurophysiol. 1977;40:244–259.
Miller RF, Dowling JE. Intracellulaire reacties van de Muller (gliale) cellen van het mudpuppy retina: hun relatie tot b-golf van het electroretinogram. J Neurophysiol.1970;33:323–341.
Newman EA, Odette LL. Model van electroretinogram b-golf generatie: een test van de k + hypothese. J Neurophysiol. 1984;51:164–182.
Newman EA. Elektrofysiologie van retinale gliacellen. Prog. Ret. Res. 1989; 8: 153-172.
Reichenbach A, Robinson SR. De betrokkenheid van Müller cellen in de buitenste retina. In: Djamgoz MBA, Archer SN, Vallerga S, editors. Neurobiologie en klinische aspecten van het buitenste netvlies. Londen: Chapman & Hall; 1995. 395-416.
Robinson SR, Hampson ECGM, Munro MN, VANEY DI. Unidirectionele koppeling van gap juncties tussen neuroglia. Proc. Austr. Neurowetenschappen. Soc. 1993;3:167.
Schnitzer J. astrocyten in zoogdiernetina. Prog. Ret. Res. 1988; 7: 209-232.
Stone J, Makarov F, Hollander H. the glial ensheathment of the soma and axon hillock of retinale ganglion cells. Vis Neurosci. 12:273–279.
Stone J, Dreher Z. relatie tussen astrocyten, ganglioncellen en vasculatuur van het netvlies. J Comp Neurol. 1987;255:35–49.
Trivino a, Ramirez JM, Salazar JJ, Ramirez AI, Garcia-Sanchez J. Immunohistochemical study of human optic nerve head astroglia. Vision Res. 1996; 36: 2015-2028.
Turner DL, Cepko CL. Een gemeenschappelijke voorouder voor neuronen en glia blijft in rat retina laat in ontwikkeling. Natuur. 1987;328:131–136.