grenzen in Cardiovasculaire Geneeskunde
Inleiding
bij het onderzoeken van coördinatensystemen die voor verschillende biologische entiteiten kunnen worden gebruikt, moeten specifieke kenmerken in aanmerking worden genomen. Bijvoorbeeld, vormen het chromosoomaantal en de positie van het basispaar een lineair coördinatenstelsel dat voldoende is om plaats in het referentiegenoom te bepalen (1). Echter, een coördinatenstelsel voor het hele menselijk lichaam, die de behoeften van HuBMAP, HCA, HPA, en andere mapping inspanningen kan dienen, is veel complexer om verschillende redenen (2-5). Ten eerste, cellen leven in drie dimensies; en, is aanvullende informatie nodig om de grootte en rotatieoriëntatie van om het even welke weefselsteekproef te beschrijven die wordt gebruikt om de gegevens te genereren. Ten tweede, terwijl de positie van het genoombasepaar niet afhangt van hoe DNA wordt gevouwen en verpakt in de kern, de posities van individuele elementen (bijv., cellen, organen) in het lichaam zijn dynamisch, omdat ze kunnen veranderen met skeletachtige en spierbewegingen, zwaartekracht, ademhaling, hartslag, en andere functies en krachten die weefsel vervormen. Ten derde, hoewel de variabiliteit van DNA tussen mensen <1% is, omvat de geometrie van het menselijk lichaam een breed scala aan hoogtes, gewichten en vormen, die variëren per geslacht en ras en aanzienlijk veranderen gedurende de levensduur van een persoon.
een optie is om een 3D Cartesiaans coördinatenstelsel te gebruiken om de positie in het lichaam te beschrijven. Cartesiaanse coördinatenstelsels hebben het voordeel vertrouwd en gemakkelijk te begrijpen te zijn. Met het lichaam in standaard anatomische positie, links-rechts, caudale-craniale, en posterior-anterior vorm drie loodrechte (x-y-z) assen. Voor kleinere schaalanalyses kan het centreren van de oorsprong op een anatomisch oriëntatiepunt het nuttigst zijn en mogelijk minder variabel tussen verschillende mensen. Het zou bijvoorbeeld gemakkelijker zijn om de afstand van een weefselmonster van de nier aan de hogere pool van de nier te meten dan aan de bovenkant van het hoofd van een persoon. Het nadeel van cartesiaanse coördinaten is dat de assen niet de natuurlijke vorm van het lichaam volgen. Dientengevolge, zou het creëren van een verwijzingslichaamskaart door digitaal samen weefselspecimens van mensen van verschillende grootte te “stikken” een complex proces vereisen van kromtrekken, roteren, en het uitlijnen van de gegevens. Dit doen op een manier die schalen naar het hele lichaam met behoud van cellulaire-niveau precisie zou zeer uitdagend zijn.
andere 3D-coördinatenstelsels zijn ontwikkeld voor verschillende toepassingen. Bijvoorbeeld, sferische coördinaten, met assen die breedtegraad, lengtegraad en hoogte vertegenwoordigen, gemakkelijk beschrijven locatie op het oppervlak van de aarde. Een eenvoudig pad in sferische coördinaten, zoals “1 km oost”, is veel moeilijker te communiceren met behulp van cartesiaanse coördinaten. Op dezelfde manier zouden coördinatensystemen voor het menselijk lichaam idealiter assen moeten hebben die anatomische structuren, genetische expressiepatronen, chemische gradiënten en/of andere biologisch relevante routes volgen. Er zijn verschillende orgaanspecifieke coördinatensystemen ontwikkeld, zoals Talairach-Coördinaten voor functionele beeldvorming van de hersenen, maar deze strekken zich niet uit tot het hele lichaam (6).
vasculair coördinatensysteem
in 2017 werd een Common Coordinate Framework (CCF) bijeenkomst georganiseerd door de National Institutes of Health, Het Broad Institute, het Sanger Institute en het Chan Zuckerberg Initiative. Deelnemers aan de bijeenkomst, waaronder anatomisten, pathologen, clinici en technologie-experts uit de hele wereld, stelden verschillende benaderingen voor voor het in kaart brengen van de cellen van het menselijk lichaam, waaronder anatomisch gebaseerde coördinatensystemen (7). Een van deze, die de vasculatuur gebruikt, werd verder besproken tijdens een 2019 CCF Workshop, specifiek voor het lokaliseren van niercellen (8). In dit manuscript geven we een conceptueel overzicht van dit vasculaire coördinatenstelsel en beschrijven we de voordelen en beperkingen ervan (figuur 1).
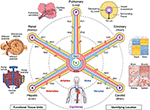
figuur 1. De naaf-en-spaak structuur van een vasculair coördinatenstelsel. Het vasculaire coördinatenstelsel bestaat uit representatieve vaatlussen die beginnen en eindigen in de kamers van het hart en zich uitstrekken tot de functionele eenheden van elk orgaan (tegen de klok in van linksboven: alveoli, glomeruli en hepatische lobules). Het ” adres “van een cel omvat de naam van de lus (bv.” R “voor nier en” H “voor lever) en het vertakkingsniveau van het dichtstbijzijnde vat (bv.” RA1 ” voor afferente arteriolen in de nierlus). Merk op dat de wanden van het hart liggen langs de coronaire (“C”) vasculaire lus, en de cellen van sommige structuren intern in het hart zijn eigenlijk gepositioneerd op de periferie van het coördinatenstelsel, in de buurt van de haarvaten die hen voorzien van bloed. Er zijn meerdere manieren om een nog preciezere “GPS-achtige” positie te lokaliseren, waaronder, met de klok mee van rechtsboven, de ” hypoxie vingerafdruk “die het gevolg is van het verminderen van zuurstofniveaus verder van het vat, de unieke” histologische vingerafdruk “en” genexpressie vingerafdruk “in verschillende soorten vasculaire endotheelcellen, en de kenmerkende” vasculaire architectuur vingerafdruk ” gevonden in verschillende soorten weefsel. De vasculatuur strekt zich uit tot alle delen van het lichaam (bodem) en frames alle organen op alle schalen. bronbestand: Afbeeldingen van hepatische lobules, glomeruli, alveoli, gene expression heat map en whole body vasculature zijn aangepast van Wikimedia Commons: https://commons.wikimedia.org/wiki/File:2423_Microscopic_Anatomy_of_Liver.jpg (Public Domain); https://commons.wikimedia.org/wiki/File:Juxtaglomerular_Apparatus_and_Glomerulus.jpg (CC BY 3.0 license); https://commons.wikimedia.org/wiki/File:Alveolus_diagram.svg (Public Domain); https://commons.wikimedia.org/wiki/File:Iris_dendrogram.png (CC BY-SA 4.0 licentie); en, https://commons.wikimedia.org/wiki/File:Circulatory_System_en.svg (public domain). Gene expressie heat map opnieuw gemaakt van Guo et al. (9) Gebruik van gesimuleerde gegevens. Vasculaire architectuur gebaseerd op Bosetti et al. (10) (CC BY 4.0 licentie).
Het doel van een vasculair coördinatenstelsel is niet om een kaart van de vasculatuur te maken. Eerder, is het idee om bekende vasculaire wegen door het lichaam te gebruiken als een as in een coördinatenstelsel dat de positie van anatomische elementen, zoals cellen, in het weefsel rond de vasculatuur kan beschrijven. In dit voorgestelde kader kunnen de kamers van het hart worden gezien als de oorsprong in de kaart van het hele lichaam. De vasculaire as bevat vasculaire lussen (vergelijkbaar met “wegen” in de Google Map metafoor) die zich uitstrekken door de aorta of longslagader, geleidelijk af te taperen naar de grootte van een enkele cel als ze naderen elke andere cel in elk orgaan in het lichaam, en terug te keren naar het hart. Langs deze wegen, volgt de vasculature de unieke biologie van de diverse organen en weefsels; en, eveneens, konden de organen en weefsels van het lichaam niet zonder de unieke eigenschappen van hun nauw geïntegreerde vasculature bestaan.
net zoals de genoomkaart het DNA ontvouwt in een lineaire sequentie, kunnen we ons voorstellen dat de complexe 3D-wendingen van de vasculatuuras zich ontvouwen in een eenvoudiger 2D “hub-and-spoke” vorm met de kamers van het hart in het centrum. Deze schematische weergave van de vasculatuur maakt het gemakkelijker om (1) de locatie in het lichaam te beschrijven; (2) vasculaire routes uit te lijnen met verschillende 3D-vormen maar gelijkwaardige functie van verschillende mensen; (3)patronen te identificeren zoals veranderingen in celtype en genexpressie als één overgangen van Grotere naar kleinere vaten binnen een orgaan (langs een spaak); en, (4) vergelijk weefsel op hetzelfde niveau (bijvoorbeeld, haarvaten) in verschillende organen (over spaken).
een orgaan, zoals de nier, heeft tienduizenden vasculature pathways als elk capillair duidelijk wordt beschouwd. Om de bouw van een CCF haalbaar te maken, zullen we echter een extra vereenvoudigde aanname maken dat veel van deze trajecten niet van elkaar te onderscheiden zijn. Met name de kleinste vaten (haarvaten) staan in het centrum van de kleine gespecialiseerde functionele eenheden in elk orgaan (bijv., leverkubuli in de lever, glomeruli in de nier, en alveoli in de long). Een heel orgaan vereist veel van deze vasculaire gecentreerde functionele eenheden die anatomisch en fysiologisch vergelijkbaar zijn (11). Deze gelijkenis kan worden gebruikt om tal van vasculaire wegen in te storten in een paar representatieve (Figuur 2). In de toekomst, als we meer leren over de biomoleculaire profielen van deze routes, kunnen we de CCF verfijnen door de routes te splitsen in subtypes die worden ontdekt.

Figuur 2. Het ontvouwen van de renale vasculaire route naar het eencellige niveau. Een representatieve vasculaire route komt de nier binnen via de nierslagader, gaat door de glomerulus en keert terug uit de nierader. Op de macroschaal (links) en mesoscale (Midden), labels in gele dozen zijn anatomische structuren die overeenkomen met verschillende vaten langs deze lus. Op de microschaal (rechts), labels in gele dozen zijn verschillende soorten cellen die binnen een korte afstand van een nabijgelegen vat in de glomerulus. De positie van de afzonderlijke cellen kan worden beschreven aan de hand van het adres van het dichtstbijzijnde vat (bijv., “RA0” voor glomerulus capillaire), de afstand in micrometer of aantal cellen van het endotheel van het vat en een hoek loodrecht op de lengte van het vat (bv. “RA0-10 µm-135°” of “RA0-1C-135°”). Aan de rechterkant is elk vat en zijn omringende weefsel uit het originele beeld gehaald en verticaal uitgelijnd om het gemakkelijk te maken om te zien hoe celtypes en distributie langs de vasculaire weg veranderen. In dit voorbeeld zijn de uitgelijnde afbeeldingen ook gedraaid zodat het midden van de glomerulus altijd rechts staat. bronbestand: Afbeeldingen van de nier en glomerulus zijn aangepast van Wikimedia Commons: https://commons.wikimedia.org/wiki/File:KidneyStructures_PioM.svg (CC BY 3.0 licentie); en, https://commons.wikimedia.org/wiki/File:Renal_corpuscle-en.svg (CC BY-SA 4.0 licentie).
een “adres” van een individuele cel in een vasculair coördinatenstelsel bestaat uit vier componenten. (1) de eerste is het dichtstbijzijnde anatomisch benoemde vat dat het meest precies identificeert een vasculaire lus (het vasculaire grondgebied of “waterscheiding”), zoals de rechter nierslagader. (2) de volgende component vertegenwoordigt het vertakkingsniveau van het vat. In de nier, omvatten de voorbeelden van proximal aan distal de interlobar slagaders, corticale stralen slagaders, afferente arteriolen, en glomerular capillairen. Het vertakkingsniveau kan ook numeriek worden gedefinieerd, met haarvaten op het nulniveau en hogere niveaus met grotere aantallen. (3) de derde component is de loodrechte afstand in micrometers of aantal cellen van de endotheellaag van het vat. (4) Een optioneel vierde onderdeel zou de draaihoek loodrecht op de lengte van het vat kunnen zijn. Nul graden kunnen op vele manieren worden gedefinieerd, afhankelijk van de toepassing. Bijvoorbeeld, kan het ten opzichte van een teller op het weefselspecimen zijn, of het kan naar een anatomische structuur, zoals het centrum van de dichtstbijzijnde glomerulus in de nier wijzen. Het nut en de behoefte van deze componenten zouden door experimentele tests moeten worden bevestigd.
een andere benadering is het gebruik van endotheelcellen als “verankerende cellen” om de relatieve posities van de andere cellen op een GPS-achtige manier te identificeren. Endotheel loopt over de hele vasculatuur. Verschillende endotheliale cel (EC) types verschijnen in verschillende delen van de vasculatuur, die histologisch kunnen worden gedetecteerd door unieke celkarakteristieken en naburige cellen (de “histologische vingerafdruk”), evenals door analyse van hun specifieke genprofielen (de “genexpressie vingerafdruk,” figuur 1 warmtekaart) (9, 12, 13). Vasculair organisatiepatroon, vertakkende complexiteit, diameter, enz. zorg voor extra herkenbare kenmerken die een “vasculaire architectuur vingerafdruk” vormen voor elk weefsel (figuur 1 false-color fluorescente vasculatuur beelden) (10, 14). Elk weefsel heeft specifieke zuurstofgradiënten, die kunnen worden gebruikt om de afstand van het vat te bepalen. Wanneer PO2 niet direct kan worden gemeten, kan men de celafstand afleiden van de inductie/expressiegradiënten van hypoxie-induceerbare genen in verschillende soorten cellen (de “hypoxie-vingerafdruk”, figuur 1 transversale weergave van een vat) (15-17).
voordelen van een vasculair CCF
een vasculair coördinatenstelsel is biologisch zinvol. Elke levende cel moet zich binnen een kleine straal van het dichtstbijzijnde bloedvat bevinden (100 µm tot 1 mm, afhankelijk van het weefsel) om zuurstof te ontvangen (18); en elk vat is bekleed met dezelfde continue laag endotheel (19). Aldus, vormt de vasculatuur een ononderbroken weg die alle delen van het lichaam bereikt, naadloos het afbouwen neer over schalen, van macroschaal (geheel lichaam / klinisch) aan mesoscale aan microschaal (ééncellige capillaire vaten). Als deel van dit, behandelt het de geleidelijke overgang van grote slagaders en aders, die in de meeste mensen, tot de miljoenen microscopische schepen worden behouden die door categorie (b.v., glomerulus capillaire) maar niet door individuele namen herkenbaar zijn. Het vasculaire systeem past zich aan de individuele lichaamsgrootte en-vorm aan, waarbij rekening wordt gehouden met interindividuele variaties (20, 21). Het definieert de vorm van functionele eenheden in verschillende organen, zoals leverknobbels, nier glomeruli, en longblaasjes. De normale ontwikkeling van nieuw weefsel begint met de vorming van vaten voordat er extra celtypen omheen kunnen groeien (22).
het vasculaire systeem bereikt ook alle organen, weefsels en cellen op een aaneengesloten manier. Andere anatomische structuren lijken niet dezelfde veelzijdigheid te hebben. Het skelet strekt zich bijvoorbeeld uit tot het hele lichaam; echter, de afstand van een cel in een orgaan tot het dichtstbijzijnde bot kan enkele centimeters, en dat bot is waarschijnlijk geen deel van het orgaan, en nog minder waarschijnlijk deel van een weefselmonster. Het zenuwstelsel volgt veel van dezelfde routes als grotere vaten belegd met contractiele eigenschappen, maar het is niet bekend of ze zich uitstrekken tot de kleinere vaten die alle weefselcellen bereiken volgen. Dus, in tegenstelling tot cellen ‘ afhankelijkheid van zuurstof, is er geen garantie dat elke cel in de nabijheid van een zenuw. Orgaan-specifieke referentiesystemen zijn gebaseerd op unieke structurele kenmerken die alleen bestaan in dat individuele orgaan (bijvoorbeeld, specifieke gebieden van de hersenen) en zijn waarschijnlijk niet nuttig voor het vertegenwoordigen van cellocaties elders in het lichaam.
Er zijn vele praktische voordelen van een vasculair coördinatenstelsel. Vasculaire wegen in alle organen zijn uitgebreid bestudeerd en worden in de literatuur in detail beschreven. Ze zijn nuttig, bekend, en hebben gestandaardiseerde namen in vele specialty domeinen. Weefselvascularisatie patronen worden klinisch gebruikt om ziekte te diagnosticeren; en, schepen worden gebruikt in chirurgie en biopten als de belangrijkste anatomische oriëntatiepunten en om “vasculaire gebieden” te definiëren (23, 24). Hoewel de exacte positie in 3D Cartesiaanse ruimte moeilijk te bepalen voor een resected Weefsel specimen kan zijn, zal de chirurg meestal in staat zijn om aan te geven welke vasculaire waterscheiding het specimen omvatte.
beperkingen van een vasculair CCF
alleen het kennen van de basenparen in een genoomsequentie levert onvoldoende informatie op om te bepalen hoe het DNA in een bepaalde cel wordt gevouwen. Op dezelfde manier, hoewel het uitgevouwen vasculaire coördinatenstelsel de 3D ruimtelijke relatie van nabijgelegen cellen op microschaal kan beschrijven, gaan de kronkelende paden die Schepen nemen en de relatieve afstand tussen cellen op grotere schalen verloren. Informatie over Grotere schaalstructuren kan worden verkregen door klinische beeldvorming en histologische en moleculaire patronen te integreren.
enige aanvullende positionele informatie gaat verloren door instortende vasculaire routes. Bijvoorbeeld, kan een vasculair coördinatenstelsel aanvankelijk alle glomerulus capillairen in de nier behandelen als dezelfde structuur, potentieel maskerend verschillen in glomeruli bij de superieure en inferieure nierpolen. Hoewel, als we meer over de biomoleculaire profielen van deze wegen leren, kunnen we iteratief verfijnen de vasculaire CCF in de tijd door het splitsen van wegen in om het even welke subtypes die worden ontdekt.
ondanks deze beperkingen behoudt een vasculair coördinatenstelsel voldoende positionele informatie om vele soorten onderzoeksvragen te beantwoorden, door onderzoekers in staat te stellen individuele cellen binnen functionele eenheden, weefsels en organen nauwkeurig te lokaliseren, of de effecten van context op verschillende celtypes in het hele lichaam op de macro – en meso – schalen te vergelijken.
volgende stappen en toekomstige richtingen
in Figuur 1 geven we een sterk vereenvoudigde en gestileerde weergave van het vasculaire CCF om het algemene concept te introduceren. De eigenlijke vasculaire wegen zijn veel complexer, met de volledige vasculaire CCF uiteindelijk bestaande uit honderden of duizenden structuren evenals vertakkende patronen die niet een strikte hub-and-spoke lay-out volgen. Bijvoorbeeld, de aderen in het leverportaalsysteem, die bloed van meerdere organen naar de lever voeren, en de bloedsomloop anastomosen, zoals de cirkel van Willis in de hersenen, zouden loodrecht op en over de “spaken” in Figuur 1 lopen.
de vasculaire CCF zal ook normale anatomische varianten van de vasculatuur moeten opnemen, zoals de thyroidea ima en dubbele cystische arteriën, op dezelfde manier als enkelvoudige nucleotide polymorfismen (SNP ‘ s) normale variaties in het genoom beschrijven. Als we de details van de vasculaire CCF uitbreiden en invullen, kan het een meer sneeuwvlok of web-achtige verschijning aannemen, met kansen toegewezen aan verschillende secties om de kans aan te geven om ze in een bepaalde persoon te vinden.
het eigenlijke vasculaire CCF zal een geavanceerder coderingsschema voor de naamgeving van vaten vereisen dan in Figuur 1 wordt getoond, om de complexiteit ervan nauwkeuriger weer te geven en het “berekenbaar” te maken met softwarealgoritmen. Een aanpak is om voort te bouwen op bestaande anatomische ontologieën, zoals UBERON, dat al unieke uniforme Resource Identifiers (URI ‘ s) bevat voor veel schepen en verschillende relatietypen definieert, zoals “branching_part_of,” om te beschrijven hoe schepen verbinden (25).
een cel kan in de buurt van meer dan één vat zijn, in welk geval het mogelijk is om aan elk vat een apart adres toe te wijzen. Toekomstig onderzoek is nodig om te bepalen wat de juiste “cutoff” – afstand moet zijn. Het kan wenselijk zijn om meerdere adressen voor cellen op te slaan om hun positie in 3D-ruimte te trianguleren.
hoewel onze eerste motivatie voor een vasculair CCF is om een coördinatenstelsel te definiëren voor het specificeren van de locatie van cellen, kan de nieuwe radiale lay-out van het menselijk lichaam rond de vasculaire, zoals afgebeeld in Figuur 1, Andere wetenschappelijke toepassingen hebben. Bijvoorbeeld, heeft de positionele informatie binnen dit kader analogieën aan embryologische ontwikkeling en zou inzicht in mechanismen kunnen verstrekken die ziekte of dysregulations veroorzaken die uit een groep cellen voortvloeien. Bijvoorbeeld, in de vasculaire CCF, macrovasculaire ziekten geassocieerd met type 2 diabetes (b. v., ischemische hartziekte, perifere vasculaire ziekte, en cerebrovasculaire ziekte) zijn geclusterd in de buurt van het centrum, terwijl de microvasculaire ziekten (b.v., retinopathie, nefropathie, en neuropathie) vormen een ring rond de buitenkant (26).
samenvatting
het vasculaire systeem heeft verschillende eigenschappen die reageren op de kenmerken die eerder wenselijk werden geacht voor een CCF om het in kaart brengen van alle cellen in het menselijk lichaam mogelijk te maken (7). (1) Het werkt op verschillende schalen. Door een continu endotheel maakt het een naadloze overgang van grote anatomische structuren naar het cellulaire niveau. (2) Het is van toepassing op alle lichaamsweefsels. Omdat organen zich rond bloedvaten ontwikkelen, kadert de vasculatuur de orgelarchitectuur op alle schalen. Vasculaire patronen zijn zo kenmerkend dat beelden van bloedvaten alleen, met alle andere cellen verwijderd, gemakkelijk kunnen worden gebruikt om het orgaan te identificeren. (3) Het houdt rekening met donorverschillen. Vascularisatie past zich natuurlijk aan individuele variaties in weefsel, lichaamsgrootte en vorm aan. In plaats van de 3D-coördinaten van elke glomerulus in een persoon in kaart te brengen met die in een andere persoon, zou de vasculaire CCF elke cel in een representatieve glomerulus capillair van elke persoon plaatsen. (4) de vasculatuur is bekend bij beoefenaars van vele verschillende klinische specialiteiten, die zowel ziekte diagnosticeren als operaties begeleiden, en wordt gebruikt als oriëntatiepunten door pathologen, radiologen en andere clinici. Dit zou het plaatsen van weefselsteekproeven in het lichaam en het registreren van de plaats van individuele cellen vergemakkelijken. Hoewel geen enkele CCF ideaal is voor alle use cases, definieert een vasculair CCF een natuurlijk coördinatenstelsel dat het gemakkelijk maakt om biomoleculaire gegevens van meerdere mensen te combineren en biologisch relevante onderzoeksvragen te stellen.
data Availability Statement
publiek beschikbare datasets werden geanalyseerd in deze studie. Deze gegevens zijn hier te vinden: https://www.proteinatlas.org.
Auteursbijdragen
GW ontwierp deze studie op basis van rapporten van de CCF-vergadering van 2017 en de CCF-Workshop van 2019. KB en YJ gaven kritische feedback. GW schreef de eerste versie, met extra tekst die is getranscribeerd uit de ccfws-01 diapresentatie. Alle auteurs hebben bijgedragen aan het bewerken van het manuscript.
financiering
Dit onderzoek werd ondersteund door de National Institutes of Health (NIH) award OT2OD026671. Dit werk vertegenwoordigt niet de mening van het NIH of het National Heart, Lung, and Blood Institute (NHLBI).
belangenconflict
De auteurs verklaren dat het onderzoek werd uitgevoerd zonder enige commerciële of financiële relatie die als een potentieel belangenconflict kon worden opgevat.
Dankbetuigingen
wij danken Dr. Zorina S. Galis van de National Institutes of Health voor het helpen ontwikkelen van het idee van een vasculair-gebaseerd coördinatensysteem tijdens de 2017 CCF Meeting en 2019 CCF Workshop, het leveren van presentaties van deze evenementen, en het deelnemen aan tal van discussies die de basis vormden van dit manuscript. De opmerkingen van deskundigen van de beoordelaars hielpen het voorgestelde gemeenschappelijke coördinatensysteem op vasculaire basis te verduidelijken en in detail te brengen.
3. Uhlén M, Björling E, Agaton C, Szigyarto CA, Amini B, Andersen E, et al. Een menselijke eiwitatlas voor normale en kankerweefsels die op antilichaamproteomics worden gebaseerd. Mol Cell Proteomics. (2005) 4:1920–32. doi: 10.1074 / mcp.M500279-MCP200
PubMed Abstract / CrossRef Full Text / Google Scholar
12. Vanlandewijck M, He L, Mäe MA, Andrae J, Ando K, Del Gaudio F, et al. Een moleculaire atlas van celtypes en zonatie in de hersenvasculatuur. Natuur. (2018) 554:475–80. doi: 10.1038/nature25739
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Johnson C, Sung HJ, Lessner SM, Fini ME, Galis ZS. Matrix metalloproteinase-9 is required for adequate angiogenic revascularization of ischemic tissues: potential role in capillary branching. Circ Res. (2004) 94:262–8. doi: 10.1161/01.RES.0000111527.42357.62
PubMed Abstract | CrossRef Full Text | Google Scholar
15. De Santis V, zanger M. Tissue oxygen tension monitoring of organ perfusion: rationale, methodologies, and literature review. Br J Anaesth. (2015) 115:357–65. doi: 10.1093/bja/aev162
PubMed Abstract | CrossRef Full Text/Google Scholar
17. Koch CJ. Meting van het absolute zuurstofgehalte in cellen en weefsels met behulp van zuurstofsensoren en 2-nitroimidazol EF5. Methoden Enzymol. (2002) 352:3–31. doi: 10.1016/S0076-6879(02)52003-6
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Paruchuri V, Salhab KF, Kuzmik G, Gubernikoff G, Fang H, Rizzo JA, et al. Aortic size distribution in the general population: explaining the size paradox in aortic dissection. Cardiology. (2015) 131:265–72. doi: 10.1159/000381281
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Abadi E, Segars WP, Sturgeon GM, Roos je, Ravin CE, Samei E. Het modelleren van longarchitectuur in de xcat-serie van phantoms: physiologically based airways, slagaders and aders. IEEE Trans Med Imaging. (2018) 37:693–702. doi: 10.1109 / TMI.2017.2769640
PubMed Abstract / CrossRef Full Text / Google Scholar
24. Majno P, Mentha G, Toso C, Morel P, PEITGEN HO, Fasel JH. Anatomie van de lever: een overzicht met drie niveaus van complexiteit–een verdere stap naar op maat gemaakte territoriale leverresecties. J Hepatol. (2014) 60:654–62. doi: 10.1016/j.jhep.2013.10.026
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Cade WT. Diabetes-related microvascular and macrovascular diseases in the physical therapy setting. Phys Ther. (2008) 88:1322–35. doi: 10.2522/ptj.20080008
PubMed Abstract | CrossRef Full Text | Google Scholar