het universele oplosmiddel
het universele oplosmiddel
Dit is natuurlijk een andere belangrijke eigenschap van water, omdat meer stoffen in water oplossen dan elke andere veel voorkomende vloeistof. Dit komt omdat het polaire watermolecuul ” oplossend vermogen verhoogt.”Oplossen” betekent het breken van “zouten” in componenten ” ionen.”Bijvoorbeeld, NaCl (common salt) breekt in de ionen Na+ en Cl – vanwege de aantrekkingskracht voor ionen (atomen of groepen van atomen met een lading) om watermoleculen is hoog.
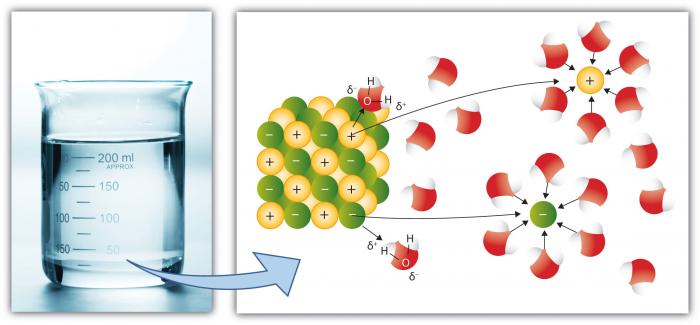
kationen, zoals na (natrium) hebben een netto positieve lading, terwijl anionen (zoals Cl, Chloride) een netto negatieve lading hebben. Er zijn vele individuele elementen en samenstellingen die ionen vormen. Zo kan water aanzienlijke concentraties van verschillende chemische soorten vasthouden, afhankelijk van hun specifieke eigenschappen. Merk op hoe de watermoleculen de individuele ionen omringen, ze geïsoleerd houden van andere ionen in oplossing. Dit gebeurt totdat de capaciteit van water om de ionen te isoleren wordt overschreden, op welk punt de oplossing is “verzadigd” met die ionen en kan niet meer oplossen (zout zal beginnen te neerslaan—vorm een vaste stof).