Nyugtalan láb szindróma: gyakori, alul diagnosztizált rendellenesség
US Pharm. 2009;34(1):24-29.
nyugtalan láb szindróma (RLS) a központi idegrendszer közös szenzomotoros rendellenessége. Ellenállhatatlan késztetés vagy a végtagok mozgatásának szükségessége jellemzi, amely a kényelmetlen végtagérzetek eredményeként jelentkezik. Bár az RLS általában a lábakban kezdődik, átterjedhet a test más részeire, például a karokra vagy a törzsre. Az RLS-ben szenvedők gyakran úgy írják le a rendellenességet, mint a lábak belsejében folyó víz, a “csontok hibái” vagy a lábak elektromossága. Ezek a tünetek egész nap jelen lehetnek, de általában az inaktivitás időszakában és este súlyosbodnak. Az RLS-ben szenvedő embereknek általában a végtagjaikat kell mozgatniuk a kellemetlen érzések teljes vagy részleges enyhítése érdekében. Éjszaka az RLS gyakran társul időszakos végtagmozgásokkal (PLMs), amelyek alvási problémákat okozhatnak, és megnehezíthetik az ülő tevékenységek elvégzését, például hosszabb ideig kényelmesen ülve egy autóban vagy egy repülőgépen.
az RLS oka továbbra sem tisztázott, de a kutatások arra utalnak, hogy az agyban a vashiány miatt károsodott dopaminaktivitás RLS-t indukálhat genetikai hajlamú embereknél. Az RLS elsődlegesnek vagy másodlagosnak minősíthető egy másik egészségi állapot, például végstádiumú vesebetegség (ESRD) vagy terhesség miatt. A dopamin agonisták, mint a ropirinol és a pramipexol, az RLS első vonalbeli terápiája, napi tünetekkel. Alternatív terápiák állnak rendelkezésre refrakter esetek vagy tartós tünetek esetén. Ez a cikk az RLS prevalenciáját, etiológiáját és diagnózisát, valamint a rendelkezésre álló kezeléseket vizsgálja.
prevalencia
epidemiológiai vizsgálatok szerint Európában és Észak-Amerikában az általános népesség 7,2-11% – a szenved valamilyen RLS-ben.1,2 csak az Egyesült Államokban az RLS több mint 10 millió felnőttet és becslések szerint 1,5 millió gyermeket és serdülőt érint, hasonló arányban a fiúk és a lányok között.1,3 a nők körülbelül kétszer olyan fogékonyak az RLS – re, mint a férfiak (9% vs.5,4%).Az 1,2 RLS gyakoribb az idősebb felnőtteknél, de 79 éves kor után előfordulási gyakorisága csökken.1 klinikailag jelentős RLS-esetek a lakosság 2,7-3% – ánál fordulnak elő.1,2 magas prevalenciája ellenére ez a szindróma továbbra is aluldiagnosztizált és sok beteg számára aggasztó.
etiológia
az RLS etiológiája nem teljesen ismert. Tanulmányok kimutatták, hogy ez nem strukturális neurodegeneratív probléma, hanem inkább a dopamin rendszert, a vas homeo stasist vagy a genetikát érinti. A következő vita összefoglalja a három lehetséges ok mindegyikével kapcsolatos jelenlegi gondolatokat.
dopamin rendszer: az RLS-ben szenvedő emberek dopaminrendszerének abnormális kimutatására tett kísérletek nem hoztak végleges eredményeket. A neuroimaging vizsgálatok eredményei dopamin diszfunkcióra utalnak, nem pedig elégtelenségre.4 a dopamin RLS-ben való részvételét a dopamin agonistákra adott klinikai válasz támasztja alá az elsődleges RLS kezelésében.5,6 a dopamin-agonisták pontos hatásmechanizmusa az RLS tüneteinek enyhítésében nem ismert.
vas homeosztázis: egy boncolási vizsgálat kimutatta, hogy csökkent a vasraktárak az RLS-ben szenvedő betegek substantia nigra-ban.7 így az RLS egyik lehetséges oka az lehet, hogy az agy képtelen fenntartani a normális vasszintet. A vas szintén kofaktor a dopamin termelésében. Egy másik tanulmány kimutatta a lehetséges kapcsolatot a károsodott vas homeosztázis és a dopamin diszfunkció között.8 további vizsgálatokra van szükség a vas RLS-ben betöltött szerepének meghatározásához.
genetika: a klinikai tapasztalatok erős családi kapcsolatot mutattak az RLS-ben. A mai napig számos lókuszról számoltak be, de a betegséget okozó gént még nem azonosították.9,10 általánosan elfogadott, hogy az RLS autoszomális-domináns öröklési módot követ, amely csak egy érintett szülőt igényel, hogy átadja a tulajdonságot az utódoknak. További genetikai vizsgálatokra van szükség az RLS-ben szenvedők genotípusának megvilágításához.
diagnózis
az RLS diagnózisa teljes egészében a beteggel és a tünetek előzményeivel készített interjúkon alapul. A diagnosztikai kritériumokat 1995-ben állapította meg az International Restless Legs Syndrome Study Group (Irlssg), és 2003-ban felülvizsgálták.11, 12 ezek alapvető, támogató és kapcsolódó kritériumokra oszlanak (1. táblázat). Mind a négy alapvető kritériumnak jelen kell lennie az RLS diagnózisának megállapításához. A támogató klinikai jellemzők segítik a bonyolultabb esetek diagnosztizálását. A kapcsolódó jellemzők az RLS esetek többségében jelen vannak, és tovább irányíthatják a klinikusokat a diagnózisban.

elsődleges RLS
az elsődleges RLS-t alattomosabb tünetként azonosították, mint a másodlagos RLS-t. Ez gyakoribb a 40 évesnél fiatalabb embereknél. Ezeknek a betegeknek nagyobb valószínűséggel vannak más családtagjaik is a rendellenességgel. Az elsődleges RLS-ben szenvedő betegek kezelésének kritikus lépése a tüneteik gyakoriságának és súlyosságának megállapítása. Az egyik kezelési algoritmus az elsődleges RLS-t három kategóriába sorolja a tünetek súlyossága szerint13:
az időszakos RLS a tünetek alkalmi kezelését igényli, de nem elég súlyos ahhoz, hogy napi gyógyszeres terápiát igényeljen. Az időszakos RLS-ben szenvedő embereknek enyhébb tünetei vannak, és könnyebben kezelhetők. A nem gyógyszeres kezelés általában az előnyben részesített első vonalbeli megközelítés.
a napi RLS-t tartós tünetek jellemzik, amelyeket napi gyógyszeres terápiával kell kezelni. A gyógyszeres kezelés a választott kezelés.
a refrakter RLS olyan napi RLS, amely nem reagál a kezelésre legalább egy első vonalbeli gyógyszer a szokásos adagban. A következő kritériumok közül legalább egynek teljesülnie kell: képtelenség elérni a megfelelő gyógyszeres választ; nem kielégítő válasz az idő múlásával az előnyben részesített szer dózisának emelése ellenére; elviselhetetlen mellékhatások; és a tünetek súlyosbodása a további gyógyszeradagok ellenére.
másodlagos RLS
a másodlagos RLS hirtelen kialakulással jár, és jellemzően egy másik állapot, például vashiány, ESRD vagy terhesség következtében jelentkezik. A másodlagos RLS tünetei nem különböztethetők meg az elsődleges RLS tüneteitől, de a kezelés az alapállapotot célozza meg.
primer RLS kezelése
nem farmakológiai terápia
enyhe RLS esetén először a nem farmakológiai megközelítéseket kell kipróbálni. Minden más esetben a gyógyszeres terápia mellett a nem gyógyszeres terápia is alkalmazható a szenzomotoros tünetek és az alvászavarok enyhítésére. A nem gyógyszeres kezelés magában foglalja a jó alvási szokások kialakítását, mint például a rendszeres alvási ütemterv; csendes, sötét környezet biztosítása a hálószobában; és az RLS kiváltó tényezők (televízió, koffein, nikotin, alkohol) elkerülése lefekvés előtt.13 enyhe-középsúlyos mentális tevékenységek (videojátékok, rejtvények) és fizikai tevékenységek (házimunka, testmozgás) ajánlottak olyan időszakokban, amikor a betegek a leginkább hajlamosak a tünetek megjelenésére, például este, inaktivitás vagy pihenés időszakában. Mozgásszegény tevékenységek, például repülőgépes repülések, hosszú autós túrák és filmek ajánlottak reggelre, amikor az RLS tünetei általában enyhülnek.
farmakológiai terápia
az RLS farmakológiai kezelése tüneti. Nem gyógyítja meg a rendellenességet, de kezeli a zavaró megnyilvánulásait. Az RLS kezelésére alkalmazott farmakológiai szerek a levodopa (l-dopa), dopamin agonisták, gabapentin, opioidok és benzodiazepinek.
l-Dopa: az l-Dopa egy dopamin prekurzor. A dekarboxiláz inhibitor karbidopával (Sinemet) együtt állítják elő, amely megakadályozza az L-dopa perifériás plazma lebontását. A karbidopa 75%-kal csökkenti a szükséges l-dopa mennyiségét. Amint az l-dopa átjut a vér-agy gáton, dopaminná alakul. Parkinson-kór esetén a karbidopa / l-dopa terápiát általában napi háromszor 25 mg/100 mg-mal kezdik; intermittáló RLS esetén az l-dopa és karbidopa kombinációját alacsonyabb dózisokban alkalmazták szükség szerint, azonnali hatása és a titrálás szükségességének hiánya miatt.13 hosszabb felezési idejű L-dopa nyújtott hatóanyag-leadású készítményt vizsgáltak alternatív alkalmazásra olyan betegeknél, akiket éjszaka gyakran ébresztenek a tünetek az azonnali felszabadulású forma rövid hatása miatt.14 Az Egyesült Államok piacán jelenleg nincs egyetlen egységből álló l-dopa termék.
RLS-ben szenvedő betegeknél az l-dopa tipikus dopaminerg mellékhatásokat okoz, mint például hányinger, hányás, aluszékonyság, szédülés, hypotonia és fejfájás. A leginkább káros mellékhatás, az augmentáció megakadályozza annak alkalmazását a napi RLS-ben.15 az augmentáció magában foglalja az RLS tüneteinek rosszabbodását a nap elején egy esti gyógyszeradag után, a tünetek súlyosságának növekedését, valamint a tünetek terjedését a test más részeire, például a karokra vagy a törzsre.13
dopamin agonisták: a dopamin agonisták a napi RLS első vonalbeli terápiája.13 a nonergot agonisták, mint a ropinirol és a pramipexol előnyösebbek az ergot agonistákkal szemben, mint a pergolid és a kabergolin, kedvezőbb mellékhatásprofiljuk miatt. A pergolid és a kabergolin, amelyekről kimutatták, hogy növelik a szívbillentyű-regurgitáció kockázatát, jelenleg nem állnak rendelkezésre az Egyesült Államokban e káros káros hatás miatt.16
a ropinirol (Requip) volt az első gyógyszer, amelyet az FDA jóváhagyott (2005-ben) közepesen súlyos vagy súlyos primer RLS kezelésére. Ez egy teljes intrinsic nonergolin agonista a dopamin D2 és D3 receptor altípusok számára. Három nagy klinikai vizsgálat igazolta a ropinirol hatékonyságát és tolerálhatóságát az RLS kezelésében.5,17,18 mindhárom vizsgálatban a betegeket ropinirolra vagy placebóra randomizálták a tolerálhatóságnak megfelelő 0,25-4 mg/nap rugalmas titrálási séma szerint, naponta egyszer, egy-három órával lefekvés előtt. Az eredményeket az International RLS Rating Scale (irls)-az elsődleges eredménymérő-és a Clinical Global Impressions-Improvement (CGI-I) skála segítségével értékelték. Az IRLS 10 részből áll, amelyek értékelik az érzékszervi és motoros tünetek súlyosságát, az alvászavarokat, a mindennapi tevékenységekre gyakorolt hatást és az RLS-hez kapcsolódó hangulatot. Az IRLS alapján mindhárom vizsgálat megállapította, hogy a ropinirol hatékonyan csökkentette az RLS alapvető tüneteit-például a tünetek súlyosságát és gyakoriságát, valamint az alvási problémákat -, és hatékonyan növelte az általános jólétet. A leggyakrabban jelentett mellékhatások a dopamin agonistákra jellemző hányinger és fejfájás voltak. Ezekben a vizsgálatokban az augmentációt hivatalosan nem értékelték,és a betegség augmentációjáról nem számoltak be.
a pramipexol (Mirapex), amelyet az FDA 2006-ban jóváhagyott a közepesen súlyos napi RLS kezelésére, egy másik teljes nonergolin D2 és D3 receptor agonista. A pramipexol hatásosságát több klinikai vizsgálatban értékelték.6,19,20 minden beteg szükség szerint pramipexolt (0,125 mg-0,75 mg) kapott, és tolerálta, vagy placebót kapott naponta egyszer, két-három órával lefekvés előtt. Az összes vizsgálatban a hatásosság értékeléséhez használt két végponti mutató az IRLS és a CGI-I volt. Javulást tapasztaltak mind az RLS szubjektív, mind objektív méréseiben. Gyakran jelentett mellékhatások a hányinger, fejfájás és fáradtság voltak. Az augmentációt hivatalosan nem értékelték, bár a pramipexollal végzett augmentációról néhány dokumentált jelentés retrospektív vizsgálatokban jelent meg.21,22
egyéb kezelések: a Gabapentin, a benzodiazepinek és az opioidok hasznos másodvonalbeli szerek, amelyek megfelelő alternatív terápiaként szolgálnak olyan RLS esetekben, amelyek specifikus tünetekkel járnak, mint a folyamatos alvászavarok vagy a végtagok fájdalmas érzései.
az RLS-re vonatkozó legtöbb kutatás az antikonvulzív gabapentinnel (Neurontin) foglalkozott, amely hasznosnak bizonyult az RLS és a perifériás neuropathia szempontjából.23,24 a Gabapentin, a gamma-amino-vajsav szerkezeti analógja az RLS szubjektív tüneteinek csökkentésével működik.23 mivel aluszékonyságot okozhat, a gabapentin kipróbálható az RLS kiegészítő szereként, amely tartós alvási problémákkal jár.24 további vizsgálat szükséges a gabapentinnel végzett krónikus monoterápia hosszú távú hatásainak vizsgálatához.
viszonylag kevés publikált tanulmány létezik a benzodiazepinek RLS-ben történő alkalmazásáról. Klinikai vizsgálatokban csak klonazepámot és alprazolámot vizsgáltak. Nyugtató tulajdonságaik miatt ezt a két szert elsősorban alvás kiváltására használták. A klonazepám egy kis vizsgálata azt mutatta, hogy a gyógyszer hatékony volt az éjszakai RLS-ben, mivel képes az alvás indukálására és fenntartására; azonban nem csökkentette a PLMs-t alvás közben.25 a nappali álmosság és a kognitív zavarok magasabb incidenciája állítólag a gyógyszer hosszabb hatásával függött össze. Összességében a benzodiazepineket az RLS második vonalbeli lehetőségének tekintik, amely jelentős álmatlansággal jár.26
Az opioid analgetikumok hatása az RLS-ben nem ismert. Egy retrospektív klinikai vizsgálat hosszú távú opioid monoterápiában (oxikodon, propoxifen, kodein vagy metadon) primer RLS-ben részesülő betegeken kimutatta, hogy az opioidok nagyon hatékonyak a motoros tünetek és az alvászavarok enyhítésében, és gyakorlatilag nem okoztak toleranciát vagy fizikai függőséget (a 36 monoterápiás beteg közül csak egynél fordult elő).27 a szerzők az opioid kiválasztását javasolták a beteg panaszainak súlyossága alapján. Egy másik tanulmány azt javasolta, hogy a tramadol (Ultram) alacsonyabb visszaélési potenciállal és kevesebb mellékhatással rendelkezik, mint más opioidok, és hogy ez legyen a választott opioid az RLS kezelésére.28 súlyos, refrakter esetekben orális metadon ajánlott hosszú felezési ideje miatt.29
másodlagos RLS kezelése
egyes betegeknél RLS alakul ki egy másik állapot következményeként. A terhes nők legfeljebb 26% – át érintik az RLS tünetei, különösen a harmadik trimeszterben.30 az RLS magas prevalenciája ESRD-ben és vashiányos betegekben fordul elő.31,32 a másodlagos RLS kezelése a kiváltó ok azonosítására és kezelésére összpontosít. Terhesség alatt a terápiát visszatartják, mivel a nők a szülés után a tünetek teljes megfordulását tapasztalják. A veseátültetés-de nem a dialízis-gyógyítja az RLS-t az ESRD-ben. Intravénás vas adható be, ha a vaskészletek alacsonyak.33 a klinikusoknak értékelniük kell a betegeket olyan egyéb anyagok tekintetében, amelyek súlyosbíthatják az RLS tüneteit, mint például a metoklopromid, az összes neuroleptikum, számos antidepresszáns és antihisztamin. Ha lehetséges, ezeket a szereket fel kell függeszteni.
gyógyszerész szerepe az RLS-ben
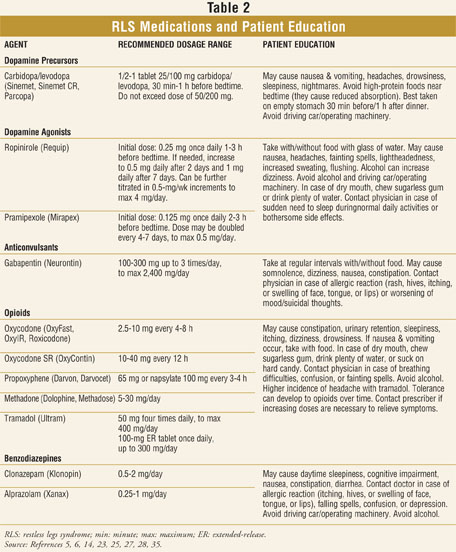
a gyógyszerészeknek tisztában kell lenniük az RLS tipikus jeleivel és tüneteivel, például a borjak, a combok, a lábak vagy akár a karok kellemetlen érzéseivel. Ezeket az érzéseket a betegek gyakran úgy írják le, mint” kúszó”,” kúszó”,” bizsergő”,” ideges”,” mélyen ülő “vagy” égő.”Bár az RLS leírása jelentősen eltérhet a betegek között, a közös elem a végtagok mozgatásának vágya vagy szükségessége, amely esténként romlik, és nehézséget okoz az elalvásban vagy az alvásban. Az RLS által érintett emberek fáradtságra, depressziós hangulatra vagy koncentrációhiányra is panaszkodhatnak.34 a gyógyszerészek fontolóra vehetik annak ajánlását, hogy az RLS-tünetekkel rendelkező betegek beszéljenek az alapellátási orvosukkal egy neurológushoz vagy egy megfelelő alvásspecialistához történő beutalásról orvosuk értékelése és ajánlása alapján. Fontos, hogy a gyógyszerészek megismerjék az RLS leggyakoribb gyógyszereit, és megfelelő tanácsadást nyújtsanak azok megfelelő használatáról és lehetséges káros hatásairól (2.táblázat).
különböző online források léteznek, amelyek további információkat nyújthatnak az RLS-ről. Az RLS Alapítvány (www.rls.org) az RLS-információk legjobb általános forrása. Az oldal tartalmazza a támogató csoportok listáját, egy csevegőszobát, az RLS kezelések naprakész áttekintését és szakértői tanácsokat. Egyéb online források are we MOVE (www.wemove.org) és beszélni Az alvásról (www.talkaboutsleep.com).
1. Allen RP, Walters AS, Montplaisir J, et al. Nyugtalan láb szindróma prevalenciája és hatása: REST általános populációs vizsgálat. Arch Gyakornok Med. 2005;165:1286-1292.
2. Hening W, Walters AS, Allen RP, et al. A nyugtalan láb szindróma (RLS) hatása, diagnózisa és kezelése alapellátási populációban: a REST (RLS epidemiology, symptoms and treatment) alapellátási vizsgálat. Alvás Med. 2004;5:237-246.
3. Picchietti D, Allen RP, Walters AS, et al. Nyugtalan láb szindróma: prevalencia és hatás gyermekeknél és serdülőknél-a Peds REST tanulmány. Gyermekgyógyászat. 2007;120:253-266.
4. Wetter TC, Eisensehr I, Trenkwalder C. funkcionális neuroimaging vizsgálatok nyugtalan láb szindrómában. Alvás Med. 2004;5:401-406.
5. Trenkwalder C, Garcia-Borreguero D, Montagna P, et al. Ropinirol a nyugtalan láb szindróma kezelésében: a TREAT RLS 1 vizsgálat eredményei, egy 12 hetes, randomizált, placebo-kontrollos vizsgálat 10 európai országban. J Neurol Idegsebészeti Pszichiátria. 2004;75:92-97.
6. Winkelman JW, Sethi KD, Kushida CA, et al. A pramipexol hatásossága és biztonságossága nyugtalan láb szindróma esetén. Neurológia. 2006;67:1034-1039.
7. Connor JR, Boyer PJ, Menzies SL, et al. A neuropatológiai vizsgálat azt sugallja, hogy a nyugtalan láb szindrómában károsodott az agyi vasszerzés. Neurológia. 2003;61:304-309.
8. Wang X, Wiesinger J, Beard J, et al. Az agyban a thy1 expressziót befolyásolja a vas, és nyugtalan láb szindróma esetén csökken. J Neurol Sci. 2004;220:59-66.
9. Mathias RA, Hening W, Washburn M, et al. A nyugtalan láb szindróma szegregációs elemzése: lehetséges bizonyítékok egy fő génre egy vak diagnózisokat alkalmazó családi vizsgálatban. Zümmögött.
10. Desautels a, Turecki G, Xiong L, et al. A neurotenzin mutációs elemzése családi nyugtalan láb szindrómában. Mov Disord. 2004;19:90-94.
11. Walters mint. A nyugtalan láb szindróma jobb meghatározása felé. A Nemzetközi Nyugtalan Láb Szindróma Tanulmányozó Csoport. Mov Disord. 1995;10:634-642.
12. Allen RP, Picchietti D, Hening WA, et al. Nyugtalan láb szindróma: diagnosztikai kritériumok, különleges szempontok, epidemiológia. A jelentés a nyugtalan láb szindróma diagnózis és epidemiológiai műhely a National Institutes of Health. Alvás Med. 2003;4:101-119.
13. Silber MH, Ehrenberg BL, Allen RP és mtsai. Algoritmus a nyugtalan láb szindróma kezelésére. Mayo Clin Proc. 2004;79:916-922.
14. Trenkwalder C, Collado Seidel V, Kazenwadel J, et al. Egyéves kezelés standard és nyújtott hatóanyagleadású levodopával: a nyugtalan láb szindróma megfelelő hosszú távú kezelése? Mov Disord.
15. Allen RP, Earley CJ. A nyugtalan láb szindróma fokozódása karbidopával / levodopával. Aludj.
16. Schade R, Andersohn F, Suissa S, et al. Dopamin agonisták és a szívbillentyű regurgitációjának kockázata. N Engl J Med. 2007;356:29-38.
17. Walters AS, Ondo WG, Dreykluft T, et al. A ropinirol hatékony a nyugtalan láb szindróma kezelésében. TREAT RLS 2: 12 hetes, kettős-vak, randomizált, párhuzamos csoport, placebo-kontrollos vizsgálat. Mov Disord. 2004;19:1414-1423.
18. Bogan RK, Fry JM, Schmidt MH, et al. Ropinirol nyugtalan láb szindrómában szenvedő betegek kezelésében: amerikai székhelyű randomizált, kettős-vak, placebo-kontrollos klinikai vizsgálat. Mayo Clin Proc.
19. Oertel WH, Stiasny-Kolster K, Bergholdt B, et al. A pramipexol hatékonysága nyugtalan láb szindrómában: hathetes, multicentrikus, randomizált, kettős-vak vizsgálat (effect-RLS vizsgálat). Mov Disord.
20. Trenkwalder C, Stiasny-Kolster K, Kupsch a, et al. A pramipexol kontrollos megvonása 6 hónapos nyílt kezelést követően nyugtalan láb szindrómában szenvedő betegeknél. Mov Disord.
21. Ferini-Strambi L. nyugtalan láb szindróma augmentáció és pramipexol kezelés. Alvás Med.
22. Winkelman JW, Johnston L. a nyugtalan láb szindróma (RLS) hosszú távú pramipexol-kezelésével kapcsolatos augmentáció és tolerancia. Alvás Med. 2004;5:9-14.
23. Happe s, Kl Xhamsch G, Saletu B, Zeitlhofer J. idiopátiás nyugtalan láb szindróma (RLS) kezelése gabapentinnel. Neurológia. 2001;57:1717-1719.
24. Garcia-Borreguero D, Larrosa O, de la Llave Y, et al. Nyugtalan láb szindróma kezelése gabapentinnel: kettős vak, keresztezett vizsgálat. Neurológia. 2002;59:1573-1579.
25. Saletu M, Anderer P, Saletu-Zyhlarz G, et al. Nyugtalan láb szindróma (RLS) és periodikus végtagmozgási zavar (PLMD): klonazepámmal végzett akut placebo-kontrollos alvászavar laboratóriumi vizsgálatok. Eur Neuropsychopharmacol. 2001;11:153-161.
26. Schenck CH, Mahowald MW. Hosszú távú, éjszakai benzodiazepin kezelés káros parasomniák és egyéb zavarok megszakadt éjszakai alvás 170 felnőtt. Am J Med.
27. Walters AS, Winkelmann J, Trenkwalder C, et al. Opioidokkal kezelt nyugtalan láb szindrómás betegek hosszú távú nyomon követése. Mov Disord. 2001;16:1105-1109.
28. Lauerma H, Markkula J. nyugtalan láb szindróma kezelése tramadollal: nyílt vizsgálat. J Clin Pszichiátria. 1999;60:241-244.
29. Ondo WG. Metadon refrakter nyugtalan láb szindróma esetén. Mov Disord. 2005;20:345-348.
30. Manconi M, Govoni V, De Vito A, et al. Nyugtalan láb szindróma és terhesség. Neurológia.
31. Gigli GL, Adorati M, Dolso P és mtsai. Nyugtalan láb szindróma végstádiumú vesebetegségben. Alvás Med. 2004;5:309-315.
32. Sun ER, Chen CA, Ho G és mtsai. Vas és a nyugtalan láb szindróma. Aludj. 1998;21:371-377.
33. Earley CJ, Heckler D, Allen RP. A vas ismételt IV adagjai a nyugtalan láb szindróma hatékony kiegészítő kezelését biztosítják. Alvás Med. 2005;6:301-305.
34. Kushida C, Martin M, Nikam P és mtsai. A nyugtalan láb szindróma terhe az egészséggel kapcsolatos életminőségre. Qual Life Res. 2007;16: 617-624.
35. Tények & összehasonlítások. Tények & összehasonlítások 4.0 .www.factsandcomparisons.com. hozzáférés augusztus 31, 2008. 2006;62:157-164. 2003;18:1184-1189. 1996;19:205-213. 2006;81:17-27. 2007;22:213-219. 2006;21:1404-1410. 2002; 3 (kiegészítés): S23-S25. 1996;100:333-337. 2004;63:1065-1069.