SF6 molekuláris geometria, Lewis szerkezet, alak és polaritás
a kén-hexafluorid vagy az SF6 szervetlen, üvegházhatású gáz. Nem gyúlékony, szagtalan és színtelen, és kiváló szigetelőanyag. Ez egy hipervalens oktaéderes molekula, amely érdekes beszélgetési téma volt a kémia rajongói körében.Henri Moissan felfedezte az SF6 létezését. Mellesleg ő is a fluor felfedezője. Az SF6 szintetizálásának szokásos módja az S8 F2-nek való kitettsége. Ez a módszer néhány kén-fluorid képződését okozza,de ezek melegítéssel kiküszöbölhetők, majd NaOH segítségével eltávolíthatók minden további SF4 molekula.
az SF6 nem használható közvetlenül a szintézis után. Meg kell tisztítani, hogy megszabaduljon az összes reaktív fluoridtól. Ezt követően át kell mennie a pirolízisen.
ebben a blogbejegyzésben megismerjük az SF6 Lewis szerkezetét és kötési szögeit, molekuláris geometriáját és alakját, amelyek segíthetnek megérteni ennek a molekulának a fizikai tulajdonságait.
| Name of molecule | Sulphur Hexafluoride ( SF6) |
| No of Valence Electrons in the molecule | 48 |
| Hybridization of SF6 | sp3d2 hybridization |
| Bond Angles | 90 degrees |
| Molecular Geometry of SF6 | Octahedral |
Contents
SF6 Valence Electrons
To determine the Lewis Bármely molekula szerkezete, először meg kell tudnunk a vegyérték elektronok teljes számát. Itt megtudjuk az SF6 vegyértékelektronjainak teljes számát azáltal, hogy hozzáadjuk a vegyérték elektronokat mind a kén, mind a fluor atomokhoz.
összes vegyérték elektronok SF6 – vegyérték elektronok kén + vegyérték elektronok fluor
kén hat vegyérték elektronok.
a fluornak hét vegyértékelektronja van, de mivel ebben a molekulában hat fluor atom van, ezt a számot megszorozzuk 6-tal.
= 6 + 7*6
= 6 + 42
= 48 vegyérték elektronok
így SF6 48 vegyérték elektronok, amelyek segítenek felhívni a Lewis Dot szerkezete SF6.
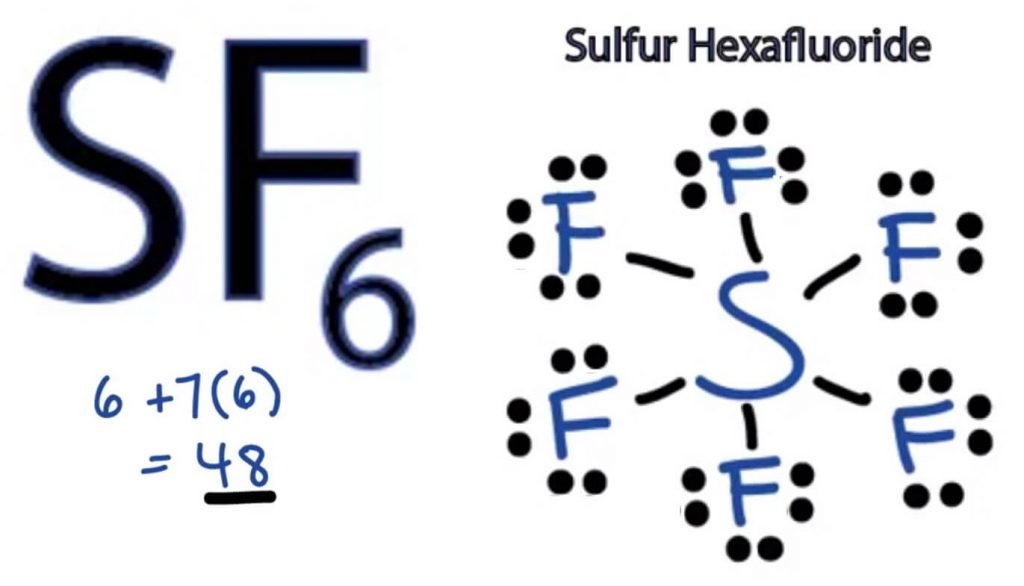
SF6 Lewis szerkezet
bármely molekula Lewis-Pontszerkezete a szerkezet kialakításában részt vevő atomok és az egyes vegyértékelektronok képi ábrázolása. Ez a szerkezet segít megismerni a molekulában lévő kötésképződéseket és az elektronok elrendezését.
a kénatom központi helyzetbe kerül, mivel kevésbé elektronegatív, mint a fluor. Tehát helyezze a középpontba és az összes fluor atomot körülötte, így:
a fluor atomnak csak egy vegyértékelektronra van szüksége az oktett befejezéséhez. Mivel minden atom követi az oktettszabályt, hogy stabil szerkezetet érjen el, a fluor atom egy vegyértékelektronnal rendelkezik kénatom. Így a kén hat vegyértékelektronját megosztja az összes fluor atommal, ami hat egyszeri kötést eredményez S és F között.
Lewis szerkezetében a kötéseket a szerkezetben két atom közötti egyenes húzásával mutatjuk be. Tehát ezek a kötések 12 vegyértékelektront vesznek fel a 48-ból.
helyezze az összes fennmaradó vegyértékelektront a fluor atomok köré, és ellenőrizze, hogy az összes fluor Atom oktettje teljes-e.
Ha ezt megteszi, az összes fluor atom külső héjában vegyértékelektronokat fog látni, de a kénnek több mint 8 elektronja van a külső héjában. Ez azért van, mert kivétel az oktett szerep alól, és kibővítheti pályáját, hogy több elektront befogadjon.
ezért ez az SF6 megfelelő Lewis-szerkezete.
SF6 hibridizáció
most, hogy ismerjük az SF6 Lewis szerkezetét, most meg tudjuk határozni az atomok hibridizációját a molekulában. Itt, amikor a kén megosztja elektronjait a fluor atomokkal, megvizsgáljuk hibridizációját.
az SF6 elektronikus konfigurációja alapállapotában 3s23p4. De amikor megosztja az elektronokat, és gerjesztett állapotban van, az elektronpárok mind a 3s, mind a 3p pályán párosítatlanok lesznek. Ezek az elektronok mozognak, hogy kitöltsék a magasabb üres 3D pályákat. Ennek eredményeként hat hibrid pálya képződik (az egyik 3s, három 3p, kettő 3D). Ezek a hibrid pályák azok, amelyek befogadják a megosztott elektronokat. Ezek a pályák átfedik a fluor atom 2P pályáit, amikor a kén és a fluor atomok kötéseket képeznek. Ez a hat pálya az oktaéder alakjának hat irányában van.
ezért a kén-hexafluorid sp3d2 hibridizációval rendelkezik.
SF6 kötési szög
mivel a kén 6 fluor atommal osztja meg vegyértékelektronjait, láthatjuk, hogy a kénatom mind a hat elektronja közös kötéseket képez. Az F-S-F kötési szöge 90 fok.
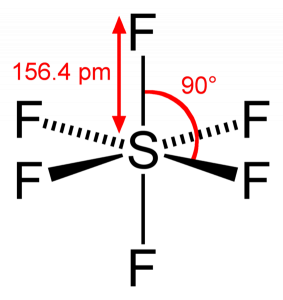
SF6 molekuláris geometria
amikor a kén-hexafluorid molekulát vizsgáljuk, a kén központi helyzetben van, a fluor atomok szimmetrikusan vannak elrendezve körülötte. Az atomok az oktaéderes mintába kerülnek, ami az SF molekuláris geometriáját6 oktaéder.
SF6 alak
a molekula molekuláris geometriáját tekintve azt mondhatjuk, hogy az SF6 molekula oktaéderes alakú, mivel nyolc oldala van. A központi atom azonban hat Fluoratommal kötődik, az SF6 alakja oktaéder.

az SF6 poláris vagy nem poláros?
az SF6 egy nem poláros molekula. A VSEPR-elmélet ugyanis azt mondja, hogy amikor hat fluor Atom szimmetrikusan helyezkedik el a kénatom körül, a kötési dipólusok megszűnnek. Ennek eredményeként ez egy nem poláros molekula.

ugyanolyan tulajdonságokkal rendelkezik, mint a nem poláros molekulák, például vízben nem oldódik és nem poláros szerves oldószerekben oldódik.
Záró megjegyzések
a cikk összefoglalásához elmondhatjuk, hogy az SF6 Lewis-pontszerkezetében az összes vegyértékelektron elhasználódik, ami hat egyszeri kötést eredményez az S-F között, magányos elektronpárok nélkül.
a kén hibridizációja ebben a molekulában sp3d2 90 fokos kötési szögekkel.
az SF6 molekuláris geometriája oktaéder és nem poláros molekula.