7.18: Alogenuri vinilici e alogenuri arilici
Sostituzione nucleofila negli alogenuri arilici
Vedremo in dettaglio la struttura del clorobenzene. Bromobenzene e iodobenzene sono uguali. Il modo più semplice per disegnare la struttura di clorobenzene è:
Per capire clorobenzene correttamente, è necessario scavare un po ‘ più profondo di questo. C’è un’interazione tra gli elettroni delocalizzati nell’anello benzenico e una delle coppie solitarie sull’atomo di cloro. Questo si sovrappone al sistema elettronico ad anello delocalizzato . . .
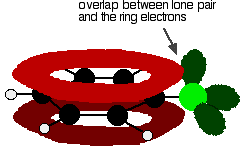
per dare una struttura un po ‘ come questa:
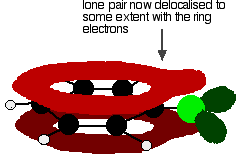
Questa delocalizzazione non è affatto completa, ma ha un effetto significativo sulle proprietà legame cloro e polarità della molecola. La delocalizzazione introduce un legame extra tra il carbonio e il cloro, rendendo il legame più forte. Questo ha un effetto importante sulle reazioni di composti come il clorobenzene.
C’è anche un certo movimento di elettroni dal cloro verso l’anello. Il cloro è abbastanza elettronegativo e di solito attira elettroni nel legame carbonio-cloro verso se stesso. In questo caso, questo è compensato in una certa misura dal movimento degli elettroni verso l’anello nella delocalizzazione. La molecola è meno polare di quanto si sarebbe altrimenti previsto.
Gli alogenuri arilici semplici come il clorobenzene sono molto resistenti alla sostituzione nucleofila. È possibile sostituire il cloro con-OH, ma solo in condizioni industriali molto severe, ad esempio a 200°C e 200 atmosfere. In laboratorio, queste reazioni non accadono. Ci sono due ragioni per questo – a seconda di quale dei meccanismi di cui sopra si sta parlando.
- La forza extra del legame carbonio-alogeno negli alogenuri arilici: il legame carbonio-cloro nel clorobenzene è più forte di quanto ci si potrebbe aspettare. C’è un’interazione tra una delle coppie solitarie sull’atomo di cloro e gli elettroni dell’anello delocalizzati, e questo rafforza il legame. Entrambi i meccanismi di cui sopra comportano la rottura del legame carbonio-alogeno ad un certo punto. Più è difficile rompere, più lenta sarà la reazione.
- Repulsione da parte degli elettroni dell’anello: questo si applicherà solo se lo ion idrossido ha attaccato il clorobenzene con un meccanismo come il primo descritto sopra. In quel meccanismo, lo hydroxide idrossido attacca il carbonio leggermente positivo a cui è collegato l’atomo di alogeno.Se l’atomo di alogeno è collegato a un anello di benzene, lo incoming idrossido in entrata si troverà di fronte agli elettroni dell’anello delocalizzati sopra e sotto quell’atomo di carbonio. Lo ion idrossido negativo sarà semplicemente respinto. Quel particolare meccanismo è semplicemente un non-starter!