Etichetta: MEGACE ES-megestrol acetate suspension
FARMACOLOGIA CLINICA
Esistono diversi metodi analitici utilizzati per stimare le concentrazioni plasmatiche di megestrol acetate, tra cui gascromatografia-mass fragmentography (GC-MF), cromatografia liquida ad alta pressione (HPLC) e radioimmunoassay (RIA). I metodi GC-MF e HPLC sono specifici per l’acetato di megestrol e le concentrazioni equivalenti del rendimento. Il metodo RIA reagisce ai metaboliti di megestrol acetato ed è, quindi, non specifico e indica concentrazioni più elevate rispetto ai metodi GC-MF e HPLC. Le concentrazioni plasmatiche dipendono, non solo dal metodo utilizzato, ma anche dall’inattivazione intestinale ed epatica del farmaco, che può essere influenzata da fattori quali la motilità del tratto intestinale, i batteri intestinali, gli antibiotici somministrati, il peso corporeo, la dieta e la funzionalità epatica.
Meccanismo di azione
Parecchi ricercatori hanno riferito sull’appetito che migliora la proprietà dell’acetato di megestrol ed il suo uso possibile in cachexia. Il meccanismo preciso con cui megestrol acetato produce effetti in anoressia e cachessia è sconosciuto al momento attuale.
Proprietà farmacocinetiche:
Le concentrazioni plasmatiche di megestrol acetato dopo somministrazione di 625 mg (125 mg/mL) di Megace® ES sospensione orale sono equivalenti in condizioni di alimentazione a 800 mg (40 mg/mL) di megestrol acetato sospensione orale (vedere figura sotto).
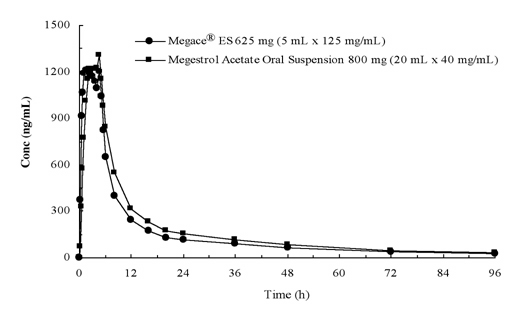
Al fine di caratterizzare la proporzionalità della dose di Megace® ES, sono stati condotti studi di farmacocinetica su un intervallo di dosi quando somministrati a digiuno e alimentati. La farmacocinetica di megestrol era lineare nell’intervallo di dosaggio tra 150 mg e 675 mg dopo la somministrazione di Megace® ES indipendentemente dalle condizioni del pasto. La Cmax e l’AUC sotto un pasto ad alto contenuto di grassi sono aumentate del 48% e del 36%, rispettivamente, rispetto a quelle sotto il digiuno dopo la somministrazione di 625 mg Megace® ES (Tabella 1). Tuttavia, un pasto ad alto contenuto di grassi ha aumentato significativamente l’AUC e la Cmax di megestrol rispettivamente a 2 e 7 volte rispetto a quelli a digiuno dopo la somministrazione di 800 mg nella formulazione originale. Non c’è stata alcuna differenza nella sicurezza dopo la somministrazione nello stato fed, quindi Megace® ES potrebbe essere assunto indipendentemente dai pasti.
|
*megestrol acetate oral suspension |
||||||||||||||||
| Table 1 – Pharmacokinetic Studies Conducted with Megace® ES | ||||||||||||||||
| Amount Dosed | 150 mg | 250 mg | 375 mg | 450 mg | 575 mg | 625 mg | 675 mg | 800 mg* | ||||||||
| Dose | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 20 mL | ||||||||
| Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | |
| Cmax (ng/mL) | 412 | 379 | 647 | 588 | 810 | 958 | 955 | 1079 | – | 1421 | 1133 | 1618 | 1044 | 1616 | 187 | 1364 |
| AUC0-∞ (ng∙h/mL) | 3058 | 3889 | 5194 | 6328 | 7238 | 12193 | 9483 | 11800 | – | 14743 | 12095 | 16268 | 11879 | 17029 | 8942 | 18625 |
| Tmax (h) | 1.74 | 3.80 | 1.58 | 3.38 | 1.56 | 3.42 | 1.74 | 3.16 | – | 3.75 | 1.72 | 2.91 | 1.96 | 2.76 | 5.89 | 3.85 |
La farmacocinetica plasmatica allo steady state di megestrol acetato è stata valutata in 10 pazienti adulti maschi cachettici con sindrome da immunodeficienza acquisita (AIDS) e una perdita di peso involontaria superiore al 10% del basale. I pazienti hanno ricevuto dosi orali singole di 800 mg / die di sospensione orale megestrol acetato per 21 giorni. I dati sulla concentrazione plasmatica ottenuti al giorno 21 sono stati valutati fino a 48 ore dopo l’ultima dose.
La concentrazione plasmatica media (±1SD) di picco (Cmax) di megestrol acetato è stata di 753 (±539) ng / mL. L ‘ area media sotto la curva del tempo di concentrazione (AUC) era di 10476 (±7788) ng x h/mL. Il valore mediano di Tmax è stato di cinque ore. Sette pazienti su 10 hanno guadagnato peso in tre settimane.
Inoltre, 24 soggetti adulti sieropositivi per HIV asintomatici sono stati trattati una volta al giorno con 750 mg di megestrol acetato sospensione orale. Il trattamento è stato somministrato per 14 giorni. I valori medi di Cmax e AUC sono stati rispettivamente di 490 (±238) ng/mL e 6779 (±3048) h x ng/mL. Il valore mediano di Tmax è stato di tre ore. Il valore medio di Cmax era di 202 (±101) ng / mL. La percentuale media del valore di fluttuazione era 107 (±40).
Metabolismo
I metaboliti di Megestrol acetato identificati nelle urine costituivano dal 5% all ‘ 8% della dose somministrata. L’escrezione respiratoria come biossido di carbonio marcato e l’accumulo di grasso possono aver rappresentato almeno una parte della radioattività non trovata nelle urine e nelle feci.
Eliminazione
La principale via di eliminazione del farmaco nell’uomo è l’urina. Quando megestrol acetato radiomarcato è stato somministrato all’uomo in dosi da 4 a 90 mg, l’escrezione urinaria entro 10 giorni variava dal 56,5% al 78,4% (media 66,4%) e l’escrezione fecale variava dal 7,7% al 30,3% (media 19,8%). La radioattività totale recuperata variava tra l ‘ 83,1% e il 94,7% (media 86,2%).
Popolazioni speciali
La farmacocinetica di megestrol acetato non è stata studiata in nessuna popolazione speciale.
FARMACOLOGIA ANIMALE E / O TOSSICOLOGIA
Il trattamento a lungo termine con Megace ® ES (megestrol acetato) può aumentare il rischio di infezioni respiratorie. Una tendenza verso un aumento della frequenza delle infezioni respiratorie, una diminuzione della conta dei linfociti e un aumento della conta dei neutrofili è stata osservata in uno studio di tossicità cronica/cancerogenicità di due anni condotto su megestrol acetato nei ratti.
DESCRIZIONE DEGLI STUDI CLINICI
Megestrol acetato sospensione orale alla dose di 800 mg / 20 mL è equivalente a 625 mg/5 mL di Megace ® ES. L’efficacia clinica di megestrol acetato sospensione orale è stata valutata in due studi clinici. Uno era uno studio multicentrico, randomizzato, in doppio cieco, controllato con placebo che confrontava megestrol acetato (MA) a dosi di 100 mg, 400 mg e 800 mg al giorno rispetto a placebo in pazienti affetti da AIDS con anoressia/cachessia e significativa perdita di peso. Dei 270 pazienti inseriti nello studio, 195 soddisfacevano tutti i criteri di inclusione/esclusione, avevano almeno due ulteriori misurazioni del peso dopo il basale in un periodo di 12 settimane o avevano una misurazione del peso dopo il basale, ma si erano ritirati per fallimento terapeutico. La percentuale di pazienti che hanno guadagnato cinque o più chili al massimo aumento di peso in 12 settimane di studio è stata statisticamente significativamente maggiore per i gruppi trattati con 800 mg (64%) e 400 mg (57%) MA rispetto al gruppo placebo (24%). Il peso medio è aumentato dal basale all ‘ ultima valutazione in 12 settimane di studio nel gruppo trattato con 800 mg di MA di 7.8 sterline, il gruppo MA da 400 mg di 4,2 sterline, il gruppo MA da 100 mg di 1,9 sterline e diminuito nel gruppo placebo di 1,6 sterline. Le variazioni medie di peso a 4, 8 e 12 settimane per i pazienti valutabili per l ‘ efficacia nei due studi clinici sono mostrate graficamente. Le variazioni nella composizione corporea durante le 12 settimane di studio misurate con l’analisi dell’impedenza bioelettrica hanno mostrato aumenti del peso corporeo non idrico nei gruppi trattati con MA (vedere tabella degli studi clinici). Inoltre, l’edema si è sviluppato o peggiorato in soli 3 pazienti.
Percentuali maggiori di pazienti trattati con MA nel gruppo trattato con 800 mg (89%), nel gruppo trattato con 400 mg (68%) e nel gruppo trattato con 100 mg (72%), rispetto al gruppo trattato con placebo (50%), hanno mostrato un miglioramento dell ‘appetito all’ ultima valutazione durante le 12 settimane di studio. Una differenza statisticamente significativa è stata osservata tra il gruppo trattato con 800 mg MA e il gruppo placebo nella variazione dell’apporto calorico dal basale al momento della variazione massima del peso. Ai pazienti è stato chiesto di valutare il cambiamento di peso, l’appetito, l’aspetto e la percezione generale del benessere in un sondaggio di 9 domande. Alla variazione massima di peso solo il gruppo trattato con 800 mg di MA ha dato risposte statisticamente significativamente più favorevoli a tutte le domande rispetto al gruppo trattato con placebo. Nel sondaggio è stata osservata una risposta alla dose con risposte positive correlate a dosi più elevate per tutte le domande.
Il secondo studio è stato uno studio multicentrico, randomizzato, in doppio cieco, controllato con placebo che ha confrontato megestrol acetato 800 mg/die rispetto a placebo in pazienti affetti da AIDS con anoressia/cachessia e significativa perdita di peso. Dei 100 pazienti inseriti nello studio, 65 soddisfacevano tutti i criteri di inclusione / esclusione, avevano almeno due ulteriori misurazioni del peso dopo il basale in un periodo di 12 settimane o avevano una misurazione del peso dopo il basale, ma si erano ritirati per fallimento terapeutico. I pazienti nel gruppo trattato con 800 mg di MA hanno avuto un aumento statisticamente significativamente maggiore della variazione di peso massimo medio rispetto ai pazienti nel gruppo placebo. Dal basale alla settimana di studio 12, il peso medio è aumentato di 11,2 libbre nel gruppo trattato con MA e diminuito di 2,1 libbre nel gruppo placebo. I cambiamenti nella composizione corporea misurati mediante analisi dell’impedenza bioelettrica hanno mostrato aumenti del peso non idrico nel gruppo trattato con MA (vedere tabella degli studi clinici). Non è stato riportato edema nel gruppo trattato con MA. Una percentuale maggiore di pazienti trattati con MA (67%) rispetto ai pazienti trattati con placebo (38%) ha mostrato un miglioramento dell ‘appetito all’ ultima valutazione durante le 12 settimane di studio; questa differenza era statisticamente significativa. Non ci sono state differenze statisticamente significative tra i gruppi di trattamento nel cambiamento calorico medio o nell’apporto calorico giornaliero al momento della variazione massima del peso. Nello stesso sondaggio di 9 domande a cui si fa riferimento nel primo studio, le valutazioni dei pazienti sulla variazione di peso, sull’appetito, sull’aspetto e sulla percezione generale del benessere hanno mostrato aumenti dei punteggi medi nei pazienti trattati con MA rispetto al gruppo placebo.
In entrambi gli studi, i pazienti hanno tollerato bene il farmaco e non sono state osservate differenze statisticamente significative tra i gruppi di trattamento per quanto riguarda anomalie di laboratorio, nuove infezioni opportunistiche, conta linfocitaria, conta T4, conta T8 o test di reattività cutanea (vedere la sezione ADVERSEREACTIONS).
| Megestrol Acetate Oral Suspension Clinical Efficacy Trials | |||||||
| Trial 1 | Trial 2 | ||||||
| Study Accrual Dates | Study Accrual Dates | ||||||
| 11/88 to 12/90 | 5/89 to 4/91 | ||||||
| Megestrol Acetate, mg/day | 0 | 100 | 400 | 800 | 0 | 800 | |
| Entered Patients | 38 | 82 | 75 | 75 | 48 | 52 | |
| Evaluable Patients | 28 | 61 | 53 | 53 | 29 | 36 | |
| Mean Change in Weight (lb.) | |||||||
| Baseline to 12 Weeks | 0.0 | 2.9 | 9.3 | 10.7 | -2.1 | 11.2 | |
| % Patients ≥ 5 Pound Gain | |||||||
| At Last Evaluation in 12 weeks | 21 | 44 | 57 | 64 | 28 | 47 | |
| Mean Changes in Body Composition: | |||||||
| Fat Body Mass (lb.) | 0.0 | 2.2 | 2.9 | 5.5 | 1.5 | 5.7 | |
| Lean Body Mass (lb.) | -1.7 | -0.3 | 1.5 | 2.5 | -1.6 | -0.6 | |
| Water (liters) | -1.3 | -0.3 | 0.0 | 0.0 | -0.1 | -0.1 | |
| % Patients With Improved Appetite: | |||||||
| At Time of Maximum Weight Change | 50 | 72 | 72 | 93 | 48 | 69 | |
| At Last Evaluation in 12 Weeks | 50 | 72 | 68 | 89 | 38 | 67 | |
| Mean Change in Daily Caloric Intake: | |||||||
| Baseline to Time of Maximum Weight Change | -107 | 326 | 308 | 646 | 30 | 464 | |
| *Based on bioelectrical impedance analysis determinations at last evaluation in 12 weeks |
Presented below are the results of mean weight changes for patients evaluable for efficacy in trials 1 and 2.