Frontiere in Medicina cardiovascolare
Introduzione
Nell’esaminare i sistemi di coordinate che potrebbero essere utilizzati per diverse entità biologiche, dovrebbero essere considerate caratteristiche specifiche. Ad esempio, il numero cromosomico e la posizione della coppia di basi formano un sistema di coordinate lineari sufficiente a definire la posizione nel genoma di riferimento (1). Tuttavia, un sistema di coordinate per l’intero corpo umano, che può soddisfare le esigenze di HuBMAP, HCA, HPA e altri sforzi di mappatura, è molto più complesso per diversi motivi (2-5). Innanzitutto, le cellule vivono in tre dimensioni; e sono necessarie ulteriori informazioni per descrivere la dimensione e l’orientamento rotazionale di qualsiasi campione di tessuto utilizzato per generare i dati. In secondo luogo, mentre la posizione della coppia di basi del genoma non dipende da come il DNA viene piegato e imballato nel nucleo, le posizioni dei singoli elementi (ad es., cellule, organi) all’interno del corpo sono dinamici, in quanto possono cambiare con movimenti scheletrici e muscolari, gravità, respirazione, battito cardiaco e altre funzioni e forze che distorcono il tessuto. In terzo luogo, sebbene la variabilità del DNA tra le persone sia <1%, la geometria del corpo umano si estende su una vasta gamma di altezze, pesi e forme, che variano in base al sesso e alla razza e cambiano in modo significativo durante la vita di una persona.
Un’opzione è quella di utilizzare un sistema di coordinate cartesiane 3D per descrivere la posizione all’interno del corpo. I sistemi di coordinate cartesiane hanno il vantaggio di essere familiari e facilmente comprensibili. Con il corpo in posizione anatomica standard, sinistra-destra, caudale-cranica e posteriore-anteriore formano tre assi perpendicolari (x-y-z). Per le analisi su scala più piccola, centrare l’origine su un punto di riferimento anatomico potrebbe essere più utile e potenzialmente meno variabile tra persone diverse. Ad esempio, sarebbe più facile misurare la distanza di un campione di tessuto dal rene al polo superiore del rene che alla cima della testa di una persona. Lo svantaggio delle coordinate cartesiane è che i suoi assi non seguono la forma naturale del corpo. Di conseguenza, la creazione di una mappa del corpo di riferimento “cucendo” digitalmente campioni di tessuto raccolti da persone di dimensioni diverse richiederebbe un complesso processo di deformazione, rotazione e allineamento dei dati. Fare questo in un modo che scala a tutto il corpo, pur mantenendo la precisione a livello cellulare sarebbe estremamente impegnativo.
Altri sistemi di coordinate 3D sono stati sviluppati per diverse applicazioni. Ad esempio, le coordinate sferiche, con assi che rappresentano latitudine, longitudine ed elevazione, descrivono convenientemente la posizione sulla superficie della Terra. Un semplice percorso in coordinate sferiche, come “1 km a est”, è molto più difficile da comunicare usando le coordinate cartesiane. Allo stesso modo, i sistemi di coordinate per il corpo umano dovrebbero idealmente avere assi che seguono strutture anatomiche, modelli di espressione genetica, gradienti chimici e/o altri percorsi biologicamente rilevanti. Sono stati sviluppati diversi sistemi di coordinate organo-specifici, come le coordinate di Talairach per l’imaging cerebrale funzionale, ma questi non si estendono a tutto il corpo (6).
Sistema di coordinate basato vascolare
Nel 2017, un meeting Common Coordinate Framework (CCF) è stato organizzato dal National Institutes of Health, dal Broad Institute, dal Sanger Institute e dall’iniziativa Chan Zuckerberg. I partecipanti alla riunione, che includevano anatomisti, patologi, medici ed esperti di tecnologia di tutto il mondo, hanno suggerito diversi approcci per mappare le cellule del corpo umano, compresi i sistemi di coordinate anatomicamente basati (7). Uno di questi, che utilizza la vascolarizzazione, è stato ulteriormente discusso in un workshop CCF 2019, in particolare per la localizzazione delle cellule renali (8). In questo manoscritto, presentiamo una panoramica concettuale di questo sistema di coordinate basato vascolare e descriviamo i suoi benefici e limiti (Figura 1).
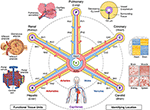
Figura 1. La struttura hub-and-spoke di un sistema di coordinate vascolari. Il sistema di coordinate vascolari è costituito da anelli di vasi rappresentativi che iniziano e terminano nelle camere del cuore e si estendono alle unità funzionali di ciascun organo (in senso antiorario dall’alto a sinistra: alveoli, glomeruli e lobuli epatici). L ‘ ” indirizzo “di una cellula comprende il nome del ciclo (ad esempio,” R “per renale e” H “per epatica) e il livello di ramificazione del vaso più vicino (ad esempio,” RA1″ per arteriole afferenti nel ciclo renale). Si noti che le pareti del cuore si trovano lungo il ciclo vascolare coronarico (“C”) e le cellule di alcune strutture interne al cuore sono effettivamente posizionate sulla periferia del sistema di coordinate, vicino ai capillari che forniscono loro sangue. Ci sono diversi modi per individuare una posizione ancora più precisa “simile al GPS”, tra cui, andando in senso orario dall’alto a destra, l’ “impronta digitale di ipossia” che deriva dalla diminuzione dei livelli di ossigeno più lontano dal vaso, l’unica “impronta istologica” e “impronta genica” in diversi tipi di cellule endoteliali vascolari e la distintiva “impronta digitale dell’architettura vascolare” trovata in La vascolarizzazione si estende a tutte le parti del corpo (in basso) e incornicia tutti gli organi a tutte le scale. File sorgente: Le immagini dei lobuli epatici, glomeruli, alveoli, l’espressione del gene mappa di calore e corpo intero sistema vascolare sono adattati da Wikimedia Commons: https://commons.wikimedia.org/wiki/File:2423_Microscopic_Anatomy_of_Liver.jpg (di Pubblico Dominio); https://commons.wikimedia.org/wiki/File:Juxtaglomerular_Apparatus_and_Glomerulus.jpg (CC BY 3.0); https://commons.wikimedia.org/wiki/File:Alveolus_diagram.svg (di Pubblico Dominio); https://commons.wikimedia.org/wiki/File:Iris_dendrogram.png (CC BY-SA 4.0 licenza); e, https://commons.wikimedia.org/wiki/File:Circulatory_System_en.svg (di Pubblico Dominio). Mappa di calore espressione genica ricreata da Guo et al. (9) utilizzo di dati simulati. Architettura vascolare basata su Bosetti et al. (10) (licenza CC BY 4.0).
L’obiettivo di un sistema di coordinate vascolari non è quello di costruire una mappa del sistema vascolare. Piuttosto, l’idea è di utilizzare percorsi vascolari noti attraverso il corpo come un asse in un sistema di coordinate in grado di descrivere la posizione di elementi anatomici, come le cellule, nel tessuto che circonda la vascolarizzazione. In questo quadro proposto, le camere del cuore possono essere viste come l’origine nella mappa di tutto il corpo. L’asse vascolare contiene anelli vascolari (paragonabili alle “strade” nella metafora di Google Map) che si estendono attraverso l’aorta o l’arteria polmonare, gradualmente si assottigliano verso le dimensioni di una singola cellula mentre si avvicinano a ogni altra cellula in ogni organo del corpo e ritornano al cuore. Lungo questi percorsi, la vascolarizzazione segue la biologia unica dei vari organi e tessuti; e, allo stesso modo, gli organi e i tessuti del corpo non potrebbero esistere senza le proprietà uniche della loro vascolarizzazione strettamente integrata.
Proprio come la mappa del genoma dispiega il DNA in una sequenza lineare, possiamo immaginare di dispiegare le complesse torsioni 3D dell’asse vascolare in una più semplice forma 2D “hub-and-spoke” con le camere del cuore al centro. Questa rappresentazione schematica della vascolarizzazione rende più facile (1) descrivere la posizione nel corpo; (2) allineare le vie vascolari con diverse forme 3D ma funzione equivalente da persone diverse; (3) identificare modelli come i cambiamenti nel tipo di cellula e nell’espressione genica quando si passa da vasi più grandi a più piccoli all’interno di un organo (lungo un raggio); e, (4) confrontare il tessuto allo stesso livello (ad esempio, capillari) in diversi organi (attraverso raggi).
Un organo, come il rene, ha decine di migliaia di vie vascolari se ogni capillare è considerato distintamente. Tuttavia, al fine di rendere fattibile la costruzione di un CCF, faremo un’ulteriore ipotesi di semplificazione che molti di questi percorsi sono indistinguibili l’uno dall’altro. In particolare, i vasi più piccoli (capillari) sono al centro delle piccole unità funzionali specializzate in ciascun organo (ad es., lobuli epatici nel fegato, glomeruli nel rene e alveoli nel polmone). Un intero organo richiede molte di queste unità funzionali centrate sui vasi che sono anatomicamente e fisiologicamente simili (11). Questa somiglianza può essere utilizzata per comprimere numerose vie vascolari in alcune rappresentative (Figura 2). In futuro, man mano che impareremo di più sui profili biomolecolari di questi percorsi, possiamo perfezionare il CCF suddividendo i percorsi in tutti i sottotipi che vengono scoperti.

Figura 2. Dispiegamento della via vascolare renale fino al livello delle singole cellule. Una via vascolare rappresentativa entra nel rene attraverso l’arteria renale, passa attraverso il glomerulo e restituisce la vena renale. Alla macroscala (a sinistra) e alla mesoscala (al centro), le etichette in scatole gialle sono strutture anatomiche che corrispondono a diversi vasi lungo questo ciclo. Al microscala (a destra), le etichette in scatole gialle sono diversi tipi di cellule che si trovano a breve distanza da una nave vicina nel glomerulo. La posizione delle singole celle può essere descritta dall’indirizzo della nave più vicina (ad es.,” RA0 “per glomerulo capillare), la distanza in micrometri o numero di cellule dal vaso endotelio e un angolo perpendicolare alla lunghezza del vaso (ad esempio,” RA0-10 µm-135° “o”RA0-1c-135°”). All’estrema destra, ogni vaso e il suo tessuto circostante sono stati estratti dall’immagine originale e allineati verticalmente per rendere più facile vedere come i tipi di cellule e la distribuzione cambiano lungo la via vascolare. In questo esempio, anche le immagini allineate sono state ruotate in modo che il centro del glomerulo sia sempre a destra. File sorgente: Le immagini del rene e del glomerulo sono adattate da Wikimedia Commons: https://commons.wikimedia.org/wiki/File:KidneyStructures_PioM.svg(licenza CC BY 3.0); e, https://commons.wikimedia.org/wiki/File:Renal_corpuscle-en.svg (licenza CC BY-SA 4.0).
Un “indirizzo” di una singola cellula in un sistema di coordinate vascolari ha quattro componenti. (1) Il primo è il vaso anatomicamente chiamato più vicino che identifica più precisamente un ciclo vascolare (il territorio vascolare o “spartiacque”), come l’arteria renale destra. (2) Il componente successivo rappresenta il livello di ramificazione della nave. Nel rene, esempi da prossimale a distale includono le arterie interlobari, le arterie corticali irradiate, le arteriole afferenti e i capillari glomerulari. Il livello di ramificazione può anche essere definito numericamente, con capillari a livello zero e livelli più alti con numeri più grandi. (3) Il terzo componente è la distanza perpendicolare in micrometri o numero di cellule dallo strato endoteliale della nave. (4) Un quarto componente opzionale potrebbe essere l’angolo di rotazione perpendicolare alla lunghezza della nave. Zero gradi possono essere definiti in molti modi a seconda dell’applicazione. Ad esempio, può essere relativo a un marcatore sul campione di tessuto, oppure può puntare verso una struttura anatomica, come il centro del glomerulo più vicino nel rene. L’utilità e la necessità di questi componenti dovrebbero essere confermate da test sperimentali.
Un altro approccio consiste nell’utilizzare le cellule endoteliali come “cellule di ancoraggio” per identificare le posizioni relative delle altre cellule in modo simile al GPS. L’endotelio riveste l’intera vascolarizzazione. Tipi distinti di cellule endoteliali (EC) compaiono in diverse parti del sistema vascolare, che possono essere rilevati istologicamente attraverso caratteristiche cellulari uniche e cellule vicine (“impronta istologica”), nonché attraverso l’analisi dei loro profili genetici specifici (“impronta genica di espressione”, Figura 1 mappa di calore) (9, 12, 13). Modello organizzativo vascolare, complessità ramificata, diametro, ecc. fornire ulteriori caratteristiche riconoscibili che formano una “impronta digitale dell’architettura vascolare” per ciascun tessuto (Figura 1 immagini fluorescenti a colori falsi) (10, 14). Ogni tessuto ha gradienti di ossigeno specifici, che possono essere utilizzati per determinare la distanza dalla nave. Quando PO2 non può essere misurato direttamente, si può dedurre la distanza cellulare dai gradienti di induzione / espressione dei geni inducibili dall’ipossia in vari tipi di cellule (“impronta digitale ipossia”, Figura 1 vista trasversale di un vaso) (15-17).
Benefici di un CCF vascolare
Un sistema di coordinate vascolari ha senso biologicamente. Ogni cellula vivente deve trovarsi entro un piccolo raggio del vaso sanguigno più vicino (da 100 µm a 1 mm, a seconda del tessuto) per ricevere ossigeno (18); e, ogni nave è rivestita dallo stesso strato continuo di endotelio (19). Così, il sistema vascolare forma un percorso ininterrotto che raggiunge tutte le parti del corpo, senza soluzione di continuità si assottiglia verso il basso attraverso scale, da macroscala (corpo intero/clinica) a mesoscala a microscala (vasi capillari a singola dimensione cellulare). Come parte di questo, gestisce la transizione graduale dalle grandi arterie e vene, che sono conservate nella maggior parte delle persone, fino ai milioni di vasi microscopici che sono riconoscibili per categoria (ad esempio, glomerulo capillare) ma non per nomi individuali. Il sistema vascolare si adatta alle dimensioni e alla forma del corpo individuale, tenendo conto delle variazioni interindividuali (20, 21). Definisce la forma delle unità funzionali in diversi organi, come lobuli epatici, glomeruli renali e alveoli polmonari. Lo sviluppo normale di nuovo tessuto inizia con la formazione di vasi prima che altri tipi di cellule possano crescere attorno ad esso (22).
Il sistema vascolare raggiunge anche tutti gli organi, i tessuti e le cellule in modo contiguo. Altre strutture anatomiche non sembrano avere una versatilità simile. Ad esempio, il sistema scheletrico si estende a tutto il corpo; tuttavia, la distanza da una cellula all’interno di un organo all’osso più vicino può essere di diversi centimetri e quell’osso è improbabile che faccia parte dell’organo e ancor meno probabile che faccia parte di un campione di tessuto. Il sistema nervoso segue molte delle stesse vie dei vasi più grandi investiti con proprietà contrattili, ma non è noto se si estendano per seguire i vasi più piccoli che raggiungono tutte le cellule dei tessuti. Pertanto, a differenza della dipendenza delle cellule dall’ossigeno, non esiste una garanzia che ogni cellula si trovi in prossimità di un nervo. I sistemi di riferimento organo-specifici si basano su caratteristiche strutturali uniche che esistono solo in quel singolo organo (ad esempio, regioni specifiche del cervello) ed è improbabile che siano utili per rappresentare le posizioni delle cellule altrove nel corpo.
Ci sono molti vantaggi pratici di un sistema di coordinate vascolari. Le vie vascolari in tutti gli organi sono state studiate ampiamente e sono descritte in letteratura in dettaglio. Sono utili, ben noti e hanno nomi standardizzati in molti domini di specialità. I modelli di vascolarizzazione tissutale sono usati clinicamente per diagnosticare la malattia; e, i vasi sono utilizzati in chirurgia e biopsie come i principali punti di riferimento anatomici e per definire “territori vascolari” (23, 24). Anche se la posizione esatta nello spazio cartesiano 3D potrebbe essere difficile da determinare per un campione di tessuto resecato, il chirurgo sarà in genere in grado di indicare quale spartiacque vascolare incluso il campione.
Limitazioni di un CCF vascolare
Solo conoscere le coppie di basi in una sequenza genomica non fornisce informazioni sufficienti per determinare come il DNA è piegato in una particolare cellula. Allo stesso modo, sebbene il sistema di coordinate vascolari dispiegato possa descrivere la relazione spaziale 3D delle cellule vicine alla microscala, i percorsi tortuosi che i vasi prendono e la distanza relativa tra le cellule a scale più grandi vengono persi. Le informazioni sulle strutture della più grande scala hanno potuto essere ottenute integrando la rappresentazione clinica ed il patterning istologico e molecolare.
Alcune informazioni posizionali aggiuntive vengono perse collassando le vie vascolari. Ad esempio, un sistema di coordinate vascolari potrebbe inizialmente trattare tutti i capillari glomerulari nel rene come la stessa struttura, potenzialmente mascherando le differenze nei glomeruli ai poli renali superiore e inferiore. Tuttavia, man mano che impariamo di più sui profili biomolecolari di questi percorsi, possiamo raffinare iterativamente il CCF vascolare nel tempo suddividendo i percorsi in qualsiasi sottotipi che vengono scoperti.
Nonostante queste limitazioni, un sistema di coordinate vascolari conserva abbastanza informazioni posizionali per rispondere a molti tipi di domande di ricerca, consentendo ai ricercatori di localizzare con precisione le singole cellule all’interno di unità funzionali, tessuti e organi, o confrontare gli effetti del contesto su vari tipi di cellule in tutto il corpo a macro e meso – scale.
Passi successivi e direzioni future
In Figura 1 presentiamo una rappresentazione altamente semplificata e stilizzata del CCF vascolare al fine di introdurre il concetto generale. Le attuali vie vascolari sono molto più complesse, con il CCF vascolare completo che alla fine consiste in centinaia o migliaia di strutture e modelli di ramificazione che non seguono un rigoroso layout hub-and-spoke. Ad esempio, le vene nel sistema portale epatico, che trasportano il sangue da più organi al fegato, e le anastomosi circolatorie, come il cerchio di Willis nel cervello, correrebbero perpendicolarmente e attraverserebbero i “raggi” in Figura 1.
Il CCF vascolare dovrà anche incorporare varianti anatomiche normali della vascolarizzazione, come la thyroidea ima e le doppie arterie cistiche, nello stesso modo in cui i polimorfismi a singolo nucleotide (SNPs) descrivono variazioni normali nel genoma. Mentre espandiamo e riempiamo i dettagli del CCF vascolare, potrebbe assumere un aspetto più fiocco di neve o simile al web, con probabilità assegnate a diverse sezioni per indicare la probabilità di trovarle in una determinata persona.
L’attuale CCF vascolare richiederà uno schema di codifica più sofisticato per la denominazione delle navi rispetto a quello mostrato in Figura 1, al fine di rappresentare la sua complessità in modo più accurato e renderlo “computabile” da algoritmi software. Un approccio consiste nel basarsi su ontologie anatomiche esistenti, come UBERON, che contiene già identificatori di risorse uniformi univoci (URI) per molte navi e definisce vari tipi di relazioni, come “branching_part_of”, per descrivere come le navi si connettono (25).
Una cella può essere vicina a più di una nave, nel qual caso è possibile assegnarle un indirizzo separato relativo a ciascuna nave. Sono necessarie ricerche future per determinare quale dovrebbe essere la distanza “cutoff” appropriata. Potrebbe essere consigliabile memorizzare più indirizzi per le celle per triangolare la loro posizione nello spazio 3D.
Sebbene la nostra motivazione iniziale per un CCF vascolare sia quella di definire un sistema di coordinate per specificare la posizione delle cellule, il nuovo layout radiale del corpo umano attorno al vascolare, come illustrato nella Figura 1, potrebbe avere altre applicazioni scientifiche. Ad esempio, le informazioni posizionali all’interno di questo quadro hanno analogie con lo sviluppo embriologico e potrebbero fornire informazioni sui meccanismi che causano malattie o disregolazioni che derivano da un gruppo di cellule. Ad esempio, nel CCF vascolare, le malattie macrovascolari associate al diabete di tipo 2 (ad esempio, cardiopatia ischemica, malattia vascolare periferica e malattia cerebrovascolare) sono raggruppate vicino al centro, mentre le malattie microvascolari (ad esempio, retinopatia, nefropatia e neuropatia) formano un anello intorno all’esterno (26).
Sommario
Il sistema vascolare ha diverse proprietà che rispondono alle caratteristiche precedentemente ritenute desiderabili per un CCF per consentire la mappatura di tutte le cellule del corpo umano (7). (1) Funziona su diverse scale. Attraverso un endotelio continuo fa una transizione senza soluzione di continuità da grandi strutture anatomiche fino al livello cellulare. (2) È applicabile a tutti i tessuti del corpo. Poiché gli organi si sviluppano attorno ai vasi, la vascolarizzazione incornicia l’architettura degli organi a tutte le scale. I modelli vascolari sono così distintivi che le immagini dei vasi da soli, con tutte le altre cellule rimosse, possono essere facilmente utilizzate per identificare l’organo. (3) Tiene conto delle differenze tra i donatori. La vascolarizzazione si adatta naturalmente alle variazioni individuali del tessuto, delle dimensioni e della forma del corpo. Invece di dover mappare le coordinate 3D di ciascun glomerulo in una persona a quelle di un’altra persona, il CCF vascolare posizionerebbe ogni cellula all’interno di un capillare glomerulare rappresentativo di ogni persona. (4) Il sistema vascolare è ben noto ai praticanti di molte specialità cliniche diverse, aiutando sia a diagnosticare la malattia che a guidare gli interventi chirurgici e utilizzato come punti di riferimento da patologi, radiologi e altri medici. Ciò faciliterebbe il posizionamento di campioni di tessuto nel corpo e la registrazione della posizione delle singole cellule. Mentre nessun singolo CCF è ideale per tutti i casi d’uso, un CCF vascolare definisce un sistema di coordinate naturale che renderebbe facile combinare dati biomolecolari da più persone e porre domande di ricerca biologicamente rilevanti.
Dichiarazione di disponibilità dei dati
I set di dati disponibili pubblicamente sono stati analizzati in questo studio. Questi dati possono essere trovati qui: https://www.proteinatlas.org.
Contributi dell’autore
GW ha concepito questo studio sulla base dei rapporti della riunione CCF 2017 e del Workshop CCF 2019. KB e YJ hanno fornito un feedback critico. GW ha scritto la bozza iniziale, con testo aggiuntivo trascritto dalla presentazione slide CCFWS-01. Tutti gli autori hanno contribuito alla modifica del manoscritto.
Finanziamento
Questa ricerca è stata sostenuta dal National Institutes of Health (NIH) award OT2OD026671. Questo lavoro non rappresenta l’opinione del NIH o del National Heart, Lung, and Blood Institute (NHLBI).
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbero essere interpretati come un potenziale conflitto di interessi.
Ringraziamenti
Ringraziamo la Dott. ssa Zorina S. Galis del National Institutes of Health per aver contribuito a sviluppare l’idea di un sistema di coordinate vascolare alla riunione CCF 2017 e al workshop CCF 2019, fornendoci presentazioni da questi eventi e partecipando a numerose discussioni che hanno costituito la base di questo manoscritto. I commenti degli esperti dei revisori hanno contribuito a chiarire e dettagliare il sistema di coordinate comune basato sui vasi proposto.
3. Uhlén M, Björling E, Agaton C, Szigyarto CA, Amini B, Andersen E, et al. Atlante proteico umano per tessuti normali e tumorali basato sulla proteomica anticorpale. Proteomica cellulare Mol. (2005) 4:1920–32. doi: 10.1074 / mcp.M500279-MCP200
PubMed Abstract | CrossRef Full Text/Google Scholar
12. Vanlandewijck M, He L, Mäe MA, Andrae J, Ando K, Del Gaudio F, et al. Un atlante molecolare di tipi di cellule e zonazione nel sistema vascolare cerebrale. Natura. (2018) 554:475–80. doi: 10.1038/nature25739
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Johnson C, Sung HJ, Lessner SM, Fini ME, Galis ZS. Matrix metalloproteinase-9 is required for adequate angiogenic revascularization of ischemic tissues: potential role in capillary branching. Circ Res. (2004) 94:262–8. doi: 10.1161/01.RES.0000111527.42357.62
PubMed Abstract | CrossRef Full Text | Google Scholar
15. De Santis V, Singer M. Tissue oxygen tension monitoring of organ perfusion: razionale, metodologie e revisione della letteratura. Br J Anaesth. (2015) 115:357–65. doi: 10.1093/bja/aev162
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Koch CJ. Misurazione dei livelli assoluti di ossigeno nelle cellule e nei tessuti mediante sensori di ossigeno e 2-nitroimidazolo EF5. Metodi Enzimolo. (2002) 352:3–31. doi: 10.1016/S0076-6879(02)52003-6
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Paruchuri V, Salhab KF, Kuzmik G, Gubernikoff G, Fang H, Rizzo JA, et al. Aortic size distribution in the general population: explaining the size paradox in aortic dissection. Cardiology. (2015) 131:265–72. doi: 10.1159/000381281
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Abadi E, Segars WP, Sturgeon GM, Roos JE, Ravin CE, Samei E. Modellazione dell’architettura polmonare nella serie XCAT di fantasmi: vie aeree, arterie e vene fisiologicamente basate. IEEE Trans Med Imaging. (2018) 37:693–702. doi: 10.1109 / TMI.2017.2769640
PubMed Abstract | CrossRef Full Text/Google Scholar
24. Majno P, Mentha G, Toso C, Morel P, Peitgen HO, Fasel JH. Anatomia del fegato: un profilo con tre livelli di complessità – un ulteriore passo verso resezioni epatiche territoriali su misura. J Epatolo. (2014) 60:654–62. doi: 10.1016/j.jhep.2013.10.026
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Cade WT. Diabetes-related microvascular and macrovascular diseases in the physical therapy setting. Phys Ther. (2008) 88:1322–35. doi: 10.2522/ptj.20080008
PubMed Abstract | CrossRef Full Text | Google Scholar