Il solvente universale
Il solvente universale
Questa è, naturalmente, un’altra proprietà chiave dell’acqua perché più sostanze si dissolvono in acqua rispetto a qualsiasi altro liquido comune. Questo perché la molecola d’acqua polare migliora ” Potere dissolvente.”La dissoluzione comporta la rottura di” sali “in ioni componenti.”Ad esempio, NaCl (sale comune) si rompe negli ioni Na+ e Cl – a causa dell’attrazione per gli ioni (atomi o gruppi di atomi con una carica) per le molecole d’acqua è alta.
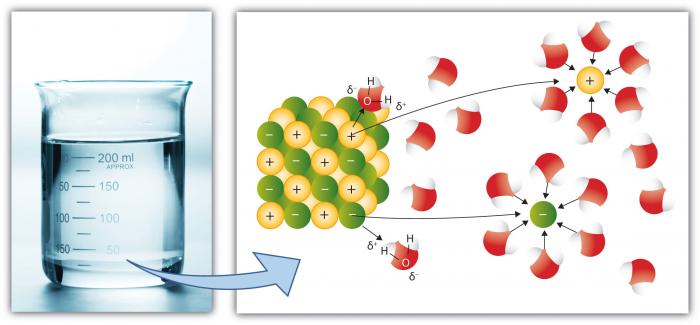
I cationi, come Na (Sodio) hanno una carica positiva netta, mentre gli anioni (come Cl, cloruro) hanno una carica negativa netta. Ci sono molti singoli elementi e composti che formano ioni. Pertanto, l’acqua può contenere concentrazioni considerevoli di varie specie chimiche a seconda delle loro particolari proprietà. Si noti come le molecole d’acqua circondano i singoli ioni, tenendoli isolati da altri ioni in soluzione. Ciò si verifica fino a quando la capacità dell’acqua di isolare gli ioni viene superata, a quel punto la soluzione è “satura” di quegli ioni e non può dissolversi di più (il sale inizierà a precipitare—formare un solido).