Refissa
Nome generico: tretinoina
Forma di dosaggio: crema
Medicamente recensito da Drugs.com. Ultimo aggiornamento aprile 1, 2020.
- Panoramica
- Effetti collaterali
- Dosaggio
- Professionale
- Interazioni
- Più
PER USO TOPICO SUL VISO SOLO.
- Refissa Descrizione
- Refissa – Farmacologia clinica
- Indicazioni e utilizzo per Refissa
- DATI degli STUDI CLINICI
- Controindicazioni
- Avvertenze
- Precauzioni
- Generale
- Informazioni per i pazienti
- interazioni Farmacologiche
- Carcinogenesi, mutagenesi, compromissione della fertilità
- Gravidanza
- Categoria di gravidanza C
- Madri che allattano
- Uso pediatrico
- Uso geriatrico
- Reazioni avverse
- Sovradosaggio
- Refissa Dosaggio e Amministrazione
- Come viene fornita Refissa
- Conservazione
- PANNELLO DI VISUALIZZAZIONE PRINCIPALE-Cartone tubo da 40 g
- di Più su Refissa (tretinoina topica)
- risorse per i Consumatori
- risorse Professionali
- Guide di trattamento correlate
Refissa Descrizione
Refissa , contiene il principio attivo tretinoina (un retinoide) in una base di crema emolliente. La tretinoina è una polvere cristallina giallo-arancio con un caratteristico odore floreale. La tretinoina è solubile in dimetilsolfossido, leggermente solubile in polietilenglicole 400, ottanolo e etanolo al 100%. È praticamente insolubile in acqua e olio minerale ed è insolubile in glicerina. Il nome chimico per tretinoina è (all-E)-3,7-dimethyl-9-(2,6,6-trimethyl-1-cyclonexen-1-yl)-2,4,6,8-nonatetraenoic acid. La tretinoina inoltre si riferisce a come acido tutto-trans-retinoico ed ha un peso molecolare di 300,44. La formula strutturale è rappresentata di seguito.
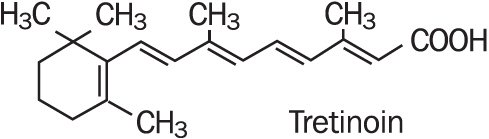
Refissa contiene tretinoina ad una concentrazione di 0.05% w/w in a water-in-oil emulsion formulation consisting of light mineral oil, sorbitol solution, hydroxyoctacosanyl hydroxystearate; methoxy PEG-22/dodecyl glycol copolymer, PEG-45/dodecyl glycol copolymer, stearoxytrimethylsilane and stearyl alcohol, dimethicone 50 cs, methylparaben, edetate disodium, propylparaben, butylated hydroxytoluene, citric acid monohydrate, and purified water.
Refissa – Farmacologia clinica
L’esatto meccanismo d’azione della tretinoina è sconosciuto, sebbene si creda che i retinoidi esercitino un effetto sulla crescita e sulla differenziazione di varie cellule epiteliali. Quando applicato localmente, tuttavia, non vi è stato alcun aumento osservato di desmosina, idrossiprolina o elastina mRNA nella pelle umana. Inoltre, il ruolo della natura irritativa di questo prodotto nell’effettuare gli effetti positivi attribuiti a questo prodotto per la sua indicazione non è stato ancora completamente determinato.
L’assorbimento transdermico della tretinoina da varie formulazioni topiche variava dall ‘ 1% al 31% della dose applicata, a seconda che fosse applicato sulla pelle sana o sulla pelle dermatitica. Quando l’assorbimento percutaneo di Tretinoina Crema, USP (emolliente) 0,05% è stato valutato in soggetti maschi sani (n=14) dopo una singola applicazione, così come dopo ripetute applicazioni giornaliere per 28 giorni, l’assorbimento di tretinoina era inferiore al 2% e le concentrazioni endogene di tretinoina e dei suoi principali metaboliti erano inalterate.
Indicazioni e utilizzo per Refissa
(Per comprendere appieno l’indicazione di questo prodotto, leggere l’intera sezione INDICAZIONI E UTILIZZO dell’etichettatura.)
Refissa è indicato come agente aggiuntivo (vedere il secondo punto in basso) per l’uso nella mitigazione (palliazione) di rughe sottili, iperpigmentazione screziata e rugosità tattile della pelle del viso in pazienti che non raggiungono tale palliazione utilizzando programmi completi per la cura della pelle e per evitare il sole (vedere il punto 3 per le popolazioni in cui l’efficacia non è stata stabilita). Refissa NON ELIMINA LE RUGHE, RIPARARE LA PELLE DANNEGGIATA DAL SOLE, INVERTIRE PHOTOAGING, o RIPRISTINARE UN MODELLO ISTOLOGICO DERMICO PIÙ GIOVANE o PIÙ GIOVANE. Molti pazienti ottengono effetti palliativi desiderati su rughe sottili, iperpigmentazione screziata e rugosità tattile della pelle del viso con l’uso di programmi completi per la cura della pelle e per evitare il sole, inclusi filtri solari, indumenti protettivi e creme emollienti NON contenenti tretinoina.
- Crema di tretinoina, USP (emolliente) 0.Lo 05% non ha dimostrato alcun EFFETTO ATTENUANTE sui segni significativi di esposizione cronica al sole come rughe grossolane o profonde, ingiallimento della pelle, lentiggini, telangiectasia, lassità cutanea, atipia cheratinocitica, atipia melanocitica o elastosi dermica.
- Refissa deve essere usato sotto controllo medico in aggiunta a un programma completo per la cura della pelle e per evitare il sole che include l’uso di filtri solari efficaci (SPF minimo di 15) e indumenti protettivi quando i risultati desiderati su rughe sottili, iperpigmentazione screziata e rugosità della pelle del viso non sono stati raggiunti con un programma completo per
- L’efficacia di Refissa nella mitigazione delle rughe sottili, dell’iperpigmentazione screziata e della rugosità tattile della pelle del viso non è stata stabilita in persone di età superiore ai 50 anni O in persone con pelle da moderatamente a pesantemente pigmentata. Inoltre, i pazienti con cheratosi attiniche visibili e i pazienti con una storia di cancro della pelle sono stati esclusi dagli studi clinici sulla crema di tretinoina, USP (emolliente) 0,05%. Pertanto l’efficacia e la sicurezza di Refissa in queste popolazioni non sono note al momento.
- Non è stata stabilita né la sicurezza né l’efficacia di Refissa per la prevenzione o il trattamento di cheratosi attiniche o neoplasie cutanee.
- Non sono state stabilite né la sicurezza né l’efficacia dell’uso quotidiano di Refissa per oltre 48 settimane e l’uso quotidiano oltre le 48 settimane non è stato studiato sistematicamente e istologicamente in studi adeguati e ben controllati. (Vedere la sezione AVVERTENZE.)
DATI degli STUDI CLINICI
Due adeguati e ben controllati studi sono stati condotti per un totale di 161 pazienti valutabili (al di sotto dei 50 anni di età) trattati con Tretinoin Cream USP) (Emolliente) 0.05% e del 154 valutabili i pazienti trattati con il veicolo emolliente crema sul viso per 24 settimane, in aggiunta ad una completa cura della pelle e di evitare il sole di programma, per valutare gli effetti delle belle rughe, screziato di iperpigmentazione, e tattili della rugosità. Patients were evaluated at baseline on a 10-point scale, and changes from that baseline rating were categorized as follows:
| No Improvement: | No change or an increase of 1 unit or more | |
| Minimal Improvement: | Reduction of 1 unit | |
| Moderate Improvement: | Riduzione di 2 o più elementi |
In questi studi, le rughe, screziato di iperpigmentazione, e ruvidità della pelle del viso sono stati pensato per essere causato da molteplici fattori che comprendeva intrinseca invecchiamento e fattori ambientali, croniche come l’esposizione al sole.
I risultati di queste valutazioni sono i seguenti:
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 36% | 40% | 24% |
| Vehicle + CSP | 62% | 30% | 8% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 35% | 27% | 38% |
| Vehicle + CSP | 53% | 21% | 27% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| * CSP= Comprehensive skin protection and sun avoidance programs included use of sunscreens, protective clothing, and emollient cream. | |||
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 49% | 35% | 16% |
| Veicoli + CSP | 67% | 23% | 10% |
la Maggior parte del miglioramento in questi segni è stato osservato durante le prime 24 settimane di terapia. Successivamente, la terapia ha mantenuto principalmente il miglioramento realizzato durante le prime 24 settimane.
La maggioranza dei pazienti perderà la maggior parte degli effetti attenuanti di Refissa sulle rughe sottili, sull’iperpigmentazione screziata e sulla rugosità tattile della pelle del viso con l’interruzione di un programma completo di cura della pelle e di prevenzione del sole incluso Refissa; tuttavia, la sicurezza e l’efficacia dell’uso quotidiano di Refissa per più di 48 settimane
Controindicazioni
Questo farmaco è controindicato in individui con una storia di reazioni di sensibilità a uno qualsiasi dei suoi componenti. Dovrebbe essere interrotto se si nota ipersensibilità a uno qualsiasi dei suoi ingredienti.
Avvertenze
- Refissa è un irritante cutaneo e non sono noti i risultati di un’irritazione della pelle continua per più di 48 settimane nell’uso cronico a lungo termine. Ci sono prove di cambiamenti atipici nei melanociti e cheratinociti e di un aumento dell’elastosi dermica in alcuni pazienti trattati con crema di tretinoina, USP (emolliente) 0,05% per più di 48 settimane. Il significato di questi risultati è sconosciuto.
- La sicurezza e l’efficacia di Refissa in individui con pelle moderatamente o fortemente pigmentata non sono state stabilite.
- Refissa non deve essere somministrato se il paziente assume anche farmaci noti per essere fotosensibilizzanti (ad es. tiazidici, tetracicline, fluorochinoloni, fenotiazine, sulfonamidi) a causa della possibilità di aumentata fototossicità.
A causa della maggiore sensibilità alla combustione, l’esposizione alla luce solare (comprese le lampade solari) deve essere evitata o ridotta al minimo durante l’uso di Refissa. I pazienti devono essere avvertiti di usare filtri solari (SPF minimo di 15) e indumenti protettivi quando usano Refissa. I pazienti con scottature devono essere avvisati di non usare Refissa fino al completo recupero. I pazienti che possono avere una notevole esposizione al sole, ad esempio a causa della loro occupazione e i pazienti con sensibilità intrinseca alla luce solare, devono prestare particolare attenzione quando usano Refissa e assicurarsi che siano osservate le precauzioni descritte nel foglietto illustrativo del paziente.
La crema di tretinoina, USP (emolliente) 0.05% deve essere tenuta fuori dagli occhi, dalla bocca, dagli angoli del naso e dalle mucose. L’uso topico può causare grave eritema locale, prurito, bruciore, bruciore e desquamazione nel sito di applicazione. Se il grado di irritazione locale lo giustifica, i pazienti devono essere indirizzati a usare meno farmaci, diminuire la frequenza di applicazione, interrompere temporaneamente l’uso o interrompere del tutto l’uso.
È stato riportato che la tretinoina causa grave irritazione sulla pelle eczematosa e deve essere usata solo con cautela nei pazienti con questa condizione.
L’applicazione di quantità maggiori di farmaci rispetto a quelle raccomandate non porterà a risultati più rapidi o migliori e potrebbero verificarsi arrossamenti, desquamazione o disagio marcati.
Precauzioni
Generale
Refissa deve essere utilizzato solo in aggiunta a un programma completo per la cura della pelle e per evitare il sole. (Vedere la sezione INDICAZIONI E UTILIZZO.)
Se si sviluppa una sensibilità al farmaco, un’irritazione chimica o una reazione avversa sistemica, l’uso di Refissa deve essere interrotto.
Gli estremi del tempo, come il vento o il freddo, possono essere più irritanti per i pazienti che usano Refissa.
Informazioni per i pazienti
Vedere il foglietto illustrativo del paziente.
interazioni Farmacologiche
Concomitante di farmaci topici, medicati o abrasivi, saponi, shampoo, detergenti, cosmetici, con un forte effetto di essiccazione, prodotti con alte concentrazioni di alcol, astringenti, spezie o di calce, permanente soluzioni di onda, l’elettrolisi, capelli prodotti per la depilazione o cere e prodotti che possono irritare la pelle deve essere usato con cautela nei pazienti in trattamento con Refissa perché possono aumentare l’irritazione con Refissa.
Refissa non deve essere somministrato se il paziente assume anche farmaci notoriamente fotosensibilizzanti (ad es., tiazidici, tetracicline, fluorochinoloni, fenotiazine, sulfonamidi) a causa della possibilità di fototossicità aumentata.
Carcinogenesi, mutagenesi, compromissione della fertilità
In uno studio dermico a vita in topi CD-1 a 100 e 200 volte la dose clinica topica umana raccomandata media, sono stati osservati alcuni tumori della pelle nei topi femmine e tumori del fegato nei topi maschi. Il significato biologico di questi risultati non è chiaro perché si sono verificati a dosi che hanno superato la dose massima tollerata dermica (MTD) di tretinoina e perché erano all’interno del tasso di occorrenza naturale di fondo per questi tumori in questo ceppo di topi. Non vi è stata evidenza di potenziale cancerogeno quando la tretinoina è stata somministrata per via topica ad una dose 5 volte la dose clinica topica media raccomandata nell’uomo. Ai fini del confronto tra l’esposizione animale e l’esposizione umana, la “dose clinica topica umana raccomandata” è definita come 500 mg di Refissa applicati giornalmente a una persona di 50 kg.
In un bioassay cronico di due anni di acido di vitamina A nei topi eseguito da Tsubura e Yamamoto, è stata riportata deposizione di amiloide generalizzata in tutti i gruppi nello strato basale della pelle trattata con vitamina A. Nei topi CD-1, uno studio simile ha riportato la ialinizzazione dei siti cutanei trattati e l’incidenza di questo risultato è stata di 0/50, 3/50 e 2/50 nei topi maschi e 1/50, 0/50, 4/50 e 2/50 nei topi femmine dai gruppi di controllo del veicolo, 0,25 mg/kg, 0,5 mg/kg e 1 mg/kg, rispettivamente.
Studi su topi albini glabri suggeriscono che la tretinoina può aumentare il potenziale tumorigeno delle dosi cancerogene di luce UVB e UVA da un simulatore solare. In altri studi, quando topi glabri leggermente pigmentati trattati con tretinoina sono stati esposti a dosi cancerogene di luce UVB, l’incidenza e il tasso di sviluppo di tumori cutanei sono stati ridotti o non è stato osservato alcun effetto. A causa di condizioni sperimentali significativamente diverse, al momento non è possibile un confronto rigoroso di questi dati disparati. Sebbene il significato di questi studi nell’uomo non sia chiaro, i pazienti devono ridurre al minimo l’esposizione al sole.
Il potenziale mutageno della tretinoina è stato valutato nel test Ames e nel test in vivo del micronucleo murino, entrambi negativi.
Studi dermici di segmento I e III con Tretinoina Crema, USP (emolliente) 0,05% non sono stati eseguiti in nessuna specie. In studi orali di segmento I e di segmento III in ratti con tretinoina, è stata osservata una diminuzione della sopravvivenza dei neonati e un ritardo della crescita a dosi superiori a 2 mg / kg / die (>400 volte la dose clinica topica media nell’uomo).
Gravidanza
Effetti teratogeni
Categoria di gravidanza C
La tretinoina ORALE ha dimostrato di essere teratogena in ratti, topi, conigli, criceti e primati subumani. È risultato teratogeno e fetotossico nei ratti quando somministrato per via orale o topica in dosi 1000 volte la dose clinica topica umana media raccomandata. Tuttavia, sono state riportate variazioni nelle dosi teratogene tra vari ceppi di ratti. Nella scimmia cynomolgus, che metabolicamente è più vicina all’uomo per la tretinoina rispetto alle altre specie esaminate, sono state riportate malformazioni fetali a dosi di 10 mg/kg/die o superiori, ma nessuna è stata osservata a 5 mg/kg/die (1000 volte la dose clinica topica umana raccomandata media), sebbene siano state osservate variazioni scheletriche aumentate a tutte le dosi. È stato riportato un aumento dose-correlato della mortalità embrionale e dell’aborto. Risultati simili sono stati riportati anche nei macachi pigtail.
La tretinoina topica nei test di teratogenicità animale ha generato risultati equivoci. Esiste evidenza di teratogenicità (coda accorciata o attorcigliata) della tretinoina topica nei ratti Wistar a dosi superiori a 1 mg/kg/die (200 volte la dose clinica topica raccomandata nell’uomo). Anomalie (omero: corto 13%, piegato 6%, os parietale incompleto ossificato 14%) sono state riportate anche quando 10 mg/kg/die è stato applicato per via cutanea.
Ci sono altri rapporti in conigli bianchi della Nuova Zelanda somministrati con dosi di circa 80 volte la dose clinica topica umana raccomandata di una maggiore incidenza di testa bombata e idrocefalia, tipica delle malformazioni fetali indotte da retinoidi in questa specie.
Al contrario, diversi studi su animali ben controllati hanno dimostrato che la tretinoina applicata per via cutanea non era teratogena, a dosi di 100 e 200 volte la dose clinica topica umana raccomandata, rispettivamente nei ratti e nei conigli.
Con l’uso diffuso di qualsiasi farmaco, un piccolo numero di segnalazioni di difetti alla nascita associati temporalmente alla somministrazione del farmaco sarebbe atteso per caso da solo. Trenta casi di malformazioni congenite temporalmente associate sono stati riportati durante due decenni di uso clinico di un’altra formulazione di tretinoina topica (Retin-A). Sebbene non sia stato stabilito alcun modello definito di teratogenicità e nessuna associazione casuale da questi casi, 5 dei rapporti descrivono la categoria di difetti alla nascita rari oloprosencefalia (difetti associati allo sviluppo incompleto della linea mediana del proencefalo). Il significato di queste segnalazioni spontanee in termini di rischio per il feto non è noto.
Effetti non teratogeni
La tretinoina dermica si è dimostrata fetotossica nei conigli quando somministrata in dosi 100 volte superiori alla dose clinica topica raccomandata nell’uomo. La tretinoina orale ha dimostrato di essere fetotossica nei ratti quando somministrata in dosi 500 volte superiori alla dose clinica umana topica raccomandata.
Non esistono tuttavia studi adeguati e ben controllati su donne in gravidanza. Refissa non deve essere usato durante la gravidanza.
Madri che allattano
Non è noto se questo farmaco sia escreto nel latte materno. Poiché molti farmaci sono escreti nel latte umano, si deve usare cautela quando Refissa viene somministrato a una donna che allatta.
Uso pediatrico
La sicurezza e l’efficacia nei pazienti di età inferiore ai 18 anni non sono state stabilite.
Uso geriatrico
La sicurezza e l’efficacia nei soggetti di età superiore ai 50 anni non sono state stabilite.
Reazioni avverse
(Vedere i paragrafi AVVERTENZE e PRECAUZIONI.)
In studi in doppio cieco, controllati con veicoli che hanno coinvolto 179 pazienti che hanno applicato la crema di tretinoina, USP (emolliente) 0,05% ai loro volti, le reazioni avverse associate all’uso della crema di Tretinoina, USP (emolliente) 0,05% sono state limitate principalmente alla pelle. Durante questi studi, il 4% dei pazienti ha dovuto interrompere l’uso di Tretinoina Crema, USP (emolliente) 0,05% a causa di reazioni avverse. Queste interruzioni erano dovute a irritazione cutanea o a reazioni avverse cutanee correlate.
Reazioni locali come desquamazione, pelle secca, bruciore, bruciore, eritema e prurito sono state riportate da quasi tutti i soggetti durante la terapia con Tretinoina Crema, USP (emolliente) 0,05%. Questi segni e sintomi erano generalmente di gravità da lieve a moderata e generalmente si manifestavano all ‘ inizio della terapia. Nella maggior parte dei pazienti la secchezza, desquamazione e arrossamento si ripresentavano dopo un declino iniziale (24 settimane).
Sovradosaggio
L’applicazione di quantità maggiori di farmaci rispetto a quelle raccomandate non ha dimostrato di portare a risultati più rapidi o migliori e possono verificarsi arrossamenti, desquamazione o disagio marcati. L’ingestione orale del farmaco può portare agli stessi effetti collaterali associati all’eccessiva assunzione orale di vitamina A.
Refissa Dosaggio e Amministrazione
- NON utilizzare Refissa se il paziente è in gravidanza o sta tentando di rimanere incinta o è ad alto rischio di gravidanza
- NON utilizzare Refissa se il paziente è bruciata dal sole o se il paziente ha eczema o di altra condizione cronica della pelle(s)
- NON utilizzare Refissa se il paziente è intrinsecamente sensibili alla luce del sole
- NON utilizzare Refissa se il paziente è anche l’assunzione di farmaci noti per essere fotosensibilizzanti (ad esempio, tiazidici, tetracicline, fluorochinoloni, fenotiazine, sulfamidici) a causa della possibilità di aumentata fototossicità.
I pazienti richiedono istruzioni dettagliate per ottenere i massimi benefici e per comprendere tutte le precauzioni necessarie per utilizzare questo prodotto con la massima sicurezza. Il medico deve esaminare il foglietto illustrativo del paziente.
Refissa deve essere applicato sul viso una volta al giorno prima di ritirarsi, usando solo abbastanza per coprire leggermente l’intera area interessata. I pazienti devono lavare delicatamente il viso con un sapone neutro, asciugare la pelle e attendere da 20 a 30 minuti prima di applicare Refissa. Il paziente deve applicare una quantità di crema di dimensioni di pisello per coprire leggermente l’intero viso. Prestare particolare attenzione quando si applica la crema per evitare gli occhi, le orecchie, le narici e la bocca.
L’applicazione di Refissa può causare una sensazione transitoria di calore o un leggero bruciore.
La mitigazione (palliazione) di rughe sottili facciali, iperpigmentazione screziata e rugosità tattile può verificarsi gradualmente nel corso della terapia. Fino a sei mesi di terapia possono essere necessari prima che gli effetti sono visti. La maggior parte del miglioramento osservato con Refissa è stato osservato durante le prime 24 settimane di terapia. Successivamente, la terapia mantiene principalmente il miglioramento realizzato durante le prime 24 settimane.
Con l’interruzione della terapia con Refissa, la maggior parte dei pazienti perderà la maggior parte degli effetti attenuanti di Refissa sulle rughe sottili, sull’iperpigmentazione screziata e sulla rugosità tattile della pelle del viso; tuttavia, la sicurezza e l’efficacia dell’uso quotidiano di Refissa per più di 48 settimane non sono state stabilite.
L’applicazione di quantità maggiori di farmaci rispetto a quelle raccomandate potrebbe non portare a risultati più rapidi o risultati migliori e potrebbero verificarsi arrossamenti, desquamazione o disagio marcati.
I pazienti trattati con Refissa possono usare cosmetici, ma le aree da trattare devono essere pulite accuratamente prima dell’applicazione del farmaco. (Vedere la sezione PRECAUZIONI.)
Come viene fornita Refissa
Refissa è disponibile in:
Tubi da 20 g NDC 42851-012-20
Tubi da 40 g NDC 42851-012-40
Conservazione
Conservare a 20-25°C (68-77°F). NON CONGELARE.
Solo Rx.
Stampato in USA
140904-0118
Prodotto da DPT Laboratories, San Antonio, TX 78215
Distribuito da ZO Skin Health, Inc., Irvine, CA 92618
Refissa®
PER USO TOPICO SOLO SUL VISO
Quali sono le informazioni più importanti su Refissa ?
Refissa è un farmaco serio. Non elimina le rughe o riparare la pelle danneggiata dal sole. Può aiutare a trattare le rughe sottili, lo scolorimento chiazzato e la pelle ruvida, ma non “cura” queste condizioni. Refissa deve essere utilizzato solo sotto la supervisione del vostro fornitore di assistenza sanitaria come parte di un ampio programma di cura della pelle. Questo programma dovrebbe includere evitare la luce solare diretta (utilizzando indumenti protettivi e filtri solari con un SPF minimo di 15) e l’utilizzo di altre creme idratanti per il viso che non contengono tretinoina.
Si dovrebbe usare Refissa solo al momento di coricarsi. Non utilizzare prodotti per la cura della pelle essiccati. Usi la più piccola quantità di Refissa necessaria ed eviti ottenerlo nei vostri occhi, orecchie, naso o bocca.
AVVERTENZA: Non usi Refissa in caso di gravidanza o di tentativo di gravidanza. Eviti la luce solare e qualsiasi altro medicinale che possa aumentare la sua sensibilità alla luce solare (vedere sotto).
Refissa non è stato studiato in persone di età superiore ai 50 anni o in persone con cute moderatamente o scura.
Che cos’è Refissa?
(Cosa posso aspettarmi da Refissa?)
Refissa è un farmaco serio che può aiutare a trattare ma non “curare” le rughe sottili, lo scolorimento della pelle chiazzata e la pelle ruvida.
Gli studi dimostrano che dopo 24 settimane, circa il 30% delle persone che hanno usato la crema Tretinoina, USP (emolliente) 0,05% per rughe sottili o scolorimento spotty ha avuto un miglioramento moderato, un altro 35% ha avuto un miglioramento minimo e il 35% non ha avuto alcun miglioramento. Circa il 16% delle persone che hanno usato la crema Tretinoina, USP (emolliente) 0,05% per la pelle ruvida ha avuto un miglioramento moderato, il 35% ha avuto un miglioramento minimo e il 49% non ha avuto alcun miglioramento. Non ci sono prove che Refissa tratti la pelle ruvida, le rughe profonde, la pelle ingiallita o altri problemi di cura della pelle.
Refissa deve essere usato come parte di un ampio programma di cura della pelle. Questo programma dovrebbe includere evitare la luce solare diretta (utilizzando indumenti protettivi e filtri solari con un SPF minimo di 15) e l’utilizzo di altre creme idratanti per il viso che non contengono tretinoina. Molte persone possono ottenere gli effetti desiderati utilizzando questo programma senza utilizzare Refissa. Non deve usare Refissa fino a quando non ha provato un ampio programma di trattamento della pelle senza Refissa.
Quando si utilizza Refissa, il miglioramento delle rughe sottili, dello scolorimento della pelle chiazzata e della pelle ruvida non è immediato e si verifica gradualmente nel tempo. Generalmente, si possono notare alcuni effetti in 3 a 4 mesi. Gli effetti sono solitamente più evidenti a circa 6 mesi con poco miglioramento aggiuntivo dopo quel tempo. Se Refissa viene fermato, il miglioramento diminuirà gradualmente.
La sicurezza dell’uso quotidiano di Refissa per più di 48 settimane non è stata stabilita.
Chi non dovrebbe usare Refissa?
Non deve usare Refissa se è scottato dal sole o molto sensibile al sole, se soffre di eczema o se la pelle è irritata. Refissa può causare un aumento dell’irritazione cutanea e una maggiore suscettibilità alle scottature.
Poiché Refissa può rendere la pelle più sensibile alla luce solare, deve informare il medico se sta usando anche altri medicinali che aumentano la sensibilità alla luce solare perché non deve usare Refissa con questi medicinali. Questi includono, ma non sono limitati a: tiazidici (usati per trattare la pressione alta), tetracicline, fluorochinolnes o sulfonamidi (usati per trattare l’infezione) e fenotiazine (usati per trattare gravi problemi emotivi). Se sta assumendo qualsiasi prescrizione di farmaci, farmaci non soggetti a prescrizione o utilizzando qualsiasi creme per il viso, verificare con un operatore sanitario per assicurarsi che non interagiscono con Refissa.
Avvertenza di gravidanza: non è stato dimostrato un uso sicuro durante la gravidanza. Ci sono segnalazioni di difetti alla nascita con animali da laboratorio e gli esseri umani che sono stati dati tretinoina per via orale. Non deve usare Refissa se è in stato di gravidanza o sta cercando di iniziare una gravidanza.
Non è noto se Refissa sia passato ai lattanti attraverso il latte materno. Non è stato dimostrato un uso sicuro nei bambini.
La sicurezza e l’efficacia di Refissa per le persone di età superiore ai 50 anni o con colorazione della pelle più scura non è stata dimostrata.
Come dovrei usare Refissa?
Si dovrebbe applicare Refissa al viso una volta al giorno prima di ritirarsi utilizzando solo abbastanza per coprire l’intera area interessata leggermente. Lavare delicatamente il viso con un sapone neutro, asciugare la pelle e attendere 20-30 minuti prima di applicare Refissa. Applicare una quantità di crema di dimensioni pisello per coprire tutto il viso. Si può sentire un calore o un leggero bruciore quando Refissa viene applicato per la prima volta.
È necessario prestare particolare attenzione quando si applica la crema per evitare gli occhi, le orecchie, le narici o la bocca. Refissa può causare gravi arrossamenti, prurito, bruciore, bruciore e desquamazione se applicato a queste aree.
L’uso di quantità maggiori del necessario di Refissa non accelera i risultati e può causare un sovradosaggio. Un sovradosaggio può causare pelle rossa e desquamazione, nonché qualche dolore o disagio.
È possibile utilizzare cosmetici dopo aver applicato Refissa. Assicurarsi di pulire accuratamente il viso prima di applicare nuovamente Refissa.
Cosa devo evitare durante l’utilizzo di Refissa?
Refissa aumenta la sensibilità alla luce solare. Evitare la luce solare il più possibile. Utilizzare indumenti protettivi e una crema solare con un SPF minimo di 15. Non prendere il sole o utilizzare lampade solari. Se sei sensibile alla luce solare o hai un lavoro che richiede di stare al sole per lunghi periodi, devi usare estrema cautela.
Durante l’utilizzo di Refissa, evitare qualsiasi prodotto che possa seccare o irritare la pelle. Ad esempio, evitare i prodotti applicati sulla pelle che contengono alcol, spezie o calce. Inoltre, evitare detergenti, depilazione o altri prodotti che possono irritare la pelle.
Quali sono i possibili effetti collaterali di Refissa?
Gli effetti indesiderati più comuni sono le reazioni cutanee. Prurito, rosso, e la pelle secca sono stati segnalati. Così hanno bruciore, bruciore e desquamazione della pelle. Questi sono più spesso lievi e sono più comuni quando viene iniziato il trattamento.
Come posso ottenere ulteriori informazioni?
Questo foglio riassume le informazioni più importanti su Refissa. Se desideri maggiori informazioni, parla con il tuo medico o altro fornitore di assistenza sanitaria. C’è anche un opuscolo scritto per gli operatori sanitari che il farmacista può fornire per voi.
CHIAMARE IL MEDICO PER UN CONSIGLIO MEDICO SUGLI EFFETTI COLLATERALI. È POSSIBILE SEGNALARE EFFETTI COLLATERALI ALLA FDA A 1-800-FDA-1088.
PANNELLO DI VISUALIZZAZIONE PRINCIPALE-Cartone tubo da 40 g
NDC 42851-012-40
117471-0118
Refissa ®
Crema di tretinoina,
USP (emolliente) 0.05%
Rx Only
NET WT 40 g
FDA APPROVED

| Refissa TRETINOIN (EMOLLIENT) tretinoin cream |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
Labeler – ZO Skin Health, Inc. (826468527)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| DPT Laboratories, Ltd. | 832224526 | manufacture(42851-012) | |
di Più su Refissa (tretinoina topica)
- Effetti Collaterali
- Durante la Gravidanza o l’Allattamento al seno
- il Dosaggio di Informazioni
- interazioni Farmacologiche
- Prezzi & Coupon
- Spagnolo
- classe di Droga: topici acne agenti
risorse per i Consumatori
- Informazioni Paziente
- Refissa Attualità (Avanzate di Lettura)
risorse Professionali
- la Prescrizione di Informazione;
- Tretinoin Gel di Microsfere (FDA)
Altre marche Retin-A Renova, Atralin, Altreno, … + 2 ulteriori
Guide di trattamento correlate
- Fotoinvecchiamento della pelle
Disclaimer medico