Trifenilfosfina
PPh3 è ampiamente usato nella sintesi organica. Le proprietà che guidano il suo utilizzo sono la sua nucleofilia e il suo carattere riducente. La nucleofilia di PPh3 è indicata dalla sua reattività verso gli alcheni elettrofili, come gli accettori di Michael e gli alogenuri alchilici. Viene anche usato nella sintesi di composti biarilici, come la reazione di Suzuki.
QuaternizationEdit
PPh3 si combina con alogenuri alchilici per dare sali di fosfonio. La struttura della reazione di quaternizzazione segue il solito schema per cui gli alogenuri benzilici e allilici sono reagenti particolarmente efficienti:
PPh3 + CH3I → + I –
Questi sali, che spesso possono essere isolati come solidi cristallini, reagiscono con basi forti per formare ylidi:
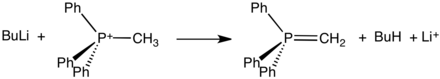
Tali ylidi sono reagenti chiave nelle reazioni di Wittig, utilizzati per convertire aldeidi e chetoni in alcheni.
Gli alogenuri arilici quaternizzano PPh3 per dare sali di tetrafenilfosfonio:
PPh3 + PhBr → Br
La reazione richiede tuttavia temperature elevate e catalizzatori metallici.
Reazione di Mitsunobuedit
Nella reazione di Mitsunobu, una miscela di trifenilfosfina e diisopropil azodicarbossilato (“DIAD”, o il suo analogo dietilico, MORTO) converte un alcool e un acido carbossilico in un estere. Il DIADE è ridotto in quanto funge da accettore di idrogeno e il PPh3 viene ossidato in OPPh3.
Reazione di Appeledit
Nella reazione di Appel, una miscela di PPh3 e CX4 (X = Cl, Br) viene utilizzata per convertire gli alcoli in alogenuri alchilici. L’ossido di trifenilfosfina (OPPh3) è un sottoprodotto.
PPh3 + CBr4 + RCH2OH → OPPh3 + RCH2Br + HCBr3
Questa reazione inizia con l’attacco nucleofilo di PPh3 su CBr4, un’estensione della reazione di quaternizzazione sopra elencata.
deossigenazionedit
La facile ossigenazione di PPh3 viene sfruttata nel suo uso per deossigenare i perossidi organici, che generalmente si verifica con il mantenimento della configurazione:
PPh3 + RO2H → OPPh3 + ROH (R = alchil)
È anche usato per la decomposizione di ozonidi organici a chetoni e aldeidi, sebbene il dimetil solfuro sia più popolare per la reazione come prodotto laterale, il dimetilsolfossido è più facilmente separato dalla miscela di reazione rispetto all’ossido di trifenilfosfina. Gli N-ossidi aromatici sono ridotti all’ammina corrispondente in alta resa a temperatura ambiente con irradiazione:

SulfonationEdit
Sulfonation di PPh3 dà tris(3-sulfophenyl)phosphine, P(C6H4-3-SO3−)3 (TPPTS), di solito isolato come il sale trisodico. A differenza di PPh3, TPPTS è solubile in acqua, così come i suoi derivati metallici. I complessi rodio di TPPT sono utilizzati in alcune reazioni di idroformilazione industriale.

Riduzione a difenilfosfidoedit
Litio in THF così come Na o K reagiscono con PPh3 per dare Ph2PM (M = Li, Na, K). Questi sali sono precursori versatili alle fosfine terziarie. Ad esempio, 1,2-dibromoetano e Ph2PM reagiscono per dare Ph2PCH2CH2PPh2. Acidi deboli come il cloruro di ammonio, convertono Ph2PM (M = Li, Na, K)in difenilfosfina:
(C6H5)2PM + H2O → (C6H5) 2PH + MOH
Complessi di metalli di transizione
La trifenilfosfina si lega bene alla maggior parte dei metalli di transizione, specialmente quelli nei metalli di transizione medio e tardivo dei gruppi 7-10. In termini di massa sterica, PPh3 ha un angolo di cono Tolman di 145°, che è intermedio tra quelli di P(C6H11)3 (170°) e P(CH3)3 (115°). In una prima applicazione nella catalisi omogenea, NiBr2(PPh3)2 è stato utilizzato da Walter Reppe per la sintesi di esteri di acrilato da alchini, monossido di carbonio e alcoli. L’uso di PPh3 è stato reso popolare dal suo uso nel catalizzatore di idroformilazione RhH (PPh3) 3 (CO).