Ureterolithiasis: non lasciando nulla di intentato
Messaggio urgente: I sintomi delle pietre nell’uretere possono imitare altre condizioni,creando un dilemma diagnostico in caso di urgenza. L’imaging è la chiave per una valutazione accurata e un trattamento appropriato.
WILLIAM GLUCKMAN, DO, MBA, FACEP e KATE ABERGER, MD
L’ureterolitiasi, che letteralmente si traduce in pietre nell’uretere, viene talvolta definita impropriamente come “calcoli renali”, che sono correttamente noti come nefrolitiasi. Sebbene le pietre si formino all’interno del rene, in genere non causano dolore acuto. L’ureterolitiasi può causare dolore estremo, disagio che a volte è considerato peggiore di quello sperimentato con il parto. Tale dolore è indicato come colica renale perché cere e diminuisce. Il dolore addominale e alla schiena associato all’ureterolitiasi a volte imita altre condizioni, rendendo i casi un dilemma diagnostico.
Epidemiologia
Sette per cento delle donne americane e il 12% degli uomini americani svilupperà pietre ad un certo momento della loro vita, e la prevalenza è in aumento in entrambi i sessi. L’incidenza è due volte più alta negli individui che hanno un membro della famiglia con pietre. Ogni anno negli Stati Uniti, 2 milioni di persone cercano un trattamento ambulatoriale per le pietre, che è un aumento del 40% dal 1994. In questo paese, i calcoli renali rappresentano l ‘ 1% dei ricoveri ospedalieri e expenditures 2,1 miliardi di spese sanitarie all’anno.
La maggior parte dei calcoli renali si verifica in pazienti di età compresa tra 20 e 49 anni, con l’età massima di insorgenza tra i 35 e i 45 anni. Un attacco iniziale di pietra in un paziente di età superiore ai 50 anni è insolito e raramente accade nei bambini fino a 16 anni. Il rapporto maschio-femmina è 3: 1. Le pietre dovute all’infezione (struvite) sono più comuni nelle donne e le donne hanno una maggiore incidenza di idronefrosi infetta. Asiatici e bianchi hanno un’incidenza di pietre molto maggiore rispetto agli afroamericani, agli africani e ai nativi americani. Il tasso di recidiva per i calcoli urinari è del 50% entro 5 anni e del 70% o superiore entro 10 anni.
Rischio
Le persone di basso status socioeconomico sono a minor rischio di ureterolitiasi rispetto a quelle di maggiore status socioeconomico. Le regioni meridionali e sud-occidentali degli Stati Uniti sono conosciute come “cintura di pietra” perché l’incidenza delle pietre è più alta che in altre aree del paese. Obesità, ipertensione e osteopenia sono condizioni associate al disturbo. La dieta svolge un ruolo significativo nell’incidenza delle pietre. Anche l’assunzione elevata di proteine animali e sale e la bassa assunzione di liquidi e calcio sono fattori che contribuiscono.
Tipi di pietra
Le quattro principali composizioni chimiche dei calcoli renali e la loro incidenza sono:
- Calcio (dal 75% all ‘80%)
- Struvite o fosfato di ammonio di magnesio (dal 10% al 15%)
- Acido urico (dal 6% al 9%)
- Cistina (dall’ 1% al 3%)
Il meccanismo principale della formazione di calcoli è la super saturazione. Questo è un cambiamento di fase in cui le lamelle disciolte si condensano in solidi. La sovrasaturazione dipende dall’equilibrio dei promotori (calcio e ossalato) e degli inibitori (magnesio e citrato) della cristallizzazione.
Le pietre di calcio sono le più comuni, comprendenti circa l ‘ 80% di tutti i casi di ureterolitiasi. Questi calcoli sono tipicamente composti da ossalato di calcio con un nucleo di fosfato di calcio, e le pietre fatte interamente di fosfato di calcio sono meno comuni. L’aspetto caratteristico delle pietre di calcio al microscopio è di una busta. Si formano in pazienti con basso volume di urina e alte concentrazioni di calcio e ossalato.
Probabilmente il fattore più importante nella formazione di calcoli è bassa assunzione di liquidi. A causa di ciò, il volume della produzione di urina è basso, che a sua volta produce alte concentrazioni di soluti formanti pietre-calcio e ossalato – nelle urine. L’ipercalciuria può derivare da un aumento dell’assunzione con la dieta o da un assorbimento di calcio iperattivo o da un eccesso di riassorbimento di calcio dalle ossa, come nell’iperparatiroidismo. L’ipercalciuria può anche essere correlata all’incapacità dei tubuli renali di assorbire il calcio nel filtrato glomerulare. Diminuzione dei livelli di magnesio e citrato-gli inibitori della formazione di calcoli-nel tratto urinario predispongono alla formazione di calcoli.
Una volta individuata l’eziologia dei calcoli di calcio di un paziente, il trattamento può essere adattato alla causa. La tendenza attuale NON è quella di limitare l’assunzione dietetica di calcio, specialmente nelle donne in postmenopausa. Molti studi hanno dimostrato che questo è inefficace e forse anche dannoso.
Le pietre di struvite sono associate a infezioni croniche del tratto urinario (UTI) causate da barre gram-negative. Questi batteri specifici sono in grado di dividere l’urea in ammonio, che poi si combina con fosfato e magnesio. I batteri usuali che fanno questo sono Proteus, Pseudomonas e Klebsiella. Escherichia coli non può dividere l’urea. Il pH delle urine di solito è maggiore di 7.
Per questi tipi di pietre, l’infezione non si risolverà fino a quando l’intera pietra non verrà rimossa. L’eziologia di base per le UTI croniche deve essere studiata.
I calcoli di acido urico sono associati a un basso pH (inferiore a 5,5) e livelli elevati di purine correlati all’elevata assunzione di carni di organi, pesce o legumi o a causa di malignità. Queste pietre sono associate alla gotta; il 25% dei pazienti con calcoli di acido urico soffre di gotta. Alcalinizzazione delle urine con bicarbonato di sodio o citrato (che viene convertito in bicarbonato di sodio) è il pilastro della terapia, oltre a garantire un’adeguata idratazione. Nei pazienti con alti livelli sierici di acido urico, l’allopurinolo è utile per abbassare i livelli sierici e aiutare a prevenire la formazione di calcoli, ma non dissolverà una pietra già formata.
I calcoli di cistina, che sono il tipo più raro, derivano da un difetto metabolico intrinseco che provoca il fallimento dei reni di riassorbire cisteina, ornitina, lisina e arginina. L’urina viene quindi sovrasatura e si formano pietre. Dieta, leganti e agenti alcalinizzanti possono essere utilizzati per il trattamento.
Le pietre si formano tipicamente nel rene e quindi entrano nell’uretere. Alcune pietre passano e non causano mai disagio, mentre altre si bloccano nell’uretere o iniziano a sfregare contro l’uretere durante il movimento, innescando dolore. Come risultato del” trauma ” all’uretere, i pazienti con pietre hanno spesso sangue nelle urine, che può variare da ematuria microscopica a grossolana.
Work-Up per la pietra sospetta
Il primo passo nel work-up per la pietra sospetta in ambiente di cure urgenti è un’analisi delle urine astina per valutare la presenza di sangue, leucociti, chetoni e nitriti. La chetosi di fronte al vomito dovrebbe giustificare l’idratazione del fluido per via endovenosa (IV) e anche la prova dell’infezione dovrebbe essere affrontata. Determinare se l’infezione è l’unica causa del dolore del paziente o si presenta in combinazione con una pietra non è sempre facile.
La microscopia è utile per identificare la presenza di cristalli, che possono aiutare a supportare ulteriormente una diagnosi di pietra rispetto ad altre cause di disturbi urinari, e una coltura di urina può escludere o escludere la presenza di infezione batterica. Non sono richiesti test di funzionalità renale sierici di routine, ma devono essere presi in considerazione per i pazienti che hanno una storia di malattia renale o hanno o nei quali si sospetta idronefrosi significativa.
L’imaging radiografico (raggi X, tomografia computerizzata , ultrasuoni ) è molto utile nella valutazione delle pietre, come descritto nella prossima sezione di questo articolo. L’analisi della pietra può essere utile per determinare la composizione della pietra, che può aiutare a determinare le misure preventive. I pazienti che vengono trattati a casa dovrebbero ricevere un colino e chiedere di restituire una pietra che passano, se possibile.
Imaging per pietre
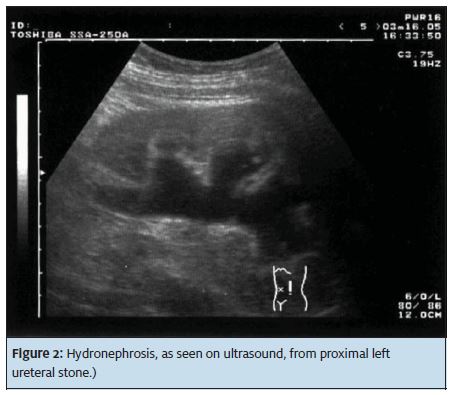
Poiché l ‘ 80% delle pietre è a base di calcio e radiopaco, l’imaging a raggi X è utile per la diagnosi. Una scansione TC non contrastata dell’addome e del bacino (Figura 1) ha una sensibilità dal 95% al 100% e una specificità dal 95% al 98% ed è il nostro esame iniziale preferito perché fornisce tutte le importanti informazioni di gestione iniziale: Posizione della pietra, dimensione, numero (peso della pietra) ed estensione dell’idronefrosi, se presente. L’imaging U/S è limitato perché non dimostra l’esatta posizione della pietra al di fuori del rene e la qualità dell’immagine può essere influenzata dall’obesità e dall’eccessivo gas intestinale. U / S (Figura 2) ha il vantaggio di non utilizzare radiazioni ionizzanti, che è una considerazione in donne in gravidanza, giovani femmine e pazienti con calcoli ricorrenti che potrebbero aver avuto diverse scansioni TC in passato.
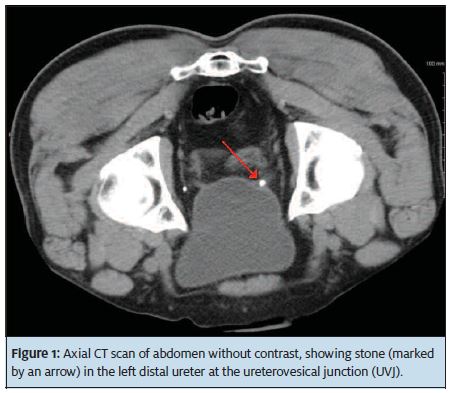
Anche l’uso di scansioni TC a bassissima dose, che forniscono quasi la metà della dose di radiazioni delle scansioni TC tipiche, è in aumento. Su queste scansioni, gli organi hanno un aspetto più” granuloso ” perché il dettaglio è ridotto, ma dimostrano ancora molto bene le pietre.
Una radiografia addominale della “piastra piana dell’addome” (KUB) può essere utile nell’impostazione di emergenza per lo screening perché la TAC e la U / S potrebbero non essere facilmente disponibili. Un KUB può anche essere usato per schermare i pazienti con una storia nota di calcoli renali radiopachi. Prima dell’avvento e della tecnologia avanzata di scansione CT e U/S, plan KUB e pielogrammi per via endovenosa, in cui è stato iniettato il contrasto IV e sono stati prelevati una serie di film plain addominali, sono state le principali modalità diagnostiche. Un KUB ha una sensibilità di circa il 50% e una sensibilità di circa il 75%, quindi un KUB negativo non esclude una pietra. Anche un KUB non mostra idronefrosi lieve o moderata, sebbene possa dimostrare una grave idronefrosi.
Gestione con farmaci
Il trattamento iniziale di emergenza della colica renale è la gestione del dolore. Intramuscluar (IM), o meglio ancora IV, ketorolac è un tipico farmaco iniziale. L’effetto non steroideo ha dimostrato di prevenire lo spasmo ureterale e quindi fornire un ottimo sollievo dal dolore. Gli oppiacei sono spesso necessari per controllare il dolore della colica renale. IM o IV morfina o idromorfina sono buone scelte. Se un paziente non vomita e può tollerare farmaci per via orale, un farmaco antinfiammatorio non steroideo, come naprossene o ketorolac intranasale insieme a ossimorfina orale o ossicodone/APA per il dolore intenso è un buon inizio. Incoraggiare il paziente a bere molti liquidi come acqua (con limone) e Gatorade è anche importante. Nausea e vomito possono essere gestiti con metoclopramide o ondansetron per via parenterale, se necessario inizialmente, e poi per via orale.
Esiste letteratura a supporto dell’uso di alfa bloccanti, in particolare tamsulosina, somministrata giornalmente a 0,4 mg. Il pensiero è che, poiché gli ureteri distali contengono recettori alfa, il trattamento con farmaci può produrre una dilatazione sufficiente per consentire il passaggio di più pietre che raggiungono la giunzione ureterovesical.
Bandiere rosse nella gestione
Le pietre ureterali di fronte all’infezione sono potenzialmente problematiche. Un’infezione può essere difficile da eliminare solo con antibiotici senza affrontare la pietra. I pazienti che sono febbrili e hanno brividi devono essere valutati per l’infezione.
Gestione definitiva
In circa l ‘ 80% dei pazienti i cui calcoli sono piccoli (cioè < 4 mm) tipicamente, i calcoli passeranno spontaneamente. Le pietre più grandi di 4 mm spesso richiedono un intervento chirurgico come l’ureteroscopia e la rimozione con o senza posizionamento dello stent. I pazienti con calcoli > 4 mm con o senza idronefrosi devono essere indirizzati a un urologo entro pochi giorni e prima se il loro dolore è difficile da controllare.
La litotripsia extracorporea ad onde d’urto (ESWL) è un’altra procedura utilizzata per trattare i calcoli renali e ureterali prossimali. Un’onda d’urto focalizzata viene generata e mirata alla pietra, essenzialmente polverizzando in frammenti più piccoli che vengono poi passati facilmente nelle urine. I vantaggi di ESWL includono generalmente meno tempo di anestesia e meno rischio di danno ureterale. L’ESWL è considerato un trattamento di prima linea e può essere vantaggioso per i pazienti in cui la gestione in attesa e il dolore inaspettato possono essere problematici, come piloti e chirurghi. Anche i pazienti con rene unico o quelli a rischio più elevato a causa di tempi di anestesia più lunghi possono trarre beneficio da ESWL.
Criteri di ammissione
Non sono stati stabiliti criteri definiti di laboratorio o radiografici per l’ammissione di pazienti con calcoli. Il giudizio clinico dovrebbe essere usato per determinare, ma le seguenti situazioni dovrebbero indurre l’ammissione:
- ostruzione Ureterale in solitaria o trapiantati di rene
- ostruzione Ureterale associati con grave idronefrosi e/o infetti idronefrosi
- Persistente vomito e incapacità di tollerare fluidi orali o farmaci per il dolore
- il Dolore non controllato dall’gli analgesici orali
- Acuta elevazione BUN/creatinina o peggioramento di patologie insufficienza renale
Conclusione
Ureterolithiasis è una comune causa di fianco e dolore addominale. L’obiettivo è quello di governare le nostre altre cause potenzialmente letali di dolore come aneurisma aortico addominale, appendicite e diverticolite e controllare il dolore del paziente. Utilizzare una modalità di imaging diagnostico precoce per solidificare la diagnosi e determinare se il paziente richiede un rinvio urologico e un intervento di attesa vigile e terapia conservativa.
Bibliografia
- Berrington de Gonzalez A, Mahesh M, Kim P, et al. Rischi di cancro proiettati da scansioni tomografiche calcolate eseguite negli Stati Uniti nel 2007. Arch Stagista Med, 2009; 169(22): 2071-2077.
- Ciaschini MW, Remer EM, Baker ME, et al. Calcoli urinari: riduzione della dose di radiazioni del 50% e del 75% alla TC – effetto sulla sensibilità. Radiologico. 2009; 251(1): 105-111.
- Dellabella M, Milanese G, Muzzonigro G. Efficacia della tamsulosina nella gestione medica dei calcoli ureterali juxtavesici. J Urol. 2003; 170 (6 Pt 1): 2202-2205
- Sala PM. Neprolitiasi: trattamento, cause e prevenzione. Cleveland Clinic Journal of Medicine. 2009; 76(10): 583-591.
- Kluner C, Hein PA, Gralla O, et al. La TC a bassissima dose con una dose di radiazioni equivalente a quella di KUB è sufficiente per rilevare calcoli renali e ureterali? J Comput Assistere Tomogr. 2006; 30(1): 44-50.
- Miller JC. CT e problemi di sicurezza delle radiazioni. Radiologia. 2010; 8(3)
- Consiglio Nazionale per la radioprotezione e la misurazione (2009). Rapporto n. 160-Esposizione alle radiazioni ionizzanti della popolazione degli Stati Uniti. www.ncrponline.org
- Paulson EK, Weaver C, Ho LM, et al. Dose di radiazioni convenzionale e ridotta di 16-MDCT per il rilevamento di nefrolitiasi e ureterolitiasi. AJR Am J Roentgenol. 2008; 190(1): 151-157.
- Smith-Bindman R, Lipson J, Marcus R, et al. Dose di radiazioni associata a esami comuni di tomografia computerizzata e al rischio associato di cancro per l’attributo della vita. Arch Stagista Med. 2009; 169(22): 2078-2086.
- Soto JA. Calcoli ureterali e renali. In: Sahani DV, Samir AE, eds. Imaging addominale. Maryland Heights, MO: Elsevier; 2010; 1: 185-189.
- Wasserstein AG. Nefrolitiasi. Am J Rene Dis. 2005; 45(2): 422-428.
- Wen CC, Coyle TL, Jerde TJ, Nakada SY. Ketorolac inibisce efficacemente la contrattilità ureterale in vitro. J Endourol. 2008; 22(4): 739-742.
- Lupo SJ Jr., Campi BF. Nefrolitiasi. Medscape. emedicine.medscape.com, emedicine.medscape.com/article/437096overview#aw2aab6b2b4aa. Aggiornato il 16 giugno 2011. Accesso al 23 gennaio 3012.
- Lupo SJ Jr., Campi BF. Trattamento e gestione della nefrolitiasi. Medscape. http://emedicine.medscape.com/article/437096-treatment. Aggiornato il 23 gennaio 2012. Accesso al 9 febbraio 2010.
Worcester E. Malattia renale. J Clin Investire. 2005; 115(10): 2598-2608
