VoLumen
Nome generico: solfato di bario
Forma di dosaggio: sospensione orale
Medicamente recensito da Drugs.com. Ultimo aggiornamento il 1 ° ottobre 2020.
- Panoramica
- Effetti Collaterali
- Dosaggio
- Professional
- Gravidanza
- Più
Disclaimer: Questo farmaco non è stato trovato dalla FDA per essere sicuro ed efficace, e questo etichettatura non è stato approvato dalla FDA. Per ulteriori informazioni sui farmaci non approvati, clicca qui.
- VoLumen Descrizione
- FARMACOLOGIA CLINICA
- INDICAZIONI E UTILIZZO
- Controindicazioni
- Avvertenze
- Precauzioni
- Generale
- Informazioni per i pazienti
- Interazioni farmacologiche
- Uso in gravidanza
- Le madri che allattano
- REAZIONI AVVERSE
- REAZIONI ALLERGICHE
- Sovradosaggio
- DOSAGGIO E SOMMINISTRAZIONE
- Per somministrazione orale: Marcatura del tratto gastrointestinale
- Stoccaggio
- Come viene fornito VoLumen
- More about Volumen (barium sulfate)
- risorse per i Consumatori
- risorse Professionali
- Guide di trattamento correlate
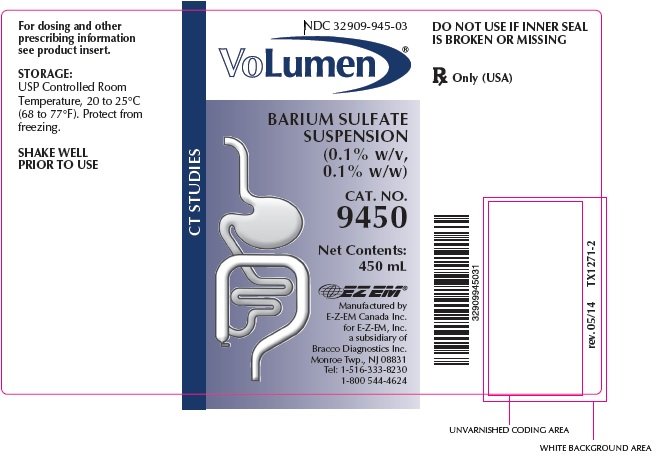
VoLumen Descrizione
VoLumen® è una sospensione di solfato di bario 0,1% p/v, 0,1% p / p per somministrazione orale. Ogni 100 mL contiene 0,1 g di solfato di bario. Il solfato di bario, dovuto la sua alta densità molecolare è opaco ai raggi X e quindi, funge da agente di contrasto positivo per gli studi radiografici. Il principio attivo è solfato di bario e la sua formula strutturale è BaSO4. Il solfato di bario si presenta come una polvere fine, bianca, inodore, insapore, ingombrante che è priva di grittiness. Le sue sospensioni acquose sono neutre al tornasole. È praticamente insolubile in acqua, soluzioni di acidi e alcali e solventi organici.
Ingredienti inattivi: acido citrico, gomma naturale, acido benzoico, citrato di sodio, aroma naturale e artificiale di mirtillo, sorbato di potassio, acqua purificata, saccarina sodica, emulsione di simeticone, benzoato di sodio e sorbitolo.
FARMACOLOGIA CLINICA
Il solfato di bario, a causa della sua elevata densità molecolare è opaco ai raggi X e, quindi, agisce come agente di contrasto positivo per gli studi radiografici. Il solfato di bario è biologicamente inerte e, quindi, non viene assorbito o metabolizzato dall’organismo e viene eliminato dal tratto GASTROINTESTINALE invariato.
INDICAZIONI E UTILIZZO
Per l’uso nella tomografia computerizzata per opacizzare il tratto gastrointestinale.
Controindicazioni
Questo prodotto non deve essere usato in pazienti con perforazione gastrointestinale nota o sospetta o ipersensibilità al solfato di bario o a qualsiasi componente di questa formulazione di solfato di bario.
Avvertenze
Raramente sono state riportate gravi reazioni allergiche di natura anafilattoide in seguito alla somministrazione di agenti di contrasto con solfato di bario. Personale e strutture adeguatamente formati devono essere disponibili per il trattamento di emergenza di reazioni gravi e devono rimanere disponibili per almeno 30-60 minuti dopo la somministrazione, poiché possono verificarsi reazioni ritardate.
Precauzioni
Generale
Le procedure diagnostiche che comportano l’uso di mezzi di contrasto radiopachi devono essere eseguite sotto la direzione di personale con la formazione necessaria e con una conoscenza approfondita della particolare procedura da eseguire. Una storia di asma bronchiale, atopia, come evidenziato dalla febbre da fieno e dall’eczema, o una precedente reazione a un agente di contrasto, meritano un’attenzione speciale. Si deve usare cautela con l’uso di mezzi radiopachi nei pazienti gravemente debilitati e in quelli con ipertensione marcata o malattia cardiaca avanzata. L’ingestione di bario non è raccomandata in pazienti con una storia di aspirazione alimentare. Se sono necessari studi sul bario in questi pazienti o in pazienti in cui l ‘ integrità del meccanismo di deglutizione non è nota, procedere con cautela. Se il bario viene aspirato nella laringe, l’ulteriore somministrazione deve essere immediatamente interrotta.
Informazioni per i pazienti
Prima della somministrazione di questo prodotto, le pazienti che ricevono agenti diagnostici con solfato di bario devono essere istruite a:
- Informare il proprio medico in caso di gravidanza.
- Informare il proprio medico se sono allergici a qualsiasi farmaco o cibo, o se hanno avuto reazioni precedenti a prodotti di solfato di bario o altri agenti di contrasto utilizzati nelle procedure a raggi X (vedere PRECAUZIONI generali).
- Informare il proprio medico su eventuali altri farmaci che stanno attualmente assumendo.
- Consultare immediatamente un medico se si verificano una reazione allergica dopo l’uso di questo prodotto.
Interazioni farmacologiche
La presenza di formulazioni di solfato di bario nel tratto gastrointestinale può alterare l’assorbimento degli agenti terapeutici assunti in concomitanza. Al fine di ridurre al minimo qualsiasi potenziale cambiamento nell’assorbimento, deve essere presa in considerazione la somministrazione separata di solfato di bario da quella di altri agenti.
Uso in gravidanza
È noto che le radiazioni causano danni al feto non ancora nato esposto in utero. Pertanto, le procedure radiografiche devono essere utilizzate solo quando, a giudizio del medico, il suo uso è ritenuto essenziale per il benessere della paziente incinta.
Le madri che allattano
I prodotti con solfato di bario possono essere utilizzati durante l’allattamento.
REAZIONI AVVERSE
Le reazioni avverse, come nausea, vomito, diarrea e crampi addominali, che accompagnano l’uso di formulazioni di solfato di bario sono rare e di solito lievi. Si sono verificate reazioni gravi (circa 1 su 1.000.000) e decessi (circa 1 su 10.000.000). Le complicazioni procedurali sono rare, ma possono includere polmonite da aspirazione, formazione di granulomi, intravasazione, embolizzazione e peritonite dopo perforazione intestinale, episodi vasovagali e sincopali e decessi.
REAZIONI ALLERGICHE
A causa della maggiore probabilità di reazioni allergiche nei pazienti atopici, è importante che una storia completa di allergie note e sospette, nonché sintomi di tipo allergico, ad esempio, rinite, asma bronchiale, eczema e orticaria, essere ottenuto prima di qualsiasi procedura medica utilizzando questi prodotti. Una lieve reazione allergica molto probabilmente includerebbe prurito generalizzato, eritema o orticaria (circa 1 su 250.000). Tali reazioni generalmente rispondono ad un antistaminico come 50 mg di difenidramina o il suo equivalente. Nelle reazioni più rare e più gravi (circa 1 su 1.000.000) si possono sviluppare edema laringeo, broncospasmo o ipotensione. Le reazioni gravi che possono richiedere misure di emergenza sono spesso caratterizzate da vasodilatazione periferica, ipotensione, tachicardia riflessa, dispnea, agitazione, confusione e cianosi, progredendo fino allo stato di incoscienza. Il trattamento deve essere iniziato immediatamente con 0,3-0,5 cc di 1:1000 epinefrina per via sottocutanea. Se predomina il broncospasmo, devono essere somministrati lentamente da 0,25 a 0,50 grammi di aminofillina endovenosa. Potrebbero essere necessari vasopressori appropriati. Gli adrenocorticosteroidi, anche se somministrati per via endovenosa, non esercitano alcun effetto significativo sulle reazioni allergiche acute per alcune ore. La somministrazione di questi agenti non deve essere considerata come misure di emergenza per il trattamento delle reazioni allergiche. I pazienti in apprensione possono sviluppare debolezza, pallore, tinnito, diaforesi e bradicardia dopo la somministrazione di qualsiasi agente diagnostico. Tali reazioni sono solitamente di natura non allergica e sono trattate al meglio avendo il paziente disteso per altri 10-30 minuti sotto osservazione.
Sovradosaggio
In rare occasioni dopo somministrazione ripetuta, possono verificarsi gravi crampi allo stomaco, nausea, vomito, diarrea o stitichezza. Queste risposte indicate possono essere presenti sia nelle procedure fluoroscopiche che CT. Questi sono di natura transitoria e non sono considerati gravi. I sintomi possono essere trattati secondo gli standard attualmente accettati di assistenza medica.
DOSAGGIO E SOMMINISTRAZIONE
Il volume della sospensione di solfato di bario CT da somministrare dipenderà dal grado e dall’entità del contrasto richiesto nell’area o nelle aree esaminate e dalla tecnica utilizzata.
Per somministrazione orale: Marcatura del tratto gastrointestinale
Il paziente deve iniziare a bere VoLumen® circa 20 – 30 minuti prima della procedura programmata. Si raccomanda che il paziente consumare più bottiglie, circa 900 mL a 1.350 ml di volume totale prima dell’esame o utilizzare come indicato dal medico. Per una migliore marcatura gastrica, il paziente deve consumare i 200 ml finali immediatamente prima della scansione. La marcatura intestinale è coerente a causa dell’uniformità della concentrazione dello 0,1% di BaSO4. La marcatura del lume intestinale può essere migliorata aumentando il volume di VoLumen® consumato (vedi sotto). Altri regimi posologici possono essere seguiti a seconda dei casi. Nei pazienti in cui la marcatura è problematica, come l’obesità e il transito ritardato, è possibile migliorare la marcatura aumentando il volume totale di VoLumen® somministrato fino a 1.800 mL o quattro (4) flaconi.
Stoccaggio
USP Temperatura ambiente controllata, da 20 a 25°C (da 68 a 77°F). Proteggere dal congelamento.
Come viene fornito VoLumen
VoLumen® viene fornito nella seguente quantità: flaconi da 450 mL,
Cat. No. 9450, NDC 32909-945-03
Solo Rx (USA)
AGITARE BENE PRIMA DELL’USO
In attesa di brevetto
Prodotto da
E-Z-EM Canada Inc.
per E-Z-EM, Inc.
una filiale di Bracco Diagnostics Inc.
Monroe Township, NJ 08831
Tel: 1-516-333-8230 1-800 544-4624
rev. 05/14 TX1272-3 ©2006 E-Z-EM, Inc.
Sospensione di solfato di VoLumen – Bario
NDC: 32909-945-03
| VoLumen barium sulfate suspension |
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
Labeler – E-Z-EM Canada Per maggiori informazioni, consultare il sito
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| E-Z-EM Canada Inc | 204211163 | PACK(32909-945), ANALYSIS(32909-945), LABEL(32909-945), MANUFACTURE(32909-945) | |
More about Volumen (barium sulfate)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Pricing & Coupon
- Spagnolo
- 1 Recensione
- classe di Droga: non iodati mezzi di contrasto
risorse per i Consumatori
- Avanzate di Lettura
risorse Professionali
- la Prescrizione di Informazione;
Altre marche NeuLumEX, Liquido-Z Paque, HD 200 Plus, Entrobar, … + 30 più
Guide di trattamento correlate
- Tomografia computerizzata
Disclaimer medico