Label: MEGACE ES-megestrolacetaat suspensie
klinische farmacologie
Er zijn verschillende analysemethoden gebruikt om de plasmaconcentraties van megestrolacetaat te schatten, waaronder gaschromatografie-massa fragmentografie (GC-MF), hogedrukvloeistofchromatografie (HPLC) en radioimmunoassay (RIA). De GC-MF en HPLC methoden zijn specifiek voor megestrolacetaat en opbrengst equivalente concentraties. De Ria-methode reageert op megestrolacetaat-metabolieten en is daarom niet-specifiek en wijst op hogere concentraties dan de GC-MF-en HPLC-methoden. Plasmaconcentraties zijn afhankelijk, niet alleen van de gebruikte methode, maar ook van intestinale en leverinactivatie van het geneesmiddel, die kunnen worden beïnvloed door factoren zoals de beweeglijkheid van het darmkanaal, darmbacteriën, toegediende antibiotica, lichaamsgewicht, dieet en leverfunctie.
werkingsmechanisme
verschillende onderzoekers hebben melding gemaakt van de eetlustverhogende eigenschap van megestrolacetaat en het mogelijke gebruik ervan bij cachexie. Het precieze mechanisme waardoor megestrolacetaat effecten in anorexia en cachexia veroorzaakt is op dit moment onbekend.
Farmacokinetische eigenschappen:
plasmaconcentraties van megestrolacetaat na toediening van 625 mg (125 mg/mL) Megace® ES suspensie voor oraal gebruik zijn onder gevoede omstandigheden equivalent aan 800 mg (40 mg/mL) megestrolacetaat suspensie voor oraal gebruik (zie figuur hieronder).
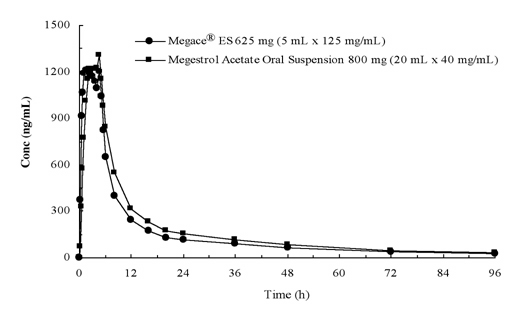
om de dosisproportionaliteit van Megace® ES te karakteriseren, werden farmacokinetische studies over een reeks doses uitgevoerd bij toediening onder nuchtere en gevoede omstandigheden. De farmacokinetiek van Megestrol was lineair in het doseringsbereik tussen 150 mg en 675 mg na toediening van Megace® ES, ongeacht de toestand van de maaltijd. De Cmax en AUC bij een vetrijke maaltijd namen toe met respectievelijk 48% en 36%, vergeleken met degenen die nuchter waren na toediening van 625 mg Megace® ES (Tabel 1). Een vetrijke maaltijd verhoogde echter significant de AUC en Cmax van megestrol tot respectievelijk een factor 2 en een factor 7, vergeleken met patiënten in nuchtere toestand na toediening van 800 mg in de oorspronkelijke formulering. Er was geen verschil in veiligheid na toediening in de gevoede toestand, daarom kon Megace® ES worden ingenomen zonder rekening te houden met maaltijden.
|
*megestrol acetate oral suspension |
||||||||||||||||
| Table 1 – Pharmacokinetic Studies Conducted with Megace® ES | ||||||||||||||||
| Amount Dosed | 150 mg | 250 mg | 375 mg | 450 mg | 575 mg | 625 mg | 675 mg | 800 mg* | ||||||||
| Dose | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 20 mL | ||||||||
| Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | |
| Cmax (ng/mL) | 412 | 379 | 647 | 588 | 810 | 958 | 955 | 1079 | – | 1421 | 1133 | 1618 | 1044 | 1616 | 187 | 1364 |
| AUC0-∞ (ng∙h/mL) | 3058 | 3889 | 5194 | 6328 | 7238 | 12193 | 9483 | 11800 | – | 14743 | 12095 | 16268 | 11879 | 17029 | 8942 | 18625 |
| Tmax (h) | 1.74 | 3.80 | 1.58 | 3.38 | 1.56 | 3.42 | 1.74 | 3.16 | – | 3.75 | 1.72 | 2.91 | 1.96 | 2.76 | 5.89 | 3.85 |
Plasma steady state farmacokinetiek van megestrolacetaat werd geëvalueerd bij 10 volwassen, cachectische mannelijke patiënten met acquired immunodeficiency syndrome (AIDS) en een onvrijwillig gewichtsverlies groter dan 10% van de uitgangswaarde. De patiënten kregen eenmalige orale doses van 800 mg / dag megestrolacetaat suspensie voor oraal gebruik gedurende 21 dagen. Gegevens over de plasmaconcentratie, verkregen op dag 21, werden tot 48 uur na de laatste dosis geëvalueerd.
De gemiddelde (±1SD) piekplasmaconcentratie (Cmax) van megestrolacetaat was 753 (±539) ng/mL. Het gemiddelde oppervlak onder de concentratietijdcurve (AUC) was 10476 (±7788) ng x uur/mL. De mediane Tmax-waarde was vijf uur. Zeven van de tien patiënten kwamen in drie weken aan.
bovendien kregen 24 volwassen, asymptomatische HIV-seropositieve mannelijke proefpersonen eenmaal daags 750 mg megestrolacetaat suspensie voor oraal gebruik. De behandeling werd gedurende 14 dagen toegediend. De gemiddelde Cmax-en AUC-waarden waren respectievelijk 490 (±238) ng/mL en 6779 (±3048) uur x ng/mL. De mediane Tmax-waarde was drie uur. De gemiddelde Cmax-waarde was 202 (±101) ng/mL. Het gemiddelde % van de fluctuatiewaarde was 107 (±40).
metabolisme
megestrolacetaatmetabolieten die in de urine werden geïdentificeerd, vormden 5% tot 8% van de toegediende dosis. De respiratoire uitscheiding als geëtiketteerde opslag van kooldioxide en vet kan verantwoordelijk zijn geweest voor ten minste een deel van de radioactiviteit die niet in urine en uitwerpselen wordt gevonden.
eliminatie
de belangrijkste eliminatieroute bij mensen is urine. Wanneer radioactief gelabeld megestrolacetaat aan mensen werd toegediend in doses van 4 tot 90 mg, varieerde de urinaire excretie binnen 10 dagen van 56,5% tot 78,4% (gemiddeld 66,4%) en de fecale excretie van 7,7% tot 30,3% (gemiddeld 19,8%). De totale teruggewonnen radioactiviteit varieerde tussen 83,1% en 94,7% (gemiddeld 86,2%).
speciale populaties
De farmacokinetiek van megestrolacetaat is bij geen enkele speciale populatie onderzocht.
dierlijke farmacologie en / of toxicologie
langdurige behandeling met Megace ® ES (megestrolacetaat) kan het risico op luchtweginfecties verhogen. Een trend in de richting van een verhoogde frequentie van luchtweginfecties, een verlaagd aantal lymfocyten en een verhoogd aantal neutrofielen werd waargenomen in een twee jaar durende chronische toxiciteit/carcinogeniteitsstudie met megestrolacetaat uitgevoerd bij ratten.
beschrijving van klinische STUDIES
megestrolacetaat suspensie voor oraal gebruik bij een dosis van 800 mg/20 mL komt overeen met 625 mg/5 mL Megace ® ES. De klinische werkzaamheid van megestrolacetaat suspensie voor oraal gebruik werd beoordeeld in twee klinische studies. Men was een multicenter, gerandomiseerde, dubbelblinde, placebo-gecontroleerde studie die megestrolacetaat (MA) bij dosissen 100 mg, 400 mg, en 800 mg per dag vergeleken versus placebo in AIDS-patiënten met anorexia/cachexie en significant gewichtsverlies. Van de 270 patiënten die deelnamen aan de studie, voldeden er 195 aan alle inclusie – /uitsluitingscriteria, hadden er minstens twee extra gewichtsmetingen na baseline gedurende een periode van 12 weken of hadden er één gewichtsmeting na baseline, maar vielen uit wegens therapeutisch falen. Het percentage patiënten dat bij maximale gewichtstoename in 12 studieweken vijf of meer Pond bij maximale gewichtstoename bereikte, was statistisch significant groter voor de met 800 mg (64%) en 400 mg (57%) behandelde ma-groepen dan voor de placebogroep (24%). Het gemiddelde gewicht nam toe vanaf baseline tot de laatste evaluatie in 12 studieweken in de 800 mg MA-behandelde groep met 7.8 pond, de 400 mg MA-groep met 4,2 Pond, de 100 mg MA-groep met 1,9 pond en daalde in de placebogroep met 1,6 Pond. Gemiddelde gewichtsveranderingen na 4, 8 en 12 weken voor patiënten die evalueerbaar zijn voor werkzaamheid in de twee klinische onderzoeken worden grafisch weergegeven. Veranderingen in de lichaamssamenstelling tijdens de 12 studieweken, zoals gemeten door middel van bio-elektrische impedantieanalyse, lieten een toename zien van het niet-waterlichaamsgewicht in de met MA behandelde groepen (zie tabel klinische studies). Bovendien ontwikkelde of verergerde oedeem bij slechts 3 patiënten.
Grotere percentages met MA behandelde patiënten in de 800 mg-groep (89%), de 400 mg-groep (68%) en de 100 mg-groep (72%) dan in de placebogroep (50%) vertoonden een verbetering van de eetlust bij laatste evaluatie gedurende de 12 studieweken. Er werd een statistisch significant verschil waargenomen tussen de met 800 mg MA behandelde groep en de placebogroep in de verandering in calorie-inname vanaf baseline tot het tijdstip van maximale gewichtsverandering. Patiënten werd gevraagd om gewichtsverandering, eetlust, uiterlijk en algemene perceptie van welzijn te beoordelen in een 9 vraagonderzoek. Bij maximale gewichtsverandering gaf alleen de met 800 mg MA behandelde groep reacties die statistisch significant gunstiger waren voor alle vragen in vergelijking met de met placebo behandelde groep. In het onderzoek werd een dosisrespons genoteerd met positieve reacties die correleerden met een hogere dosis voor alle vragen.
het tweede onderzoek was een multicenter, gerandomiseerd, dubbelblind, placebogecontroleerd onderzoek waarin megestrolacetaat 800 mg/dag werd vergeleken met placebo bij AIDS-patiënten met anorexia/cachexie en significant gewichtsverlies. Van de 100 patiënten die deelnamen aan de studie, voldeden 65 aan alle inclusie – /uitsluitingscriteria, hadden minstens twee extra gewichtsmetingen na baseline gedurende een periode van 12 weken of hadden één gewichtsmeting na baseline, maar vielen uit wegens therapeutisch falen. Patiënten in de met 800 mg MA behandelde groep hadden een statistisch significant grotere toename van de gemiddelde maximale gewichtsverandering dan patiënten in de placebogroep. Van baseline tot studieweek 12 nam het gemiddelde gewicht toe met 11,2 Pond in de met MA behandelde groep en daalde 2,1 Pond in de placebogroep. Veranderingen in de lichaamssamenstelling, gemeten door middel van bio-elektrische impedantieanalyse, toonden een toename van het niet-watergewicht in de met MA behandelde groep (zie tabel klinische studies). Er werd geen oedeem gemeld in de met MA behandelde groep. Een groter percentage van de met MA behandelde patiënten (67%) dan de met placebo behandelde patiënten (38%) vertoonde een verbetering van de eetlust bij laatste evaluatie gedurende de 12 studieweken; dit verschil was statistisch significant. Er waren geen statistisch significante verschillen tussen de behandelingsgroepen in de gemiddelde calorische verandering of in de dagelijkse calorie-inname op het moment tot de maximale gewichtswijziging. In dezelfde 9 vragenenquête waarnaar in de eerste studie werd verwezen, vertoonden de beoordelingen van de patiënten van gewichtsverandering, eetlust, uiterlijk en algemene perceptie van welzijn een toename in gemiddelde scores bij met MA behandelde patiënten in vergelijking met de placebogroep.
in beide onderzoeken verdroegen de patiënten het geneesmiddel goed en er werden geen statistisch significante verschillen gezien tussen de behandelingsgroepen met betrekking tot laboratoriumafwijkingen, nieuwe opportunistische infecties, lymfocyten tellingen, T4-tellingen, T8-tellingen of huidreactiviteitstesten (zie de rubriek bijwerkingen).
| Megestrol Acetate Oral Suspension Clinical Efficacy Trials | |||||||
| Trial 1 | Trial 2 | ||||||
| Study Accrual Dates | Study Accrual Dates | ||||||
| 11/88 to 12/90 | 5/89 to 4/91 | ||||||
| Megestrol Acetate, mg/day | 0 | 100 | 400 | 800 | 0 | 800 | |
| Entered Patients | 38 | 82 | 75 | 75 | 48 | 52 | |
| Evaluable Patients | 28 | 61 | 53 | 53 | 29 | 36 | |
| Mean Change in Weight (lb.) | |||||||
| Baseline to 12 Weeks | 0.0 | 2.9 | 9.3 | 10.7 | -2.1 | 11.2 | |
| % Patients ≥ 5 Pound Gain | |||||||
| At Last Evaluation in 12 weeks | 21 | 44 | 57 | 64 | 28 | 47 | |
| Mean Changes in Body Composition: | |||||||
| Fat Body Mass (lb.) | 0.0 | 2.2 | 2.9 | 5.5 | 1.5 | 5.7 | |
| Lean Body Mass (lb.) | -1.7 | -0.3 | 1.5 | 2.5 | -1.6 | -0.6 | |
| Water (liters) | -1.3 | -0.3 | 0.0 | 0.0 | -0.1 | -0.1 | |
| % Patients With Improved Appetite: | |||||||
| At Time of Maximum Weight Change | 50 | 72 | 72 | 93 | 48 | 69 | |
| At Last Evaluation in 12 Weeks | 50 | 72 | 68 | 89 | 38 | 67 | |
| Mean Change in Daily Caloric Intake: | |||||||
| Baseline to Time of Maximum Weight Change | -107 | 326 | 308 | 646 | 30 | 464 | |
| *Based on bioelectrical impedance analysis determinations at last evaluation in 12 weeks |
Presented below are the results of mean weight changes for patients evaluable for efficacy in trials 1 and 2.