19.11: Racemisering
Optisk aktive bifenylderivater (Seksjon 13-5a) blir racemisert hvis de to aromatiske ringene til enhver tid passerer gjennom en koplanar konfigurasjon ved rotasjon om den sentrale bindingen. Dette kan være forårsaket mer eller mindre lett av varme, med mindre 2,2 ‘ – ortho substituents er svært store.
måten forbindelser med asymmetriske karbonatomer er racemisert på, er mer komplisert. En mulighet ville være for et tetrahedral chiralt karbon festet til fire grupper for å bli plan og achiral uten å bryte noen bindinger. Teoretiske beregninger indikerer at dette ikke er en sannsynlig prosess for kiralt tetravalent karbon, men som vi vil se, forekommer det med kiralt karbon og andre kirale atomer som er festet til tre grupper:
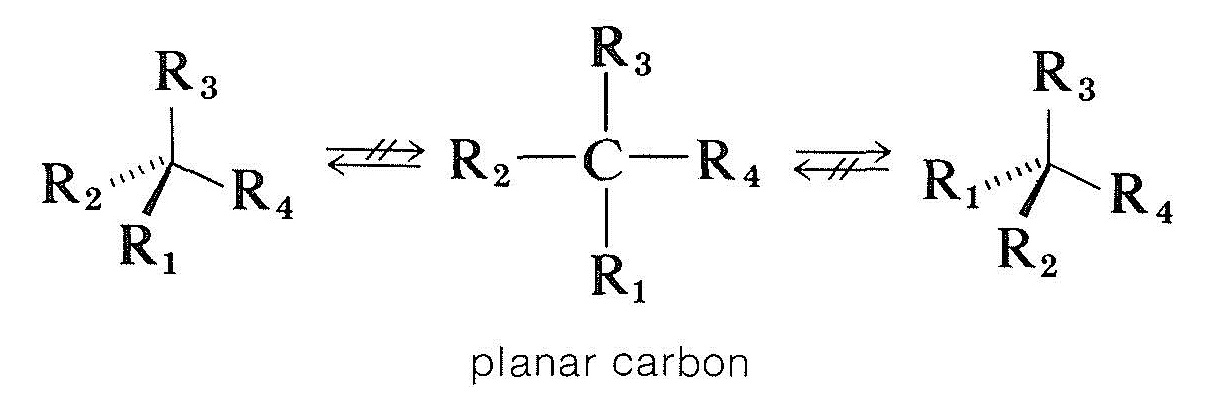
Optisk aktive karbonylforbindelser av typen \(\ce{-CHC=O}\), der alfa-karbonet er asymmetrisk, blir racemisert av både syrer og baser, og Fra Seksjon 17-1 vi kan være sikre på at dette er relatert til enolisering. Dannelse av enten enol eller enolate anion vil ødelegge asymmetri av\ (\alpha\) karbon slik at, selv om bare spormengder av enol er til stede til enhver tid, til slutt alle forbindelsen vil bli racemized. Imidlertid krever mekanismen både at det er et\ (\alpha\) hydrogen og at symmetriens senter er plassert ved dette\ (\alpha\) karbon. Ellers er syrer og baser ineffektive i katalysering av racemisering.
.jpg?revision=1)
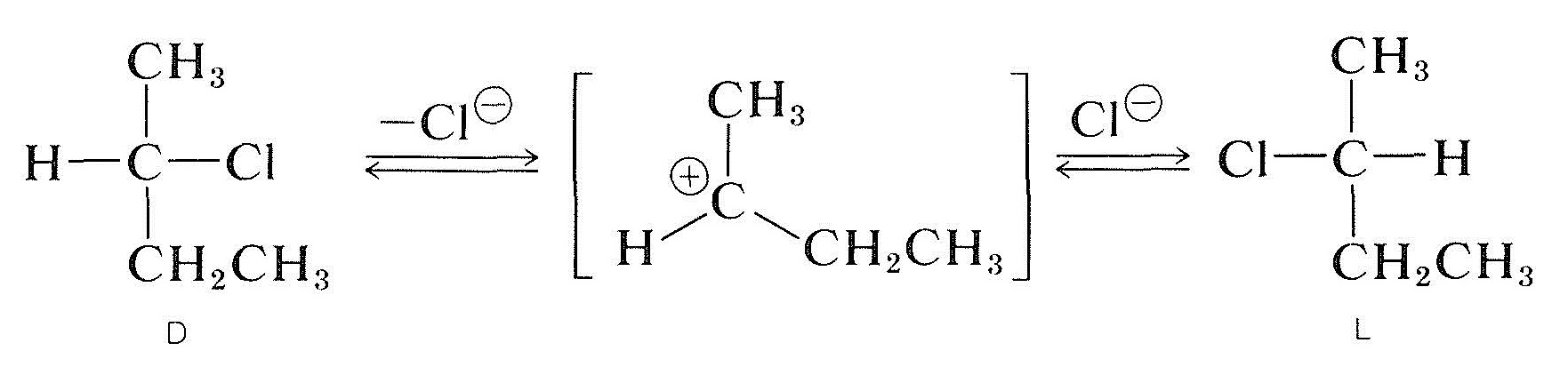
racemisering av et optisk aktivt sekundært halogenid med det kirale karbon som bærer halogenet (f. eks., 2-chlorobutane) kan oppstå ih løsning og, vanligvis, jo mer polar og bedre ioniserende løsningsmidlet er, jo lettere stoffet er racemized. Ionisering av halogenidet ved en \(S_\text{N}1\) prosess er sannsynligvis ansvarlig, og dette vil sikkert bli fremmet av polare løsningsmidler (Seksjon 8-6). Alle indikasjoner er at en alkyl carbocation gang dissosiert fra tilhørende anion er plan; og, når en slik ion rekombinerer med anion, det har lik sannsynlighet for å danne \(D\) og \(L\) enantiomerer:
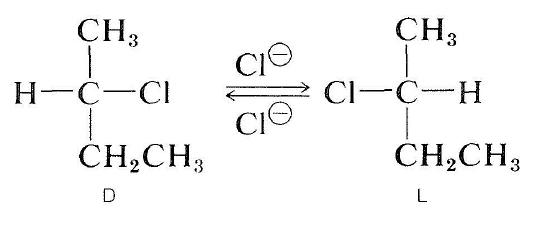
Optisk aktive halogenider kan også racemiseres av en\ (s_ \ text{N}2\) mekanisme. En løsning av aktiv 2-klorbutan i 2-propanon inneholdende oppløst litiumklorid blir racemisk. Forskyvning av klorid av halid ved kloridion inverterer konfigurasjon ved atom under substitusjon (se Avsnitt 8-5). En annen substitusjon regenererer den opprinnelige enantiomeren. Til slutt produserer denne frem og tilbake prosessen like mange av \(D\) og \(L\) former; stoffet er da racemisk:
Asymmetriske alkoholer blir ofte racemisert av sterke syrer. Utvilsomt finner ionisering sted, og rekombinasjon av karbokasjonen med vann fører til enten enantiomer:
.jpg?revision=1&size=bestfit&width=590&height=243)
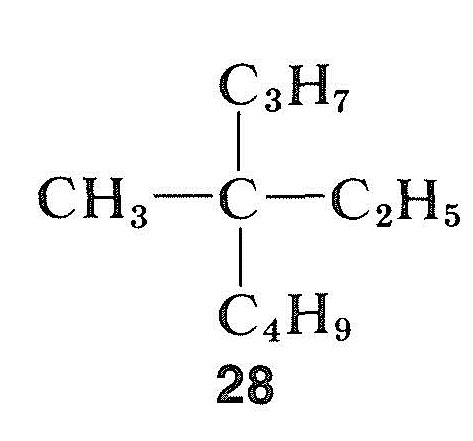
i motsetning til halogenider, alkoholer og karbonylforbindelser, kan hydrokarboner være ekstremt vanskelig å racemisere. Dette gjelder spesielt for en forbindelse med et kvaternært asymmetrisk senter, som metyletylpropylbutylmetan, \(28\), som ikke har noe «håndtak» for å tillate en å konvertere det asymmetriske karbonet til en symmetrisk tilstand ved enkle kjemiske midler:
hydrokarboner som har et hydrogenatom ved det asymmetriske karbonet, kan imidlertid racemiseres hvis de kan konverteres enten til karbokasjoner eller til carbanions. Den enkle karbanion-typen racemisering vil avhenge av surheten av det vedlagte hydrogenet og på den stereokjemiske stabiliteten til den mellomliggende karbanion som dannes. Hvis konfigurasjonen av carbanion intermediate inverterer, vil racemisering resultere (se Også Avsnitt 6-4e):
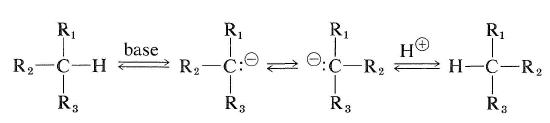
karbokasjonstypen av racemisering av et optisk aktivt hydrokarbon kan oppstå ved utvekslingsreaksjonen beskrevet i Avsnitt 10-9.
Bidragsytere og Attribusjoner
- John D. Robert Og Marjorie C. Caserio (1977) Grunnleggende Prinsipper For Organisk Kjemi, andre utgave. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Dette innholdet er opphavsrettsbeskyttet under følgende betingelser :» du er gitt tillatelse til individuell, pedagogisk, forskning og ikke-kommersiell reproduksjon, distribusjon, visning og ytelse av dette arbeidet i ethvert format.»