7.18: Vinylhalogenider og Arylhalogenider
Nukleofil substitusjon i arylhalogenidene
vi vil se nærmere på strukturen av klorbenzen. Brombenzen og jodbenzen er de samme. Den enkleste måten å tegne strukturen på klorbenzen er:
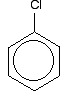
for å forstå klorbenzen riktig må du grave litt dypere enn dette. Det er en interaksjon mellom de delokaliserte elektronene i benzenringen og et av de ensomme parene på kloratomet. Dette overlapper med det delokaliserte ringelektronsystemet . . .
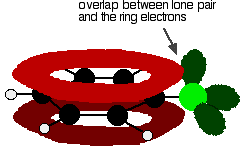
for å gi en struktur som dette:
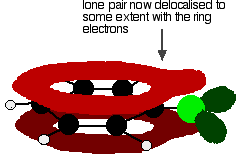
denne delokaliseringen er på ingen måte fullført, men den har en signifikant effekt på egenskapene til både karbon-klor.bindingen og polariteten til molekylet. Delokaliseringen introduserer litt ekstra binding mellom karbon og klor, noe som gjør bindingen sterkere. Dette har en stor effekt på reaksjonene av forbindelser som klorbenzen.
det er også noe bevegelse av elektroner vekk fra klor mot ringen. Klor er ganske elektronegativ og trekker vanligvis elektroner i karbon-klorbindingen mot seg selv. I dette tilfellet kompenseres dette til en viss grad av bevegelsen av elektroner tilbake mot ringen i delokaliseringen. Molekylet er mindre polar enn du ellers ville ha forventet.
Enkle arylhalogenider som klorbenzen er svært resistente mot nukleofil substitusjon. Det er mulig å erstatte klor med-OH, men bare under svært alvorlige industrielle forhold – for eksempel ved 200°C Og 200 atmosfærer. I laboratoriet skjer disse reaksjonene ikke. Det er to grunner til dette – avhengig av hvilken av de ovennevnte mekanismene du snakker om.
- den ekstra styrken av karbon-halogenbindingen i arylhalogenider: karbon-klorbindingen i klorbenzen er sterkere enn du kanskje forventer. Det er en interaksjon mellom et av de ensomme parene på kloratomet og de delokaliserte ringelektronene, og dette styrker bindingen. Begge mekanismene ovenfor innebærer å bryte karbon-halogenbindingen på et tidspunkt. Jo vanskeligere det er å bryte, jo tregere blir reaksjonen.
- Frastøting av ringelektronene: dette gjelder bare hvis hydroksidionet angrep klorbenzen med en mekanisme som den første som er beskrevet ovenfor. I den mekanismen angriper hydroksidionet det litt positive karbonet som halogenatomet er festet til.Hvis halogenatomet er festet til en benzenring, vil det innkommende hydroksidionet bli møtt med de delokaliserte ringelektronene over og under det karbonatomet. Det negative hydroksydionet vil ganske enkelt bli avstøt. Den spesielle mekanismen er bare en ikke-starter!