Etikett: MEGACE ES-megestrolacetatsuspensjon
KLINISK FARMAKOLOGI
det finnes flere analysemetoder som brukes til å estimere plasmakonsentrasjoner av megestrolacetat, inkludert gasskromatografi-massefragmentografi (GC-MF), høytrykks væskekromatografi (HPLC) og radioimmunoassay (RIA). Gc-MF og HPLC-metodene er spesifikke for megestrolacetat og gir ekvivalente konsentrasjoner. Ria-metoden reagerer på megestrolacetatmetabolitter og er derfor ikke-spesifikk og indikerer høyere konsentrasjoner ENN gc-MF og HPLC-metodene. Plasmakonsentrasjoner er ikke bare avhengige av metoden som brukes, men også på intestinal og hepatisk inaktivering av legemidlet, som kan påvirkes av faktorer som tarmmotilitet, tarmbakterier, administrerte antibiotika, kroppsvekt, diett og leverfunksjon.Flere etterforskere har rapportert om appetittforbedrende egenskapen til megestrolacetat og dens mulige bruk i kakeksi. Den nøyaktige mekanismen som megestrolacetat produserer effekter i anoreksi og kakeksi er ukjent for tiden.
Farmakokinetiske Egenskaper:
Plasmakonsentrasjoner av megestrolacetat etter administrering av 625 mg (125 mg/mL) Megace® ES mikstur, suspensjon er ekvivalente til 800 mg (40 mg/mL) megestrolacetat mikstur, suspensjon (se figur nedenfor).
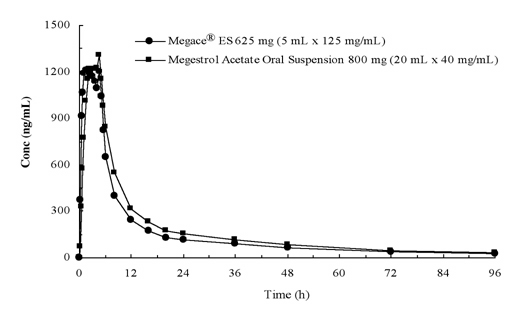
for å karakterisere doseproporsjonaliteten Til Megace® ES, ble farmakokinetiske studier på tvers av en rekke doser utført ved administrering under faste og mattilstander. Farmakokinetikken til megestrol var lineær i doseringsområdet mellom 150 mg og 675 mg etter administrasjon av Megace® es uavhengig av måltidstilstand. Cmax og AUC under et måltid med høyt fettinnhold økte med henholdsvis 48% og 36% sammenlignet med de som fastet etter administrasjon av Megace® 625 mg (Tabell 1). Imidlertid økte et fettrikt måltid signifikant AUC og Cmax av megestrol til henholdsvis 2 og 7 ganger sammenlignet med de som var fastende etter administrering av 800 mg i den opprinnelige formuleringen. Det var ingen forskjell i sikkerhet etter administrasjon i fed-tilstand, Derfor kunne Megace® ES tas uten hensyn til måltider.
|
*megestrol acetate oral suspension |
||||||||||||||||
| Table 1 – Pharmacokinetic Studies Conducted with Megace® ES | ||||||||||||||||
| Amount Dosed | 150 mg | 250 mg | 375 mg | 450 mg | 575 mg | 625 mg | 675 mg | 800 mg* | ||||||||
| Dose | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 20 mL | ||||||||
| Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | |
| Cmax (ng/mL) | 412 | 379 | 647 | 588 | 810 | 958 | 955 | 1079 | – | 1421 | 1133 | 1618 | 1044 | 1616 | 187 | 1364 |
| AUC0-∞ (ng∙h/mL) | 3058 | 3889 | 5194 | 6328 | 7238 | 12193 | 9483 | 11800 | – | 14743 | 12095 | 16268 | 11879 | 17029 | 8942 | 18625 |
| Tmax (h) | 1.74 | 3.80 | 1.58 | 3.38 | 1.56 | 3.42 | 1.74 | 3.16 | – | 3.75 | 1.72 | 2.91 | 1.96 | 2.76 | 5.89 | 3.85 |
Farmakokinetikken Til Megestrolacetat I Plasma ble evaluert hos 10 voksne, kakektiske mannlige pasienter med ervervet immunsviktsyndrom (AIDS) og et ufrivillig vekttap større enn 10% av baseline. Pasientene fikk orale enkeltdoser på 800 mg/dag megestrolacetat mikstur, suspensjon i 21 dager. Plasmakonsentrasjonsdata fra dag 21 ble evaluert i opptil 48 timer etter siste dose.
Gjennomsnittlig (±1sd) maksimal plasmakonsentrasjon (Cmax) av megestrolacetat var 753 (±539) ng/mL. Gjennomsnittlig areal under konsentrasjonstidskurven (AUC) var 10476 (±7788) ng x time/mL. Median Tmax-verdi var fem timer. Syv av 10 pasienter fikk vekt på tre uker.
I Tillegg ble 24 voksne, asymptomatiske HIV-seropositive menn dosert en gang daglig med 750 mg megestrolacetat mikstur, suspensjon. Behandlingen ble administrert i 14 dager. Gjennomsnittlige cmax-og AUC-verdier var henholdsvis 490 (±238) ng/mL og 6779 (±3048) hr x ng/mL. Median Tmax-verdi var tre timer. Gjennomsnittlig Cmax-verdi var 202 (±101) ng/mL. Gjennomsnittlig % av svingningsverdien var 107 (±40).Metabolisme Megestrolacetatmetabolitter som ble identifisert i urin utgjorde 5% til 8% av administrert dose. Respiratorisk utskillelse som merket karbondioksid og fettlagring kan ha utgjort minst en del av radioaktiviteten som ikke finnes i urin og avføring.
Eliminasjon
hovedveien for legemiddeleliminering hos mennesker er urin. Når radiomerket megestrolacetat ble administrert til mennesker i doser på 4 til 90 mg, varierte urinutskillelsen innen 10 dager fra 56,5% til 78,4% (gjennomsnittlig 66,4%) og fekal utskillelse varierte fra 7,7% til 30,3% (gjennomsnittlig 19,8%). Den totale gjenvunnede radioaktiviteten varierte mellom 83,1% og 94,7% (gjennomsnittlig 86,2%).
Spesielle Populasjoner
farmakokinetikken til megestrolacetat er ikke undersøkt i noen spesielle populasjoner.
FARMAKOLOGI og / ELLER TOKSIKOLOGI HOS DYR
Langtidsbehandling med Megace ® ES (megestrolacetat) kan øke risikoen for luftveisinfeksjoner. En trend mot økt frekvens av luftveisinfeksjoner, redusert lymfocyttall og økt nøytrofiltall ble observert i en toårig kronisk toksisitet/karsinogenitetsstudie av megestrolacetat utført hos rotter.
BESKRIVELSE av KLINISKE STUDIER
Megestrolacetat mikstur, suspensjon i en dose på 800 mg / 20 mL tilsvarer 625 mg/5 mL Megace ® ES. Den kliniske effekten av megestrolacetat mikstur ble vurdert i to kliniske studier. Den ene var en multisenter, randomisert, dobbeltblind, placebokontrollert studie som sammenlignet megestrolacetat (MA) ved doser på 100 mg, 400 mg og 800 mg daglig versus placebo hos AIDS-pasienter med anoreksi/kakeksi og signifikant vekttap. Av de 270 pasientene som deltok i studien, oppfylte 195 alle inklusjons – / eksklusjonskriterier, hadde minst to ekstra vektmålinger etter baseline i løpet av en 12-ukers periode eller hadde en vektmåling etter baseline, men droppet ut på grunn av terapeutisk svikt. Prosentandelen av pasientene som fikk fem eller flere pounds ved maksimal vektøkning i 12 studieuker var statistisk signifikant større for 800 mg (64%) OG 400 mg (57%) MA-behandlede grupper enn for placebogruppen (24%). Gjennomsnittlig vekt økte fra baseline til siste evaluering i 12 studieuker i 800 mg MA-behandlede gruppen med 7.8 pounds, 400 mg MA-gruppen med 4.2 pounds, 100 mg MA-gruppen med 1.9 pounds og redusert i placebogruppen med 1.6 pounds. Gjennomsnittlig vektendring ved uke 4, 8 og 12 for pasienter som kan evalueres for effekt i de to kliniske studiene, vises grafisk. Endringer i kroppssammensetning i løpet av de 12 studieukene målt ved bioelektrisk impedansanalyse viste økning i ikke-vann kroppsvekt i de ma-behandlede gruppene (se kliniske studietabell). I tillegg utviklet ødem eller forverret hos bare 3 pasienter.
Større prosenter AV MA-behandlede pasienter i 800 mg-gruppen (89%), 400 mg-gruppen (68%) og 100 mg-gruppen (72%), enn i placebogruppen (50%), viste en bedring i appetitt ved siste evaluering i løpet av 12 studieuker. Det ble observert en statistisk signifikant forskjell mellom DEN 800 mg MA-behandlede gruppen og placebogruppen i endringen i kaloriinntak fra baseline til tidspunkt for maksimal vektendring. Pasientene ble bedt om å vurdere vektendring, appetitt, utseende og generell oppfatning av velvære i en 9 spørsmålsundersøkelse. Ved maksimal vektendring ga kun 800 mg MA-behandlede gruppen responser som var statistisk signifikant gunstigere for alle spørsmål sammenlignet med placebogruppen. En doserespons ble observert i undersøkelsen med positive responser som korrelerte med høyere dose for alle spørsmål.den andre studien var en multisenter, randomisert, dobbeltblind, placebokontrollert studie som sammenlignet megestrolacetat 800 mg / dag versus placebo hos AIDS-pasienter med anoreksi/kakeksi og signifikant vekttap. Av de 100 pasientene som deltok i studien, oppfylte 65 alle inklusjons – / eksklusjonskriterier, hadde minst to ekstra vektmålinger etter baseline i løpet av en 12-ukers periode eller hadde en vektmåling etter baseline, men droppet ut på grunn av terapeutisk svikt. Pasienter i 800 mg MA-behandlede gruppen hadde en statistisk signifikant større økning i gjennomsnittlig maksimal vektendring enn pasienter i placebogruppen. Fra baseline til studie uke 12 økte gjennomsnittlig vekt med 11.2 pounds i MA-behandlet gruppe og redusert 2.1 pounds i placebogruppen. Endringer i kroppssammensetning målt ved bioelektrisk impedansanalyse viste økning i ikke-vannvekt i DEN MA-behandlede gruppen (se kliniske studietabell). Ingen ødem ble rapportert i DEN MA-behandlede gruppen. En større prosentandel av MA-behandlede pasienter (67%) enn placebobehandlede pasienter (38%) viste en forbedring i appetitten ved siste evaluering i løpet av 12 studieuker; denne forskjellen var statistisk signifikant. Det var ingen statistisk signifikante forskjeller mellom behandlingsgruppene i gjennomsnittlig kaloriforandring eller i daglig kaloriinntak ved tid til maksimal vektendring. I den samme 9 spørsmålsundersøkelsen som ble referert i den første studien, viste pasientenes vurderinger av vektendring, appetitt, utseende og generell oppfatning av velvære økning i gjennomsnittlig score hos MA-behandlede pasienter sammenlignet med placebogruppen.
i begge studiene tolererte pasientene legemiddelet godt, og det ble ikke sett statistisk signifikante forskjeller mellom behandlingsgruppene med hensyn til laboratorieavvik, nye opportunistiske infeksjoner, lymfocyttall, T4-tall, T8-tall eller hudreaktivitetstester (se ADVERSEREACTIONS-delen).
| Megestrol Acetate Oral Suspension Clinical Efficacy Trials | |||||||
| Trial 1 | Trial 2 | ||||||
| Study Accrual Dates | Study Accrual Dates | ||||||
| 11/88 to 12/90 | 5/89 to 4/91 | ||||||
| Megestrol Acetate, mg/day | 0 | 100 | 400 | 800 | 0 | 800 | |
| Entered Patients | 38 | 82 | 75 | 75 | 48 | 52 | |
| Evaluable Patients | 28 | 61 | 53 | 53 | 29 | 36 | |
| Mean Change in Weight (lb.) | |||||||
| Baseline to 12 Weeks | 0.0 | 2.9 | 9.3 | 10.7 | -2.1 | 11.2 | |
| % Patients ≥ 5 Pound Gain | |||||||
| At Last Evaluation in 12 weeks | 21 | 44 | 57 | 64 | 28 | 47 | |
| Mean Changes in Body Composition: | |||||||
| Fat Body Mass (lb.) | 0.0 | 2.2 | 2.9 | 5.5 | 1.5 | 5.7 | |
| Lean Body Mass (lb.) | -1.7 | -0.3 | 1.5 | 2.5 | -1.6 | -0.6 | |
| Water (liters) | -1.3 | -0.3 | 0.0 | 0.0 | -0.1 | -0.1 | |
| % Patients With Improved Appetite: | |||||||
| At Time of Maximum Weight Change | 50 | 72 | 72 | 93 | 48 | 69 | |
| At Last Evaluation in 12 Weeks | 50 | 72 | 68 | 89 | 38 | 67 | |
| Mean Change in Daily Caloric Intake: | |||||||
| Baseline to Time of Maximum Weight Change | -107 | 326 | 308 | 646 | 30 | 464 | |
| *Based on bioelectrical impedance analysis determinations at last evaluation in 12 weeks |
Presented below are the results of mean weight changes for patients evaluable for efficacy in trials 1 and 2.