Grenser i Kardiovaskulær Medisin
Innledning
ved undersøkelse av koordinatsystemer som kan brukes til forskjellige biologiske enheter, bør spesifikke egenskaper vurderes. For eksempel danner kromosomnummer og baseparposisjon et lineært koordinatsystem som er tilstrekkelig til å definere plassering i referansegenomet (1). Et koordinatsystem for hele menneskekroppen, som kan tjene Behovene Til HuBMAP, HCA, HPA og andre kartleggingsarbeid, er imidlertid langt mer komplekst av flere grunner (2-5). For det første lever celler i tre dimensjoner; og ytterligere informasjon er nødvendig for å beskrive størrelsen og rotasjonsretningen til enhver vevsprøve som brukes til å generere dataene. For det andre, mens genombaseparposisjon ikke er avhengig av HVORDAN DNA brettes og pakkes inn i kjernen, er posisjonene til individuelle elementer (f. eks., celler, organer) i kroppen er dynamiske, da de kan forandre seg med skjelett-og muskelbevegelser, tyngdekraften, pusten, hjerteslagene og andre funksjoner og krefter som forvrenger vev. For det tredje, selv om variasjonen AV DNA mellom mennesker er <1%, spenner menneskekroppsgeometri et bredt spekter av høyder, vekter og former, som varierer etter kjønn og rase og endres betydelig over en persons levetid.
Ett alternativ er å bruke ET 3d Kartesisk koordinatsystem for å beskrive posisjon i kroppen. Kartesiske koordinatsystemer har fordelen av å være kjent og lett forstått. Med kroppen i standard anatomisk posisjon, danner venstre-høyre, kaudal-kraniale og bakre-anterior tre vinkelrette (x-y-z) akser. For mindre skala analyser, sentrering opprinnelsen på en anatomisk landemerke kan være mest nyttig og potensielt mindre variabel mellom ulike mennesker. For eksempel ville det være lettere å måle avstanden til en vevsprøve fra nyren til nyrens overlegne pol enn til toppen av en persons hode. Ulempen Med Kartesiske koordinater er at aksene ikke følger kroppens naturlige form. Som et resultat vil det å lage et referansekart ved å digitalt «sy» sammen vevsprøver samlet fra mennesker av forskjellige størrelser kreve en kompleks prosess for å vri, rotere og tilpasse dataene. Å gjøre dette på en måte som skalerer til hele kroppen og samtidig opprettholde cellenivå presisjon ville være svært utfordrende.
Andre 3d-koordinatsystemer er utviklet for forskjellige applikasjoner. For eksempel beskriver sfæriske koordinater, med akser som representerer breddegrad, lengdegrad og høyde, beleilig plassering på jordens overflate. En enkel bane i sfæriske koordinater, som» 1 km øst», er mye vanskeligere å kommunisere ved Hjelp Av Kartesiske koordinater. På samme måte bør koordinatsystemer for menneskekroppen ideelt sett ha akser som følger anatomiske strukturer, genetiske uttrykksmønstre, kjemiske gradienter og/eller andre biologisk relevante veier. Flere organspesifikke koordinatsystemer er utviklet, For Eksempel Talairach-koordinater for funksjonell hjerneavbildning, men disse strekker seg ikke til hele kroppen (6).
Vaskulært Basert Koordinatsystem
i 2017 ble Et Felles Koordinatramme (CCF) Møte organisert av National Institutes Of Health, Broad Institute, Sanger Institute og Chan Zuckerberg Initiative. Møtedeltakere, som inkluderte anatomister, patologer, klinikere og teknologieksperter fra hele verden, foreslo flere tilnærminger for å kartlegge menneskekroppens celler, inkludert anatomisk baserte koordinatsystemer (7). En av disse, som bruker vaskulaturen, ble videre diskutert på ET 2019 CCF-Verksted, spesielt for lokalisering av nyreceller (8). I dette manuskriptet presenterer vi en konseptuell oversikt over dette vaskulære baserte koordinatsystemet og beskriver dets fordeler og begrensninger (Figur 1).
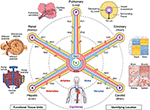
Figur 1. Nav-og-talte strukturen til et vaskulært koordinatsystem. Det vaskulære koordinatsystemet består av representative fartøysløyfer som begynner og slutter i hjertekamrene og strekker seg til de funksjonelle enhetene til hvert organ(mot klokken fra øvre venstre: alveoler, glomeruli og hepatiske lobuler). «Adressen» til en celle inkluderer navnet på sløyfen (f.eks. «R» for nyre og «H» for lever) og forgreningsnivået til nærmeste fartøy (F. EKS. «RA1» for afferente arterioler i nyresløyfen). Legg merke til at hjerteveggene ligger langs koronar («C») vaskulær sløyfe, og cellene i noen strukturer som er indre for hjertet, er faktisk plassert på periferien av koordinatsystemet, nær kapillærene som gir dem blod. Det er flere måter å finne en enda mer presis» GPS-lignende «posisjon, inkludert, går med klokken fra øverst til høyre, «hypoksi fingeravtrykk» som resulterer fra å redusere oksygennivået lenger fra fartøyet, det unike «histologiske fingeravtrykk «og» genuttrykk fingeravtrykk «i forskjellige typer vaskulære endotelceller, og den karakteristiske» vaskulær arkitektur fingeravtrykk » som finnes i forskjellige typer vev. Vaskulaturen strekker seg til alle deler av kroppen (bunnen) og rammer alle organer i alle skalaer. kildefil: Bilder av hepatiske lobules, glomeruli, alveoler, genuttrykk varmekart, og hele kroppen vaskulatur er tilpasset Fra Wikimedia Commons: https://commons.wikimedia.org/wiki/File:2423_Microscopic_Anatomy_of_Liver.jpg (Public Domain); https://commons.wikimedia.org/wiki/File:Juxtaglomerular_Apparatus_and_Glomerulus.jpg (CC BY 3.0 lisens); https://commons.wikimedia.org/wiki/File:Alveolus_diagram.svg (Public Domain); https://commons.wikimedia.org/wiki/File:Iris_dendrogram.png (cc by-sa 4.0 lisens); Ja, https://commons.wikimedia.org/wiki/File:Circulatory_System_en.svg (offentlig domene). Genuttrykk varme kart gjenskapt Fra Guo et al. (9) bruk av simulerte data. Vaskulær arkitektur basert På Bosetti et al. (10) (CC BY 4.0 lisens).
målet med et vaskulært koordinatsystem er ikke å bygge et kart over vaskulaturen. Snarere er ideen å bruke kjente vaskulære veier gjennom kroppen som en akse i et koordinatsystem som kan beskrive posisjonen til anatomiske elementer, som celler, i vevet som omgir vaskulaturen. I dette foreslåtte rammeverket, kan kamrene i hjertet bli sett på som opprinnelsen i hele kroppen kartet. Den vaskulære aksen inneholder vaskulære løkker (sammenlignbare Med» veier » I Google Map-metaforen) som strekker seg ut gjennom aorta eller lungearterien, gradvis avtar til enkeltcellestørrelse når de nærmer seg hver annen celle i hvert organ i kroppen, og går tilbake til hjertet. Langs disse veiene følger vaskulaturen den unike biologien til de forskjellige organer og vev; og på samme måte kunne kroppens organer og vev ikke eksistere uten de unike egenskapene til deres tett integrerte vaskulatur.akkurat som genomkartet utfolder DNA i en lineær sekvens, kan vi forestille oss å utfolde de komplekse 3d-vendingene i vaskulaturaksen til en enklere 2d» hub-and-spoke » – form med hjertekamrene i midten. Denne skjematiske representasjonen av vaskulaturen gjør det lettere å (1) beskrive plassering i kroppen; (2) justere vaskulære veier med varierende 3D-former, men ekvivalent funksjon fra forskjellige mennesker; (3) identifisere mønstre som endringer i celletype og genuttrykk som en overgang fra større til mindre fartøy i et organ (langs en eiker); og, (4) sammenligne vev på samme nivå (f. eks kapillærer) i ulike organer (over eiker).
et organ, som nyrene, har titusenvis av vaskulaturveier hvis hver kapillær anses å være tydelig. For å gjøre konstruksjonen AV EN CCF mulig, vil vi imidlertid gjøre en ytterligere forenkling av antagelsen om at mange av disse veiene ikke skiller seg fra hverandre. Spesielt er de minste karene (kapillærene) i sentrum av de små spesialiserte funksjonelle enhetene i hvert organ (f. eks., hepatiske lobuler i leveren, glomeruli i nyrene og alveoler i lungen). Et helt organ krever mange av disse vaskulære sentrerte funksjonelle enhetene som er anatomisk og fysiologisk like (11). Denne likheten kan brukes til å kollapse mange vaskulære veier i noen få representative (Figur 2). I fremtiden, når vi lærer mer om biomolekylære profiler av disse banene, kan VI forfine CCF ved å dele banene i noen undertyper som oppdages.

Figur 2. Utfolding av renal vaskulær vei ned til enkeltcellenivå. En representativ vaskulær vei går inn i nyrene gjennom nyrearterien, passerer gjennom glomerulus, og returnerer ut nyrevenen. Ved makroskalaen (venstre) og mesoskala (senter) er etiketter i gule bokser anatomiske strukturer som tilsvarer forskjellige fartøy langs denne sløyfen. På mikroskala (høyre) er etiketter i gule bokser forskjellige typer celler som ligger innen kort avstand fra et nærliggende fartøy i glomerulus. Plasseringen av individuelle celler kan beskrives ved nærmeste fartøys adresse (f. eks., «RA0 «for glomerulus kapillær), avstanden i mikrometer eller antall celler fra fartøyets endotel og en vinkel vinkelrett på fartøyets lengde (f.eks.» RA0-10 µ-135° «eller»RA0-1C-135°»). Helt til høyre har hvert fartøy og dets omkringliggende vev blitt ekstrahert fra det opprinnelige bildet og justert vertikalt for å gjøre det enkelt å se hvordan celletyper og distribusjon endres langs den vaskulære banen. I dette eksemplet har de justerte bildene også blitt rotert slik at senteret av glomerulus alltid er til høyre. kildefil: Bilder av nyre og glomerulus er tilpasset Fra Wikimedia Commons:https://commons.wikimedia.org/wiki/File:KidneyStructures_PioM.svg (CC BY-SA 4.0 lisens); og,https://commons.wikimedia.org/wiki/File:Renal_corpuscle-en.svg (CC BY-SA 4.0 lisens).
en «adresse» til en enkelt celle i et vaskulært koordinatsystem har fire komponenter. (1) den første er det nærmeste anatomisk navngitte fartøyet som mest nøyaktig identifiserer en vaskulær sløyfe (det vaskulære territoriet eller «vannet»), som den høyre nyrearterien. (2) den neste komponenten representerer forgreningsnivået til fartøyet. I nyrene er eksempler fra proksimale til distale interlobararteriene, kortikale utstrålede arterier, afferente arterioler og glomerulære kapillærer. Forgreningsnivået kan også defineres numerisk, med kapillærer på nullnivå og høyere nivåer med større tall. (3) den tredje komponenten er den vinkelrette avstanden i mikrometer eller antall celler fra endotellaget av fartøyet. (4) en valgfri fjerde komponent kan være rotasjonsvinkelen vinkelrett på fartøyets lengde. Null grader kan defineres mange måter avhengig av søknaden. For eksempel kan det være i forhold til en markør på vevsprøven, eller det kan peke mot en anatomisk struktur, som sentrum av nærmeste glomerulus i nyrene. Verktøyet og behovet for disse komponentene må bekreftes ved eksperimentell testing.en annen tilnærming er å bruke endotelceller som «forankringsceller» for å identifisere de relative posisjonene til de andre cellene PÅ EN GPS-lignende måte. Endotelet linjer hele vaskulaturen. Distinkte endotelcelletyper (EC) vises i forskjellige deler av vaskulaturen, som kan detekteres histologisk gjennom unike celleegenskaper og naboceller («histologisk fingeravtrykk»), samt gjennom analyse av deres spesifikke genprofiler («genuttrykk fingeravtrykk», figur 1 varmekart) (9, 12, 13). Vaskulær organisasjonsmønster, forgrening kompleksitet, diameter, etc. gi ytterligere gjenkjennelige funksjoner som danner en «vaskulær arkitektur fingeravtrykk» for hvert vev (Figur 1 falsk-farge fluorescerende vaskulatur bilder) (10, 14). Hvert vev har spesifikke oksygengradienter, som kan brukes til å bestemme avstanden fra fartøyet. NÅR PO2 ikke kan måles direkte, kan man utlede celleavstanden fra induksjons – / ekspresjonsgradienter av hypoksi-induserbare gener i forskjellige typer celler («hypoksi fingeravtrykk», Figur 1 tverrgående visning av et fartøy) (15-17).
Fordeler Med En Vaskulær CCF
et vaskulært koordinatsystem gir mening biologisk. Hver levende celle må være innenfor en liten radius fra nærmeste blodåre (100 µ til 1 mm, avhengig av vev) for å motta oksygen (18); og hvert fartøy er foret av det samme kontinuerlige laget av endotel (19). Dermed danner vaskulaturen en ubrutt vei som når alle deler av kroppen, sømløst avtagende ned over skalaer, fra makroskala (hele kroppen/klinisk) til mesoskala til mikroskala (enkeltcellestørrelse kapillærkar). Som en del av dette håndterer den gradvis overgang fra store arterier og vener, som er bevart hos de fleste, ned til millioner av mikroskopiske fartøy som er gjenkjennelige etter kategori (f.eks. glomerulus kapillær), men ikke av individuelle navn. Det vaskulære systemet tilpasser seg individuell kroppsstørrelse og form, og tar hensyn til individuelle variasjoner (20, 21). Det definerer formen på funksjonelle enheter i forskjellige organer, som leverlobuler, nyreglomeruli og lungalveoler. Normal utvikling av nytt vev begynner med fartøysdannelse før flere celletyper kan vokse rundt den (22).
det vaskulære systemet når også alle organer, vev og celler på en sammenhengende måte. Andre anatomiske strukturer synes ikke å ha lignende allsidighet. For eksempel strekker skjelettsystemet seg til hele kroppen; imidlertid kan avstanden fra en celle i et organ til nærmeste ben være flere centimeter, og at benet er usannsynlig å være en del av orgelet, og enda mindre sannsynlig å være en del av et vevsprøve. Nervesystemet følger mange av de samme veiene som større fartøy investert med kontraktile egenskaper, men det er ikke kjent om de strekker seg til å følge de mindre fartøyene som når alle vevsceller. Således, i motsetning til cellers avhengighet av oksygen, er det ingen garanti for at hver celle er i nærheten av en nerve. Organspesifikke referansesystemer er basert på unike strukturelle egenskaper som bare eksisterer i det enkelte organ( f. eks. bestemte områder av hjernen) og er usannsynlig å være nyttige for å representere cellesteder andre steder i kroppen.
det er mange praktiske fordeler med et vaskulært koordinatsystem. Vaskulære veier i alle organer har blitt studert grundig og er beskrevet i litteraturen i detalj. De er nyttige, kjente og har standardiserte navn på tvers av mange spesialdomener. Vev vaskularisering mønstre brukes klinisk for å diagnostisere sykdom; og fartøy brukes i kirurgi og biopsier som de viktigste anatomiske landemerkene og for å definere «vaskulære territorier» (23, 24). Selv om den nøyaktige posisjon I 3d Kartesisk plass kan være vanskelig å bestemme for en resected vev prøven, vil kirurgen typisk være i stand til å indikere hvilke vaskulære vannskille inkludert prøven.
Begrensninger Av En Vaskulær CCF
Bare å kjenne baseparene i en genomsekvens gir ikke nok informasjon til å bestemme HVORDAN DNA foldes i en bestemt celle. På samme måte, selv om det utfoldede vaskulære koordinatsystemet kan beskrive DET 3d romlige forholdet mellom nærliggende celler ved mikroskalaen, går de svingete banene som fartøyene tar og den relative avstanden mellom celler i større skalaer tapt. Informasjon om større skala strukturer kan oppnås ved å integrere klinisk bildebehandling og histologisk og molekylær mønster.
Noen ekstra posisjonsinformasjon går tapt ved å kollapse vaskulære veier. For eksempel kan en vaskulær koordinatsystem i utgangspunktet behandle alle glomerulus kapillærer i nyrene som den samme strukturen, potensielt maskering forskjeller i glomeruli på de overlegne og mindreverdige renale polene. Selv om vi lærer mer om de biomolekylære profilene til disse banene, kan vi iterativt avgrense vaskulær CCF over tid ved å dele veier inn i noen undertyper som oppdages.Til tross for disse begrensningene beholder et vaskulært koordinatsystem nok posisjonsinformasjon til å svare på mange typer forskningsspørsmål, ved å tillate forskere å lokalisere individuelle celler nøyaktig i funksjonelle enheter, vev og organer, eller sammenligne effekten av kontekst på ulike celletyper over hele kroppen på makro – og mesoskalaene.
Neste Trinn og Fremtidige Retninger
I Figur 1 presenterer Vi en svært forenklet og stilisert representasjon av vaskulær CCF for å introdusere det generelle konseptet. De faktiske vaskulære banene er langt mer komplekse, med full vaskulær CCF som til slutt består av hundrevis eller tusenvis av strukturer samt forgreningsmønstre som ikke følger en streng hub-og-talte layout. For eksempel vil venene i leverportalsystemet, som bærer blod fra flere organer til leveren, og sirkulasjonsanastomoser, som Sirkelen Av Willis i hjernen, løpe vinkelrett på og krysse over «eiker» I Figur 1.DEN vaskulære CCF vil også trenge å innlemme normale anatomiske varianter av vaskulaturen, som thyroidea ima og doble cystiske arterier, på samme måte som enkeltnukleotidpolymorfismer (SNPs) beskriver normale variasjoner i genomet. Når vi utvider og fyller ut detaljene i vaskulær CCF, kan det ta en mer snøfnugg eller web-lignende utseende, med sannsynligheter tildelt forskjellige seksjoner for å indikere sannsynligheten for å finne dem i en gitt person.den faktiske vaskulære CCF vil kreve et mer sofistikert kodesystem for å navngi fartøy enn Det som er vist I Figur 1, for å representere sin kompleksitet mer nøyaktig og gjøre den «computable» av programvarealgoritmer. En tilnærming er å bygge på eksisterende anatomiske ontologier, SOM UBERON, som allerede inneholder unike Uniform Resource Identifiers (Urier) for mange fartøy og definerer ulike relasjonstyper, for eksempel «branching_part_of», for å beskrive hvordan fartøy kobler seg sammen (25).
en celle kan være i nærheten av mer enn ett fartøy, i så fall er det mulig å tildele det en egen adresse i forhold til hvert fartøy. Fremtidig forskning er nødvendig for å avgjøre hva riktig» cutoff » avstand skal være. Det kan være ønskelig å lagre flere adresser for celler for å triangulere sin posisjon I 3D-rom.Selv om vår første motivasjon for en vaskulær CCF er å definere et koordinatsystem for å spesifisere plasseringen av celler, kan den nye radiale utformingen av menneskekroppen rundt karet, som vist i Figur 1, ha andre vitenskapelige anvendelser. For eksempel har posisjonsinformasjon innenfor denne rammen analogier til embryologisk utvikling og kan gi innsikt i mekanismer som forårsaker sykdom eller dysreguleringer som oppstår fra en gruppe celler. For eksempel i vaskulær CCF er makrovaskulære sykdommer forbundet med type 2 diabetes (f.eks. iskemisk hjertesykdom, perifer vaskulær sykdom og cerebrovaskulær sykdom) gruppert nær sentrum, mens mikrovaskulære sykdommer (f. eks. retinopati, nefropati og nevropati) danner en ring rundt utsiden (26).
Sammendrag
det vaskulære systemet har flere egenskaper som svarer til de egenskaper SOM TIDLIGERE ble ansett som ønskelige for EN CCF for å muliggjøre kartlegging av alle cellene i menneskekroppen (7). (1) det fungerer på tvers av flere skalaer. Gjennom et kontinuerlig endotel gjør det en sømløs overgang fra store anatomiske strukturer ned til mobilnivå. (2) det gjelder for alle kroppsvev. Fordi organer utvikler seg rundt fartøy, rammer vaskulaturen organarkitektur i alle skalaer. Vaskulære mønstre er så karakteristiske at bilder av fartøy alene, med alle andre celler fjernet, lett kan brukes til å identifisere organet. (3) det står for donorforskjeller. Vaskularisering tilpasser seg naturlig til individuelle variasjoner i vev, kroppsstørrelse og form. I stedet for å måtte kartlegge 3d-koordinatene til hver glomerulus i en person til de i en annen person, ville vaskulær CCF plassere hver celle i en representativ glomerulus kapillær fra hver person. (4) vaskulaturen er kjent for utøvere av mange forskjellige kliniske spesialiteter, og hjelper både med å diagnostisere sykdom og veilede operasjoner, og brukes som landemerker av patologer, radiologer og andre klinikere. Dette vil lette posisjonering av vevsprøver i kroppen og registrere plasseringen av individuelle celler. Selv om INGEN ENKELT CCF er ideell for alle brukstilfeller, definerer en vaskulær CCF et naturlig koordinatsystem som gjør det enkelt å kombinere biomolekylære data fra flere personer og stille biologisk relevante forskningsspørsmål.
Datatilgjengelighetserklæring
Offentlig tilgjengelige datasett ble analysert i denne studien. Disse dataene finner du her: https://www.proteinatlas.org.
Forfatterbidrag
GW unnfanget denne studien basert på rapporter fra 2017 CCF Møte og 2019 CCF Workshop. KB og YJ ga kritisk tilbakemelding. GW skrev det første utkastet, med ekstra tekst transkribert FRA CCFWS-01 lysbildepresentasjon. Alle forfattere bidro til å redigere manuskriptet.
Finansiering
denne forskningen ble støttet Av National Institutes Of Health (NIH) award OT2OD026671. DETTE arbeidet representerer IKKE den oppfatning AV NIH Eller National Heart, Lung, And Blood Institute (NHLBI).
Interessekonflikt
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller økonomiske forhold som kan tolkes som en potensiell interessekonflikt.
Bekreftelser
vi takker Dr. Zorina S. Galis fra National Institutes Of Health for å bidra til å utvikle ideen om et vaskulært koordinatsystem på CCF-Møtet i 2017 og CCF-Workshopen i 2019, gi oss presentasjoner fra disse hendelsene og delta i en rekke diskusjoner som danner grunnlaget for dette manuskriptet. Ekspertkommentarer fra anmelderne bidro til å avklare og detaljere det foreslåtte vaskulære baserte felles koordinatsystemet.
3. Uhlé M, Bjö E, Agaton C, Szigyarto CA, Amini B, Andersen E, Et al. Et humant proteinatlas for normalt og kreftvev basert på antistoffproteomikk. Mol Celle Proteomikk. (2005) 4:1920–32. doi: 10.1074 / mcp.M500279-MCP200
PubMed Abstrakt | CrossRef Full Tekst/Google Scholar
12. Vanlandewijck M, Han L, Mä MA, Andrae J, Ando K, Del Gaudio F, et al. En molekylær atlas av celletyper og sonering i hjernen vaskulatur. Natur. (2018) 554:475–80. doi: 10.1038/nature25739
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Johnson C, Sung HJ, Lessner SM, Fini ME, Galis ZS. Matrix metalloproteinase-9 is required for adequate angiogenic revascularization of ischemic tissues: potential role in capillary branching. Circ Res. (2004) 94:262–8. doi: 10.1161/01.RES.0000111527.42357.62
PubMed Abstract | CrossRef Full Text | Google Scholar
15. De Santis V, Sanger M. Vev oksygen spenning overvåking av organ perfusjon: begrunnelse, metoder, og litteratur gjennomgang. Br J Anaesth. (2015) 115:357–65. doi: 10.1093 / bja / aev162
PubMed Abstrakt | CrossRef Fulltekst / Google Scholar
17. Koch CJ. Måling av absolutte oksygennivåer i celler og vev ved hjelp av oksygensensorer OG 2-nitroimidazol EF5. Metoder Enzymol. (2002) 352:3–31. doi: 10.1016/S0076-6879(02)52003-6
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Paruchuri V, Salhab KF, Kuzmik G, Gubernikoff G, Fang H, Rizzo JA, et al. Aortic size distribution in the general population: explaining the size paradox in aortic dissection. Cardiology. (2015) 131:265–72. doi: 10.1159/000381281
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Abadi E, Segars WP, Sturgeon GM, Roos JE, Ravin CE, Samei E. Modellering av lungearkitektur i XCAT-serien av fantomer: fysiologisk baserte luftveier, arterier og årer. IEEE Trans Med Imaging. (2018) 37:693–702. doi: 10.1109 / TMI.2017.2769640
PubMed Abstrakt | CrossRef Fulltekst/Google Scholar
24. Majno P, Mentha G, Toso C, Morel P, Peitgen HO, Fasel JH. Anatomi i leveren: en oversikt med tre nivåer av kompleksitet – et ytterligere skritt mot skreddersydde territoriale leverreseksjoner. J Hepatol. (2014) 60:654–62. doi: 10.1016/j.jhep.2013.10.026
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Cade WT. Diabetes-related microvascular and macrovascular diseases in the physical therapy setting. Phys Ther. (2008) 88:1322–35. doi: 10.2522/ptj.20080008
PubMed Abstract | CrossRef Full Text | Google Scholar