The Universal Solvent
The Universal Solvent
dette er, selvfølgelig, en annen viktig egenskap av vann fordi flere stoffer oppløses i vann enn noen annen vanlig væske. Dette skyldes at det polare vannmolekylet forbedrer » Oppløsningskraften.»Oppløsning innebærer å bryte «salter» i komponent » ioner.»For Eksempel bryter NaCl (vanlig salt) Ned I ionene Na + Og Cl-på grunn av tiltrekningen for ioner (atomer eller grupper av atomer med ladning) til vannmolekyler er høy.
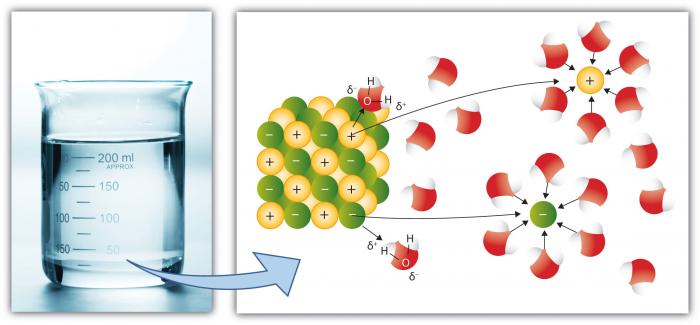
Kationer, Slik Som Na (Natrium) har en netto positiv ladning, mens anioner (Slik Som Cl, Klorid) har en netto negativ ladning. Det er mange individuelle elementer og forbindelser som danner ioner. Dermed kan vann holde betydelige konsentrasjoner av ulike kjemiske arter avhengig av deres spesielle egenskaper. Legg merke til hvordan vannmolekylene omgir de enkelte ioner, og holder dem isolert fra andre ioner i oppløsning. Dette skjer til vannets kapasitet til å isolere ioner overskrides, hvor løsningen er «mettet» med disse ioner og ikke kan oppløse mer (salt vil begynne å utfelle—danne et fast stoff).