Trifenylfosfin
PPh3 er mye brukt i organisk syntese. Egenskapene som styrer bruken er dens nukleofilitet og dens reduserende karakter. Nukleofiliteten Til PPh3 er indikert ved dens reaktivitet mot elektrofile alkener, som Michael-akseptorer og alkylhalogenider. Det brukes også i syntese av biarylforbindelser, slik Som Suzuki-reaksjonen.
QuaternizationEdit
PPh3 kombinerer med alkylhalogenider for å gi fosfoniumsalter. Funksjonen til kvaterniseringsreaksjonen følger det vanlige mønsteret der benzyl – og allylhalogenider er spesielt effektive reaktanter:
PPh3 + CH3I → + I –
disse saltene, som ofte kan isoleres som krystallinske faste stoffer, reagerer med sterke baser for å danne ylider:
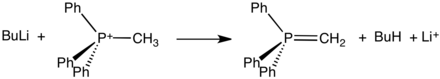
slike ylider er nøkkelreagenser i Wittig-reaksjonene, som brukes til å konvertere aldehyder og ketoner til alkener.
Arylhalogenider vil kvaternisere PPh3 for å gi tetrafenylfosfoniumsalter:
PPh3 + PhBr → Br
reaksjonen krever imidlertid forhøyede temperaturer og metallkatalysatorer .
Mitsunobu reaksjonrediger
I Mitsunobu-reaksjonen omdanner en blanding av trifenylfosfin og diisopropylazodikarboksylat («DIAD», ELLER DETS dietylanalog, DØD) en alkohol og en karboksylsyre til en ester. DIAD er redusert som det tjener som hydrogen akseptor, Og PPh3 oksyderes Til OPPh3.
Appelreaksjonendit
I Appelreaksjonen brukes en blanding Av PPh3 OG CX4 (X = Cl, Br) til å konvertere alkoholer til alkylhalogenider. Trifenylfosfinoksid (OPPh3) er et biprodukt.
PPh3 + CBr4 + RCH2OH → OPPh3 + RCH2Br + HCBr3
denne reaksjonen starter med nukleofilt angrep Av PPh3 På CBr4, en forlengelse av kvaterniseringsreaksjonen nevnt ovenfor.
DeoxygenationEdit
den enkle oksygenering Av PPh3 utnyttes i sin bruk for å deoxygenate organiske peroksider, som vanligvis oppstår med oppbevaring av konfigurasjon:
PPh3 + RO2H → OPPh3 + ROH (r = alkyl)
Det brukes også til dekomponering av organiske ozonider til ketoner og aldehyder, selv om dimetylsulfid er mer populært for reaksjonen som sideprodukt, blir dimetylsulfoksid lettere separert fra reaksjonsblandingen enn trifenylfosfinoksid. Aromatiske n-oksider reduseres til tilsvarende amin i høyt utbytte ved romtemperatur med bestråling:

SulfonationEdit
Sulfonering Av PPh3 gir tris (3-sulfofenyl)fosfin, P (C6H4-3-SO3 -) 3 (TPPT), vanligvis isolert som trisodium salt. I motsetning Til PPh3 er TPPTS vannløselige, som dets metallderivater. Rhodiumkomplekser AV TPPTER brukes i visse industrielle hydroformyleringsreaksjoner.

Reduksjon til difenylfosfidedit
Litium I THF samt Na eller K reagerer Med PPh3 for å gi Ph2PM(M = Li, Na, K). Disse saltene er allsidige forløpere til tertiære fosfiner. For eksempel reagerer 1,2-dibromoetan Og Ph2PM for Å gi Ph2PCH2CH2PPh2. Svake syrer slik ammoniumklorid, konvertere Ph2PM (M = Li, Na, K) til difenylfosfin:
(C6H5)2pm + H2O → (C6H5)2ph + MOH
Transition metal complexesEdit
Trifenylfosfin binder seg godt til de fleste overgangsmetaller, spesielt de i midten og sent overgangsmetaller i grupper 7-10. Når Det gjelder steric bulk, Har PPh3 En Tolman kjeglevinkel på 145°, som er mellom en mellomting mellom p(C6H11)3 (170°) og P(CH3)3 (115°). I en tidlig anvendelse i homogen katalyse Ble NiBr2 (PPh3)2 brukt Av Walter Reppe for syntese av akrylatestere fra alkyner, karbonmonoksid og alkoholer. Bruken Av PPh3 ble popularisert ved bruk i hydroformyleringskatalysatoren RhH (PPh3) 3 (CO).