Refissa
Generieke naam: tretinoïne
doseringsvorm: crème
medisch beoordeeld door Drugs.com. laatst bijgewerkt op 1 April 2020.
- overzicht
- bijwerkingen
- dosering
- professionele
- interacties
- meer
uitsluitend voor topisch gebruik in het gezicht.
- Refissa beschrijving
- Refissa – Klinische Farmacologie
- indicaties en gebruik voor Refissa
- gegevens uit klinische studies
- contra-indicaties
- waarschuwingen
- voorzorgsmaatregelen
- Algemeen
- informatie voor patiënten
- Drug Interactions
- carcinogenese, mutagenese, verminderde vruchtbaarheid
- zwangerschap
- zwangerschapscategorie C
- moeders die borstvoeding geven
- gebruik bij kinderen
- geriatrisch gebruik
- bijwerkingen
- overdosering
- Refissa Dosering en Administratie
- Hoe wordt Refissa geleverd
- opslag
- hoofdscherm-40 g buisdoos
- meer over Refissa (tretinoïne topicaal)
- consumer resources
- professionele resources
- gerelateerde behandelingsgidsen
Refissa beschrijving
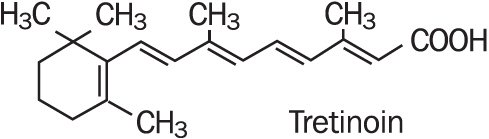
Refissa, bevat het werkzame bestanddeel tretinoïne (een retinoïde) in een verzachtende crème basis. Tretinoïne is een geel-oranje kristallijn poeder met een karakteristieke bloemengeur. Tretinoin is oplosbaar in dimethylsulfoxide, lichtjes oplosbaar in polyethyleenglycol 400, octanol, en 100% ethanol. Het is praktisch onoplosbaar in water en minerale olie, en het is onoplosbaar in glycerine. De chemische naam voor tretinoïne is (all-E)-3,7-dimethyl-9-(2,6,6-trimethyl-1-cyclonexen-1-yl) – 2,4,6,8-nonatetraeenzuur. Tretinoïne wordt ook bedoeld als all-trans-retinoic zuur en heeft een molecuulgewicht van 300,44. De structuurformule wordt hieronder weergegeven.
Refissa bevat tretinoïne in een concentratie van 0.05% w/w in a water-in-oil emulsion formulation consisting of light mineral oil, sorbitol solution, hydroxyoctacosanyl hydroxystearate; methoxy PEG-22/dodecyl glycol copolymer, PEG-45/dodecyl glycol copolymer, stearoxytrimethylsilane and stearyl alcohol, dimethicone 50 cs, methylparaben, edetate disodium, propylparaben, butylated hydroxytoluene, citric acid monohydrate, and purified water.
Refissa – Klinische Farmacologie
het exacte werkingsmechanisme van tretinoïne is onbekend, hoewel wordt aangenomen dat retinoïden een effect hebben op de groei en differentiatie van verschillende epitheliale cellen. Wanneer toegepast topically, echter, was er geen vastgestelde verhoging van desmosine, hydroxyproline, of elastine mRNA in menselijke huid. Bovendien is de rol van het irriterende karakter van dit product bij het effect van de positieve effecten toegeschreven aan dit product voor zijn indicatie nog niet volledig vastgesteld.
de transdermale absorptie van tretinoïne uit verschillende topische formuleringen varieerde van 1% tot 31% van de toegediende dosis, afhankelijk van of het werd aangebracht op een gezonde huid of op de dermatitische huid. Wanneer de percutane absorptie van tretinoïne crème, usp (verzachtend middel) 0,05% werd beoordeeld bij gezonde mannelijke proefpersonen (n=14) na een enkele toediening en na herhaalde dagelijkse toediening gedurende 28 dagen, was de absorptie van tretinoïne minder dan 2% en bleven de endogene concentraties van tretinoïne en de belangrijkste metabolieten onveranderd.
indicaties en gebruik voor Refissa
(om de indicatie voor dit product volledig te begrijpen, lees dan het volledige gedeelte indicaties en gebruik van de etikettering.)
Refissa is geïndiceerd als adjuvant (zie tweede gedachtestreepje hieronder) voor gebruik bij de mitigatie (palliatie) van fijne rimpels, gevlekte hyperpigmentatie en tactiele ruwheid van de gezichtshuid bij patiënten die geen dergelijke palliatie bereiken met behulp van uitgebreide huidverzorgings-en zonvermijdingsprogramma ‘ s (zie bullet 3 voor populaties waarin de werkzaamheid niet is vastgesteld). Refissa elimineert geen rimpels, repareert geen door de zon beschadigde huid, REVERSE PHOTOAGING of herstelt geen jonger of jonger HUIDHISTOLOGISCH patroon. Veel patiënten bereiken gewenste palliatieve effecten op fijne rimpels, gevlekte hyperpigmentatie en tactiele ruwheid van gezichtshuid met het gebruik van uitgebreide huidverzorging en zonvermijdingsprogramma ‘ s met inbegrip van zonnebrandmiddelen, beschermende kleding en verzachtende crèmes die geen tretinoïne bevatten.
- Tretinoïnecrème, USP (verzachtend middel) 0.05% heeft geen verzachtend EFFECT aangetoond op significante tekenen van chronische blootstelling aan de zon, zoals grove of diepe rimpels, vergeling van de huid, lentigines, telangiectasia, huidlaxiteit, keratinocytaire atypie, melanocytaire atypie of huidelastose.
- Refissa dient onder medisch toezicht te worden gebruikt als aanvulling op een uitgebreid huidverzorgings-en zonvermijdingsprogramma dat het gebruik van effectieve zonnebrandmiddelen (minimale SPF van 15) en beschermende kleding omvat wanneer de gewenste resultaten op fijne rimpels, gevlekte hyperpigmentatie en ruwheid van de gezichtshuid niet zijn bereikt met een uitgebreid huidverzorgings-en zonvermijdingsprogramma alleen.
- De werkzaamheid van Refissa bij het verminderen van fijne rimpels, gevlekte hyperpigmentatie en tactiele ruwheid van de gezichtshuid is niet vastgesteld bij mensen ouder dan 50 jaar of bij mensen met matig tot zwaar gepigmenteerde huid. Bovendien werden patiënten met zichtbare actinische keratosen en patiënten met een voorgeschiedenis van huidkanker uitgesloten van klinische studies met tretinoïne crème, usp (verzachtend middel) 0,05%. De werkzaamheid en veiligheid van Refissa bij deze populaties zijn op dit moment dus niet bekend.
- noch de veiligheid noch de werkzaamheid van Refissa voor de preventie of behandeling van actinische keratosen of huidneoplasmata zijn vastgesteld.
- noch de veiligheid noch de werkzaamheid van het dagelijks gebruik van Refissa gedurende langer dan 48 weken is vastgesteld, en dagelijks gebruik langer dan 48 weken is niet systematisch en histologisch onderzocht in adequate en goed gecontroleerde onderzoeken. (Zie Rubriek waarschuwingen.)
gegevens uit klinische studies
twee adequate en goed gecontroleerde studies werden uitgevoerd met in totaal 161 Evalueerbare patiënten (jonger dan 50 jaar) die werden behandeld met Tretinoïnecrème, usp (verzachtend middel) 0,05% en 154 Evalueerbare patiënten die gedurende 24 weken werden behandeld met de vehiculum verzachtend middel op het gezicht als aanvulling op een uitgebreid huidverzorgings-en zonvermijdingsprogramma, om de effecten op fijne rimpels, gevlekte hyperpigmentatie en voelbare ruwheid van de huid te beoordelen.. Patients were evaluated at baseline on a 10-point scale, and changes from that baseline rating were categorized as follows:
| No Improvement: | No change or an increase of 1 unit or more | |
| Minimal Improvement: | Reduction of 1 unit | |
| Moderate Improvement: | reductie van 2 eenheden of meer |
in deze onderzoeken werd aangenomen dat de fijne rimpels, gevlekte hyperpigmentatie en tactiele ruwheid van de gezichtshuid werden veroorzaakt door meerdere factoren waaronder intrinsieke veroudering of omgevingsfactoren, zoals chronische blootstelling aan de zon.
de resultaten van deze beoordelingen zijn als volgt:
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 36% | 40% | 24% |
| Vehicle + CSP | 62% | 30% | 8% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 35% | 27% | 38% |
| Vehicle + CSP | 53% | 21% | 27% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| * CSP= Comprehensive skin protection and sun avoidance programs included use of sunscreens, protective clothing, and emollient cream. | |||
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 49% | 35% | 16% |
| Voertuig + CSP | 67% | 23% | 10% |
de Meeste van de verbetering op deze borden werd opgemerkt tijdens de eerste 24 weken van de therapie. Daarna hield de therapie voornamelijk de verbetering in stand die gedurende de eerste 24 weken werd gerealiseerd.
een meerderheid van de patiënten zal de meest verzachtende effecten van Refissa op fijne rimpels, gevlekte hyperpigmentatie en tactiele ruwheid van de gezichtshuid verliezen bij stopzetting van een uitgebreid huidverzorgings-en zonvermijdingsprogramma, waaronder Refissa; de veiligheid en werkzaamheid van het dagelijks gebruik van Refissa gedurende langer dan 48 weken zijn echter niet vastgesteld.
contra-indicaties
dit geneesmiddel is gecontra-indiceerd bij personen met een voorgeschiedenis van gevoeligheidsreacties op een van de componenten. De behandeling dient te worden gestaakt als overgevoeligheid voor één van de bestanddelen wordt opgemerkt.
waarschuwingen
- Refissa is irriterend voor de huid en de resultaten van aanhoudende huidirritatie gedurende meer dan 48 weken bij chronisch langdurig gebruik zijn niet bekend. Er zijn aanwijzingen voor atypische veranderingen in melanocyten en keratinocyten, en van verhoogde huidelastose bij sommige patiënten behandeld met tretinoïne crème, USP (verzachtend) 0,05% gedurende langer dan 48 weken. De Betekenis van deze bevindingen is onbekend.
- veiligheid en werkzaamheid van Refissa bij personen met matig of zwaar gepigmenteerde huid zijn niet vastgesteld.
- Refissa mag niet worden toegediend als de patiënt ook geneesmiddelen gebruikt waarvan bekend is dat ze fotosensibilisatoren zijn (bijv. thiaziden, tetracyclinen, fluorochinolonen, fenothiazinen, sulfonamiden) vanwege de mogelijkheid van verhoogde fototoxiciteit.
vanwege een verhoogde brandgevoeligheid dient blootstelling aan zonlicht (inclusief zonnelampen) tijdens het gebruik van Refissa te worden vermeden of tot een minimum te worden beperkt. Patiënten moeten worden gewaarschuwd om zonnebrandmiddelen (minimum SPF van 15) en beschermende kleding te gebruiken wanneer ze Refissa gebruiken. Patiënten met zonnebrand dient te worden geadviseerd Refissa niet te gebruiken totdat zij volledig zijn hersteld. Patiënten die aanzienlijke blootstelling aan de zon kunnen hebben, bijvoorbeeld als gevolg van hun beroep en patiënten met een inherente gevoeligheid voor zonlicht, dienen bijzondere voorzichtigheid in acht te nemen bij het gebruik van Refissa en ervoor te zorgen dat de in de bijsluiter voor de patiënt beschreven voorzorgsmaatregelen in acht worden genomen.
tretinoïne crème, usp (verzachtend middel) 0,05% moet uit de ogen, mond, neushoeken en slijmvliezen worden gehouden. Het actuele gebruik kan streng lokaal erytheem, pruritus, het branden, het steken, en peeling op de plaats van toepassing veroorzaken. Als de mate van lokale irritatie dit rechtvaardigt, moeten patiënten worden geadviseerd om minder medicatie te gebruiken, de frequentie van toediening te verlagen, het gebruik Tijdelijk te staken of het gebruik helemaal te staken.van
is gemeld dat tretinoïne ernstige irritatie Veroorzaakt op de eczemateuze huid en dient alleen met voorzichtigheid te worden gebruikt bij patiënten met deze aandoening.
toediening van grotere hoeveelheden medicatie dan aanbevolen zal niet leiden tot snellere of betere resultaten, en duidelijke roodheid, schilfering of ongemak kan optreden.
voorzorgsmaatregelen
Algemeen
Refissa mag alleen worden gebruikt als aanvulling op een uitgebreid huidverzorgings-en zonvermijdingsprogramma. (Zie de rubriek indicaties en gebruik.)
indien zich een geneesmiddelgevoeligheid, chemische irritatie of een systemische bijwerking ontwikkelt, dient het gebruik van Refissa te worden gestaakt.
extreme weersomstandigheden, zoals wind of kou, kunnen irriterender zijn voor patiënten die Refissa gebruiken.
informatie voor patiënten
zie bijsluiter.
Drug Interactions
Gelijktijdig een actuele medicatie, medicinale of schurende zeep, shampoo, schoonmaakmiddelen, cosmetica met een sterk uitdrogend effect, producten met hoge concentraties van alcohol, reinigers, kruiden of kalk, permanent wave oplossingen, elektrolyse, haar ontharingsmiddelen of wassen, en producten die kunnen irriteren de huid moet met voorzichtigheid worden gebruikt bij patiënten die worden behandeld met Refissa omdat ze kunnen irritatie met Refissa.
Refissa mag niet worden toegediend als de patiënt ook geneesmiddelen gebruikt waarvan bekend is dat ze fotosensitizers zijn (bijv. thiaziden, tetracyclinen, fluorochinolonen, fenothiazinen, sulfonamiden) vanwege de mogelijkheid van verhoogde fototoxiciteit.
carcinogenese, mutagenese, verminderde vruchtbaarheid
In een levenslange dermale studie bij CD-1 muizen bij 100 en 200 maal de gemiddelde aanbevolen topische klinische dosis bij de mens werden enkele huidtumoren bij de vrouwtjesmuizen en levertumoren bij mannelijke muizen waargenomen. De biologische betekenis van deze bevindingen is niet duidelijk omdat ze optraden bij doses die de dermale maximaal getolereerde dosis (MTD) van tretinoïne overtroffen en omdat ze binnen de natuurlijke frequentie van het optreden van deze tumoren in deze stam van muizen vielen. Er was geen bewijs van carcinogeen potentieel wanneer tretinoïne topisch werd toegediend in een dosis die 5 maal de gemiddelde aanbevolen topische klinische dosis bij de mens was. Om de blootstelling van het dier te vergelijken met die van de mens, wordt de “aanbevolen topische klinische dosis bij de mens” gedefinieerd als 500 mg Refissa, dagelijks toegediend aan een persoon van 50 kg.
in een chronische, twee jaar durende bioassay van vitamine A-zuur bij muizen, uitgevoerd door Tsubura en Yamamoto, werd gegeneraliseerde amyloïddepositie gemeld in alle groepen in de basale laag van de met vitamine A behandelde huid. In CD – 1 muizen, een soortgelijke studie gemeld hyalinisatie van de behandelde huidplaatsen en de incidentie van deze bevinding was 0/50, 3/50, en 2/50 in mannelijke muizen en 1/50, 0/50, 4/50 en 2/50 in vrouwtjesmuizen uit de vehiculum controle, 0,25 mg/kg, 0,5 mg/kg, en 1 mg/kg groepen, respectievelijk.
Studies bij haarloze albinomuizen suggereren dat tretinoïne het tumorigene potentieel van carcinogene doses UVB-en UVA-licht van een solarsimulator kan versterken. In andere studies, toen licht gepigmenteerde haarloze muizen behandeld met tretinoïne werden blootgesteld aan carcinogene doses UVB-licht, werden de incidentie en snelheid van ontwikkeling van huidtumoren verminderd of werd er geen effect gezien. Als gevolg van aanzienlijk verschillende experimentele omstandigheden, geen strikte vergelijking van deze ongelijksoortige gegevens is mogelijk op dit moment. Hoewel de Betekenis van deze studies bij mensen niet duidelijk is, moeten patiënten blootstelling aan de zon tot een minimum beperken.
het mutagene potentieel van tretinoïne werd geëvalueerd in de Ames-test en in de in vivo micronucleus-test bij muizen, die beide negatief waren.
dermale Segment I en III studies met tretinoïne crème, usp (Emollient) 0,05% zijn bij geen enkele diersoort uitgevoerd. In orale Segment I-en Segment III-studies bij ratten met tretinoïne werd een verminderde overleving van pasgeborenen en groeivertraging waargenomen bij doses hoger dan 2 mg/kg/dag (>400 maal de gemiddelde topische klinische dosis bij de mens).
zwangerschap
teratogene effecten
zwangerschapscategorie C
orale tretinoïne is teratogeen gebleken bij ratten, muizen, konijnen, hamsters en submenselijke primaten. Het was teratogeen en foetotoxisch bij ratten wanneer het oraal of topisch werd toegediend in doses 1000 maal de gemiddelde aanbevolen topische klinische dosis bij de mens. Er zijn echter variaties in teratogene doses tussen verschillende stammen van ratten gemeld. Bij de cynomolgusaap, die metabolisch dichter bij de mens staat voor tretinoïne dan bij de andere onderzochte diersoorten, werden foetale misvormingen gemeld bij doses van 10 mg/kg/dag of hoger, maar geen enkele werd waargenomen bij doses van 5 mg/kg/dag (1000 maal de gemiddelde aanbevolen topische klinische dosis bij de mens), hoewel bij alle doses verhoogde skeletafwijkingen werden waargenomen. Er werd melding gemaakt van een dosisgerelateerde toename van embryoletaliteit en abortus. Vergelijkbare resultaten zijn ook gemeld bij varkensstaart makaken.
topische tretinoïne in dierproeven teratogeniciteit heeft onduidelijke resultaten opgeleverd. Er zijn aanwijzingen voor teratogeniciteit (verkorte of geknikte staart) van topische tretinoïne bij Wistar-ratten bij doses hoger dan 1 mg/kg/dag (200 maal de aanbevolen topische klinische dosis bij de mens). Anomalieën (opperarmbeen: kort 13%, gebogen 6%, OS pariëtaal onvolledig verbeend 14%) zijn ook gemeld wanneer 10 mg/kg/dag dermaal werd aangebracht.
Er zijn andere meldingen bij Nieuw-Zeelandse witte konijnen, toegediend met doses van ongeveer 80 maal de aanbevolen topische klinische dosis bij de mens, van een verhoogde incidentie van koepelhoofd en hydrocefalie, typisch voor door retinoïden geïnduceerde foetale misvormingen bij deze soort.
daarentegen hebben verscheidene goed gecontroleerde dierstudies aangetoond dat dermaal aangebracht tretinoïne bij respectievelijk ratten en konijnen niet teratogeen was bij doses van 100 en 200 maal de aanbevolen topische klinische dosis bij de mens.
bij wijdverbreid gebruik van om het even welk geneesmiddel, zou een klein aantal geboortetekortmeldingen die tijdelijk verband houden met de toediening van het geneesmiddel alleen door toeval worden verwacht. Dertig gevallen van tijdelijk-geassocieerde congenitale misvormingen zijn gemeld tijdens twee decennia van klinisch gebruik van een andere formulering van topische tretinoïne (Retin-A). Hoewel uit deze gevallen geen duidelijk patroon van teratogeniciteit en geen toevallige associatie is vastgesteld, beschrijven 5 van de rapporten de zeldzame geboortetekortcategorie holoprosencefalie (defecten geassocieerd met onvolledige ontwikkeling van de voorhersenen in de middellijn). De Betekenis van deze spontane meldingen in termen van risico voor de foetus is niet bekend.
niet-teratogene effecten
dermaal tretinoïne is foetotoxisch gebleken bij konijnen bij toediening in doses die 100 maal hoger zijn dan de aanbevolen topische klinische dosis bij de mens. Het is aangetoond dat oraal tretinoïne fetotoxisch is bij ratten wanneer het wordt toegediend in doses die 500 maal hoger zijn dan de aanbevolen topische humane klinische dosis.
er zijn echter geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. Refissa mag niet tijdens de zwangerschap worden gebruikt.
moeders die borstvoeding geven
Het is niet bekend of dit geneesmiddel wordt uitgescheiden in de moedermelk. Omdat veel geneesmiddelen in de moedermelk worden uitgescheiden, moet voorzichtigheid worden betracht wanneer Refissa wordt toegediend aan een vrouw die borstvoeding geeft.
gebruik bij kinderen
veiligheid en werkzaamheid bij patiënten jonger dan 18 jaar zijn niet vastgesteld.
geriatrisch gebruik
veiligheid en werkzaamheid bij personen ouder dan 50 jaar zijn niet vastgesteld.
bijwerkingen
(zie rubriek Wanneer moet u extra voorzichtig zijn met dit middel?)
in dubbelblinde, vehiculumgecontroleerde studies onder 179 patiënten die tretinoïne crème, usp (verzachtend middel) 0,05% op hun gezicht aandeden, bijwerkingen geassocieerd met het gebruik van tretinoïne crème, usp (verzachtend middel) 0,05% waren voornamelijk beperkt tot de huid. Tijdens deze studies moest 4% van de patiënten stoppen met het gebruik van tretinoïne crème, usp (verzachtend) 0,05% vanwege bijwerkingen. Deze stopzettingen waren het gevolg van huidirritatie of gerelateerde huidbijwerkingen.
lokale reacties zoals peeling, droge huid, branderig gevoel, stekend gevoel, erytheem en pruritus werden door bijna alle patiënten gemeld tijdens de behandeling met tretinoïne crème, usp (verzachtend middel) 0,05%. Deze tekenen en symptomen waren gewoonlijk licht tot matig ernstig en traden over het algemeen vroeg in de behandeling op. Bij de meeste patiënten kwamen de droogheid, peeling en roodheid terug na een initiële (24 weken) afname.
overdosering
toediening van grotere hoeveelheden medicatie dan aanbevolen heeft niet geleid tot snellere of betere resultaten en er kunnen opvallende roodheid, schilfering of ongemak optreden. Orale inname van het geneesmiddel kan leiden tot dezelfde bijwerkingen als die geassocieerd met overmatige orale inname van vitamine A.
Refissa Dosering en Administratie
- gebruik GEEN Refissa als de patiënt zwanger bent of probeert zwanger te worden of een hoog risico zwangerschap
- gebruik GEEN Refissa als de patiënt is verbrand of als de patiënt heeft last van eczeem of andere chronische huidaandoening(s)
- gebruik GEEN Refissa als de patiënt is inherent gevoelig voor zonlicht
- gebruik GEEN Refissa als de patiënt is ook het nemen van drugs bekend fotosensitizers (bijv., thiaziden, tetracyclines, fluorochinolonen, phenothiazines, sulfonamiden) vanwege de mogelijkheid van augmented fototoxicidad.
patiënten hebben gedetailleerde instructies nodig om maximale voordelen te verkrijgen en om alle voorzorgsmaatregelen te begrijpen die nodig zijn om dit product met de grootste veiligheid te gebruiken. De arts dient de bijsluiter van de patiënt te beoordelen.
Refissa dient eenmaal per dag vóór het terugtrekken op het gezicht te worden aangebracht, waarbij slechts voldoende wordt gebruikt om het gehele getroffen gebied licht te bedekken. Patiënten dienen hun gezicht voorzichtig te wassen met een milde zeep, de huid droog te deppen en 20 tot 30 minuten te wachten voordat Refissa wordt aangebracht. De patiënt dient een hoeveelheid crème ter grootte van een erwt aan te brengen om het hele gezicht licht te bedekken. Speciale voorzichtigheid is geboden bij het aanbrengen van de crème om de ogen, oren, neusgaten en mond te vermijden.
het aanbrengen van Refissa kan een tijdelijk warm gevoel of een licht stekend gevoel veroorzaken.
mitigatie (palliatie) van fijne rimpels in het gezicht, gevlekte hyperpigmentatie en tactiele ruwheid kan geleidelijk optreden tijdens de behandeling. Er kan tot zes maanden therapie nodig zijn voordat de effecten worden waargenomen. De grootste verbetering die bij Refissa werd waargenomen, werd waargenomen tijdens de eerste 24 weken van de behandeling. Daarna handhaaft de therapie voornamelijk de verbetering die tijdens de eerste 24 weken werd gerealiseerd.
bij stopzetting van de behandeling met Refissa zal een meerderheid van de patiënten de meest verzachtende effecten van Refissa op fijne rimpels, gevlekte hyperpigmentatie en tactiele ruwheid van de gezichtshuid verliezen; de veiligheid en werkzaamheid van het dagelijks gebruik van Refissa gedurende langer dan 48 weken zijn echter niet vastgesteld.
toediening van grotere hoeveelheden medicatie dan aanbevolen kan niet leiden tot snellere resultaten of betere resultaten, en opvallende roodheid, schilfering of ongemak kan optreden.
patiënten die met Refissa worden behandeld, mogen cosmetica gebruiken, maar de te behandelen gebieden moeten grondig worden gereinigd voordat de medicatie wordt aangebracht. (Zie rubriek voorzorgsmaatregelen.)
Hoe wordt Refissa geleverd
Refissa is verkrijgbaar in:
20 g tubes NDC 42851-012-20
40 g tubes NDC 42851-012-40
opslag
Bewaren bij 20-25°C (68-77°F). NIET IN DE VRIEZER BEWAREN.alleen
Rx.
gedrukt in de VS
140904-0118
vervaardigd door DPT Laboratories, San Antonio, TX 78215
gedistribueerd door ZO Skin Health, Inc., Irvine, CA 92618
Refissa®
alleen voor topisch gebruik op het gezicht
Wat is de belangrijkste informatie over Refissa ?
Refissa is een ernstig geneesmiddel. Het elimineert geen rimpels of herstelt de zon beschadigde huid. Het kan helpen bij de behandeling van fijne rimpels, vlekkerige verkleuring, en ruw gevoel huid, maar het niet “genezen” deze voorwaarden. Refissa mag alleen worden gebruikt onder toezicht van uw zorgverlener als onderdeel van een breed huidverzorgingsprogramma. Dit programma moet onder meer het vermijden van direct zonlicht (door het gebruik van beschermende kleding en zonnebrandmiddelen met een minimum SPF van 15) en het gebruik van andere hydraterende gezicht crèmes die geen tretinoïne bevatten.
U dient Refissa alleen voor het slapengaan te gebruiken. Gebruik geen droge huidverzorgingsproducten. Gebruik de kleinste hoeveelheid Refissa die nodig is en vermijd het in uw ogen, oren, neus of mond te krijgen.
waarschuwing: gebruik Refissa niet als u zwanger bent of probeert zwanger te worden. Vermijd zonlicht en andere geneesmiddelen die uw gevoeligheid voor zonlicht kunnen verhogen (zie hieronder).
Refissa is niet onderzocht bij mensen ouder dan 50 jaar of bij mensen met een matig of donker gepigmenteerde huid.
Wat is Refissa?
(wat kan Ik verwachten van Refissa?)
Refissa is een ernstig geneesmiddel dat fijne rimpels, vlekkerige huidverkleuring en een ruw gevoel van de huid kan helpen behandelen, maar niet zal “genezen”.
Studies tonen aan dat na 24 weken ongeveer 30% van de mensen die Tretinoïnecrème, usp (verzachtend middel) 0,05% voor fijne rimpels of vlekkerige verkleuring gebruikten, een matige verbetering vertoonde, nog eens 35% een minimale verbetering en 35% geen verbetering. Ongeveer 16% van de mensen die tretinoïne crème, usp (verzachtend) 0,05% voor ruwe huid gebruikt had matige verbetering, 35% had minimale verbetering, en 49% had geen verbetering. Er zijn geen aanwijzingen dat Refissa grove huid, diepe rimpels, gele huid of andere huidverzorgingsproblemen behandelt.
Refissa dient te worden gebruikt als onderdeel van een breed huidverzorgingsprogramma. Dit programma moet onder meer het vermijden van direct zonlicht (door het gebruik van beschermende kleding en zonnebrandmiddelen met een minimum SPF van 15) en het gebruik van andere hydraterende gezicht crèmes die geen tretinoïne bevatten. Veel mensen kunnen de gewenste effecten bereiken door dit programma te gebruiken zonder Refissa te gebruiken. U mag Refissa niet gebruiken voordat u een breed huidbehandelingsprogramma zonder Refissa heeft geprobeerd.
wanneer u Refissa gebruikt, is de verbetering van fijne rimpels, vlekkerige huidverkleuring en ruwe huid niet onmiddellijk en treedt deze geleidelijk op in de loop van de tijd. Over het algemeen kunt u enkele effecten opmerken in 3 tot 4 maanden. De effecten zijn meestal het meest merkbaar op ongeveer 6 maanden met weinig extra verbetering na die tijd. Als Refissa wordt gestopt, zal de verbetering geleidelijk afnemen.
de veiligheid van het dagelijks gebruik van Refissa gedurende meer dan 48 weken is niet vastgesteld.
wie mag Refissa niet gebruiken?
U mag Refissa niet gebruiken als u verbrand bent door de zon of zeer gevoelig bent voor de zon, als u eczeem heeft of als uw huid geïrriteerd is. Refissa kan verhoogde huidirritatie en verhoogde gevoeligheid voor zonnebrand veroorzaken.
aangezien Refissa uw huid gevoeliger kan maken voor zonlicht, moet u uw arts vertellen of u ook andere geneesmiddelen gebruikt die de gevoeligheid voor zonlicht verhogen, omdat u Refissa niet samen met deze geneesmiddelen mag gebruiken. Deze omvatten, maar zijn niet beperkt tot: thiaziden (gebruikt voor de behandeling van hoge bloeddruk), tetracyclines, fluorochinolnes of sulfonamiden (gebruikt voor de behandeling van infecties) en fenothiazinen (gebruikt voor de behandeling van ernstige emotionele problemen). Als u geneesmiddelen op recept gebruikt, geneesmiddelen zonder recept gebruikt of gezichtscrèmes gebruikt, neem dan contact op met een beroepsbeoefenaar in de gezondheidszorg om er zeker van te zijn dat deze geen interactie hebben met Refissa.
Zwangerschapswaarschuwing: veilig gebruik tijdens de zwangerschap is niet aangetoond. Er zijn meldingen van geboorteafwijkingen bij laboratoriumdieren en mensen die tretinoïne via de mond kregen. U mag Refissa niet gebruiken als u zwanger bent of probeert zwanger te worden.
Het is niet bekend of Refissa via de moedermelk wordt doorgegeven aan zuigelingen. Veilig gebruik bij kinderen is niet aangetoond.
De veiligheid en werkzaamheid van Refissa bij personen ouder dan 50 jaar of met een donkerdere huidskleur zijn niet bewezen.
Hoe moet ik Refissa gebruiken?
U dient Refissa eenmaal per dag aan te brengen op uw gezicht voordat u met pensioen gaat en alleen voldoende te gebruiken om het gehele getroffen gebied licht te bedekken. Was uw gezicht voorzichtig met een milde zeep, dep de huid droog en wacht 20 tot 30 minuten voordat Refissa wordt aangebracht. Breng een hoeveelheid crème ter grootte van een erwt aan om je hele gezicht te bedekken. U kunt een warmte of licht steken voelen wanneer Refissa voor het eerst wordt aangebracht.
u moet bijzonder voorzichtig zijn bij het aanbrengen van de crème om uw ogen, oren, neusgaten of mond te vermijden. Refissa kan ernstige roodheid, jeuk, brandend, stekend en peeling veroorzaken indien toegepast op deze gebieden.
het gebruik van Grotere dan noodzakelijke hoeveelheden Refissa zal de resultaten niet versnellen en kan een overdosis veroorzaken. Een overdosis kan leiden tot rode en peeling huid, evenals wat pijn of ongemak.
u mag cosmetica gebruiken na het aanbrengen van Refissa. Zorg ervoor dat u uw gezicht grondig reinigt voordat u Refissa opnieuw aanbrengt.
Wat moet ik vermijden tijdens het gebruik van Refissa?
Refissa verhoogt uw gevoeligheid voor zonlicht. Vermijd zonlicht zoveel mogelijk. Gebruik beschermende kleding en een zonnebrandcrème met een minimum SPF van 15. Niet zonnebaden of gebruik zonnehemels. Als u gevoelig bent voor zonlicht of een baan hebt die vereist dat u voor lange periodes in de zon bent, moet u uiterste voorzichtigheid gebruiken.
vermijd producten die de huid kunnen uitdrogen of irriteren tijdens het gebruik van Refissa. Vermijd bijvoorbeeld producten op de huid die alcohol, kruiden of kalk bevatten. Vermijd ook reinigingsmiddelen, ontharing of andere producten die de huid kunnen irriteren.
Wat zijn de mogelijke bijwerkingen van Refissa?
de meest voorkomende bijwerkingen zijn huidreacties. Jeuk, rode en droge huid zijn gemeld. Dus heb brandende, stekende en schilferende huid. Deze zijn meestal mild en komen het meest voor bij het starten van de behandeling.
Hoe kan ik aanvullende informatie krijgen?
Deze bijsluiter vatte de belangrijkste informatie over Refissa samen. Als u meer informatie wilt, neem dan contact op met uw arts of andere zorgverlener. Er is ook een folder geschreven voor gezondheidswerkers die uw apotheker voor u kan verstrekken.
bel uw arts voor medisch advies over bijwerkingen. U KUNT BIJWERKINGEN MELDEN AAN FDA OP 1-800-FDA-1088.
hoofdscherm-40 g buisdoos
NDC 42851-012-40
117471-0118
Refissa ®
Tretinoïnecrème,
USP (verzachtend middel) 0.05%
Rx Only
NET WT 40 g
FDA APPROVED

| Refissa TRETINOIN (EMOLLIENT) tretinoin cream |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
Labeler – ZO Skin Health, Inc. (826468527)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| DPT Laboratories, Ltd. | 832224526 | manufacture(42851-012) | |
meer over Refissa (tretinoïne topicaal)
- bijwerkingen
- Tijdens zwangerschap of borstvoeding
- doseringsinformatie
- geneesmiddelinteracties
- prijs & Coupons
consumer resources
- patiënteninformatie
- refissa topical (advanced reading)
professionele resources
- voorschrijfinformatie
- tretinoïne gel microsphere (FDA)
andere merken Retin-A, Renova, Atralin, altreno, … + 2 meer
gerelateerde behandelingsgidsen
- Fotoaging van de huid
medische Disclaimer