7.18: halogenuri de vinil și halogenuri de aril
substituție nucleofilă în halogenurile de aril
vom analiza în detaliu structura clorobenzenului. Bromobenzenul și iodobenzenul sunt la fel. Cel mai simplu mod de a desena structura clorobenzenului este:
pentru a înțelege corect clorobenzenul, trebuie să săpați un pic mai adânc decât asta. Există o interacțiune între electronii delocalizați din inelul benzenic și una dintre perechile singure de pe atomul de clor. Aceasta se suprapune cu sistemul electronic inelar delocalizat . . .
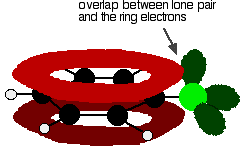
pentru a da o structură mai degrabă ca aceasta:
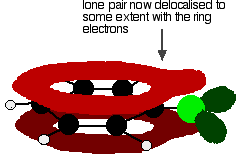
această delocalizare nu este în niciun caz completă, dar are un efect semnificativ asupra proprietăților atât ale clorului de carbon, cât și ale legătura și polaritatea moleculei. Delocalizarea introduce o legătură suplimentară între carbon și clor, făcând legătura mai puternică. Acest lucru are un efect major asupra reacțiilor compușilor precum clorobenzenul.
există, de asemenea, o mișcare a electronilor departe de clor spre inel. Clorul este destul de electronegativ și, de obicei, atrage electroni în legătura carbon-clor spre sine. În acest caz, acest lucru este compensat într-o oarecare măsură de mișcarea electronilor înapoi spre inel în delocalizare. Molecula este mai puțin polară decât v-ați fi așteptat altfel.
halogenurile simple de aril precum clorobenzenul sunt foarte rezistente la substituția nucleofilă. Este posibil să înlocuiți clorul cu-OH, dar numai în condiții industriale foarte severe – de exemplu la 200 C și 200 de atmosfere. În laborator, aceste reacții nu se întâmplă. Există două motive pentru aceasta-în funcție de care dintre mecanismele de mai sus vorbiți.
- rezistența suplimentară a legăturii carbon-halogen în halogenurile de aril: legătura carbon-clor din clorobenzen este mai puternică decât v-ați putea aștepta. Există o interacțiune între una dintre perechile singure de pe atomul de clor și electronii inelului delocalizat, ceea ce întărește legătura. Ambele mecanisme de mai sus implică ruperea legăturii carbon-halogen la un moment dat. Cu cât este mai dificil să se rupă, cu atât reacția va fi mai lentă.
- repulsia de către electronii inelului: acest lucru se va aplica numai dacă ionul hidroxid a atacat clorobenzenul printr-un mecanism ca primul descris mai sus. În acest mecanism, ionul hidroxid atacă carbonul ușor pozitiv la care este atașat atomul de halogen.Dacă atomul de halogen este atașat la un inel benzenic, ionul hidroxid de intrare va fi confruntat cu electronii inelului delocalizat deasupra și dedesubtul acelui atom de carbon. Ionul hidroxid negativ va fi pur și simplu respins. Acest mecanism special este pur și simplu un non-starter!