etichetă: MEGACE es – megestrol acetat suspensie
farmacologie clinică
există mai multe metode analitice utilizate pentru a estima concentrațiile plasmatice ale acetatului de megestrol, inclusiv cromatografie în masă-fragmentografie în masă (GC-MF), cromatografie lichidă de înaltă presiune (HPLC) și radioimunoanaliză (RIA). Metodele GC – MF și HPLC sunt specifice acetatului de megestrol și produc concentrații echivalente. Metoda RIA reacționează la metaboliții acetatului de megestrol și este, prin urmare, nespecifică și indică concentrații mai mari decât metodele GC-MF și HPLC. Concentrațiile plasmatice depind nu numai de metoda utilizată, ci și de inactivarea intestinală și hepatică a medicamentului, care poate fi afectată de factori precum motilitatea tractului intestinal, bacteriile intestinale, antibioticele administrate, greutatea corporală, dieta și funcția hepatică.
mecanism de acțiune
Mai mulți investigatori au raportat despre proprietatea de creștere a apetitului acetatului de megestrol și posibila utilizare a acestuia în cașexie. Mecanismul precis prin care acetatul de megestrol produce efecte în anorexie și cașexie nu este cunoscut în prezent.
Proprietăți farmacocinetice:
concentrațiile plasmatice ale acetatului de megestrol după administrarea a 625 mg (125 mg/mL) de suspensie orală Megace xixt ES sunt echivalente în condiții de hrănire cu 800 mg (40 mg/mL) de suspensie orală de megestrol acetat (vezi figura de mai jos).
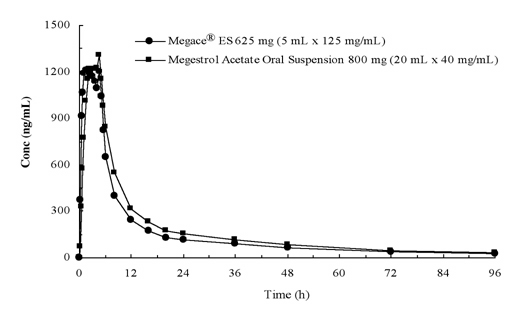
pentru a caracteriza proporționalitatea dozei de Megace XQC, s-au efectuat studii farmacocinetice pe o serie de doze atunci când au fost administrate în condiții de repaus alimentar și de hrană. Farmacocinetica megestrolului a fost liniară în intervalul de dozare cuprins între 150 mg și 675 mg după administrarea Megace xves, indiferent de starea mesei. Cmax și ASC în cazul unei mese bogate în lipide au crescut cu 48% și, respectiv, 36%, comparativ cu cele în condiții de repaus alimentar, după administrarea a 625 mg Megace xixt ES (Tabelul 1). Cu toate acestea, o masă bogată în grăsimi a crescut semnificativ ASC și Cmax de megestrol de 2 ori și, respectiv, de 7 ori, comparativ cu cele aflate în condiții de repaus alimentar după administrarea a 800 mg în formularea originală. Nu a existat nici o diferență în ceea ce privește siguranța după administrarea în statul fed, prin urmare Megace xves ar putea fi luat fără a ține cont de mese.
|
*megestrol acetate oral suspension |
||||||||||||||||
| Table 1 – Pharmacokinetic Studies Conducted with Megace® ES | ||||||||||||||||
| Amount Dosed | 150 mg | 250 mg | 375 mg | 450 mg | 575 mg | 625 mg | 675 mg | 800 mg* | ||||||||
| Dose | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 20 mL | ||||||||
| Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | |
| Cmax (ng/mL) | 412 | 379 | 647 | 588 | 810 | 958 | 955 | 1079 | – | 1421 | 1133 | 1618 | 1044 | 1616 | 187 | 1364 |
| AUC0-∞ (ng∙h/mL) | 3058 | 3889 | 5194 | 6328 | 7238 | 12193 | 9483 | 11800 | – | 14743 | 12095 | 16268 | 11879 | 17029 | 8942 | 18625 |
| Tmax (h) | 1.74 | 3.80 | 1.58 | 3.38 | 1.56 | 3.42 | 1.74 | 3.16 | – | 3.75 | 1.72 | 2.91 | 1.96 | 2.76 | 5.89 | 3.85 |
farmacocinetica plasmatică la starea de echilibru a acetatului de megestrol a fost evaluată la 10 pacienți adulți, bărbați cașectici, cu sindrom de imunodeficiență dobândită (SIDA) și o scădere involuntară în greutate mai mare de 10% din valoarea inițială. Pacienții au primit doze orale unice de 800 mg/zi de suspensie orală de acetat de megestrol timp de 21 de zile. Datele privind concentrația plasmatică obținute în ziua 21 au fost evaluate timp de până la 48 de ore după ultima doză.
concentrația plasmatică maximă medie (int.1SD) (Cmax) a acetatului de megestrol a fost de 753 (int. 539) ng / mL. Aria medie de sub curba concentrației plasmatice în funcție de timp (ASC) a fost de 10476 (7788) ng x oră/mL. Valoarea mediană a Tmax a fost de cinci ore. Șapte din 10 pacienți s-au îngrășat în trei săptămâni.
În plus, 24 de subiecți adulți, asimptomatici, seropozitivi HIV, au fost tratați o dată pe zi cu 750 mg suspensie orală de acetat de megestrol. Tratamentul a fost administrat timp de 14 zile. Valorile medii ale Cmax și ASC au fost de 490 (238) ng/mL, respectiv 6779 (3048) hr x ng/mL. Valoarea mediană a Tmax a fost de trei ore. Valoarea medie a Cmax a fost de 202 (101) ng/mL. Procentul mediu al valorii fluctuației a fost de 107 (40 la sută).metabolizarea metaboliților acetatului de Megestrol care au fost identificați în urină au constituit 5% până la 8% din doza administrată. Excreția respiratorie ca dioxid de carbon marcat și depozitarea grăsimilor ar fi putut reprezenta cel puțin o parte din radioactivitatea care nu se găsește în urină și fecale.
eliminare
calea principală de eliminare a medicamentului la om este urina. Când acetatul de megestrol marcat radioactiv a fost administrat la om în doze de 4 până la 90 mg, excreția urinară în decurs de 10 zile a variat de la 56,5% la 78,4% (medie 66,4%) și excreția fecală a variat de la 7,7% la 30,3% (medie 19,8%). Radioactivitatea totală recuperată a variat între 83,1% și 94,7% (media 86,2%).farmacocinetica acetatului de megestrol nu a fost studiată la nicio populație specială.
farmacologia și / sau Toxicologia animalelor
tratamentul pe termen lung cu Megace xixt ES (acetat de megestrol) poate crește riscul de infecții respiratorii. O tendință de creștere a frecvenței infecțiilor respiratorii, scăderea numărului de limfocite și creșterea numărului de neutrofile a fost observată într-un studiu de toxicitate cronică/carcinogenitate cu megestrol acetat, efectuat la șobolani, cu durata de doi ani.
descrierea studiilor clinice
Megestrol acetat suspensie orală la o doză de 800 mg/20 mL este echivalent cu 625 mg / 5 mL de Megace xves. Eficacitatea clinică a suspensiei orale de acetat de megestrol a fost evaluată în două studii clinice. Unul a fost un studiu multicentric, randomizat, dublu-orb, controlat cu placebo, care a comparat acetat de megestrol (MA) la doze de 100 mg, 400 mg și 800 mg pe zi față de placebo la pacienții cu SIDA cu anorexie/cașexie și pierdere semnificativă în greutate. Din cei 270 de pacienți incluși în studiu, 195 au îndeplinit toate criteriile de includere/excludere, au avut cel puțin două măsurători suplimentare ale greutății după momentul inițial pe o perioadă de 12 săptămâni sau au avut o măsurare a greutății după momentul inițial, dar au renunțat pentru eșec terapeutic. Procentul pacienților care au obținut cinci sau mai multe kilograme la creșterea maximă în greutate în 12 săptămâni de studiu a fost semnificativ statistic mai mare pentru grupurile tratate cu MA de 800 mg (64%) și 400 mg (57%) decât pentru grupul placebo (24%). Greutatea medie a crescut de la momentul inițial până la ultima evaluare în 12 săptămâni de studiu în grupul tratat cu MA de 800 mg cu 7.8 lire sterline, grupul de 400 mg MA cu 4,2 lire sterline, grupul de 100 mg MA cu 1,9 lire sterline și a scăzut în grupul placebo cu 1,6 lire sterline. Modificările medii ale greutății la 4, 8 și 12 săptămâni pentru pacienții evaluabili pentru eficacitate în cele două studii clinice sunt prezentate grafic. Modificările compoziției corporale în timpul celor 12 săptămâni de studiu, măsurate prin analiza impedanței bioelectrice, au arătat creșteri ale greutății corporale fără apă în grupurile tratate cu AM (vezi tabelul studiilor clinice). În plus, edemul sa dezvoltat sau sa agravat la numai 3 pacienți.
procente mai mari de pacienți tratați cu AM în grupul de 800 mg (89%), grupul de 400 mg (68%) și grupul de 100 mg (72%), decât în grupul placebo (50%), au arătat o îmbunătățire a apetitului alimentar la ultima evaluare pe parcursul celor 12 săptămâni de studiu. S-a observat o diferență semnificativă statistic între grupul tratat cu MA de 800 mg și grupul placebo în ceea ce privește modificarea aportului caloric de la momentul inițial la momentul modificării greutății maxime. Pacienții au fost rugați să evalueze schimbarea greutății, apetitul, aspectul și percepția generală a bunăstării într-un sondaj de 9 întrebări. La modificarea maximă a greutății, numai grupul tratat cu MA de 800 mg a dat răspunsuri care au fost semnificativ statistic mai favorabile tuturor întrebărilor în comparație cu grupul tratat cu placebo. Un răspuns la doză a fost observat în sondaj, cu răspunsuri pozitive corelate cu doze mai mari pentru toate întrebările.
al doilea studiu a fost un studiu multicentric, randomizat, dublu-orb, controlat cu placebo, care a comparat acetat de megestrol 800 mg/zi față de placebo la pacienții cu SIDA cu anorexie / cașexie și pierdere semnificativă în greutate. Din cei 100 de pacienți incluși în studiu, 65 au îndeplinit toate criteriile de includere/excludere, au avut cel puțin două măsurători suplimentare ale greutății după momentul inițial pe o perioadă de 12 săptămâni sau au avut o măsurare a greutății după momentul inițial, dar au renunțat pentru eșec terapeutic. Pacienții din grupul tratat cu MA de 800 mg au prezentat o creștere semnificativ statistic mai mare a modificării medii a greutății maxime decât pacienții din grupul placebo. De la momentul inițial până la Săptămâna de studiu 12, greutatea medie a crescut cu 11,2 lire sterline în grupul tratat cu MA și a scăzut cu 2,1 lire sterline în grupul placebo. Modificările compoziției corporale măsurate prin analiza impedanței bioelectrice au arătat creșteri ale greutății non-apă în grupul tratat cu MA (vezi tabelul studiilor clinice). Nu a fost raportat edem în grupul tratat cu MA. Un procent mai mare de pacienți tratați cu AM (67%) decât pacienții tratați cu placebo (38%) au prezentat o îmbunătățire a apetitului la ultima evaluare pe parcursul celor 12 săptămâni de studiu; această diferență a fost semnificativă statistic. Nu au existat diferențe semnificative statistic între grupurile de tratament în ceea ce privește modificarea calorică medie sau aportul caloric zilnic la momentul până la modificarea maximă a greutății. În același sondaj de 9 întrebări la care se face referire în primul studiu, evaluările pacienților privind modificarea greutății, apetitul, aspectul și percepția generală a bunăstării au arătat creșteri ale scorurilor medii la pacienții tratați cu MA comparativ cu grupul placebo.
în ambele studii, pacienții au tolerat bine medicamentul și nu s-au observat diferențe semnificative statistic între grupurile de tratament în ceea ce privește anomaliile de laborator, noile infecții oportuniste, numărul limfocitelor, numărul T4, numărul T8 sau testele de reactivitate cutanată (vezi secțiunea ADVERSEREACTIONS).
| Megestrol Acetate Oral Suspension Clinical Efficacy Trials | |||||||
| Trial 1 | Trial 2 | ||||||
| Study Accrual Dates | Study Accrual Dates | ||||||
| 11/88 to 12/90 | 5/89 to 4/91 | ||||||
| Megestrol Acetate, mg/day | 0 | 100 | 400 | 800 | 0 | 800 | |
| Entered Patients | 38 | 82 | 75 | 75 | 48 | 52 | |
| Evaluable Patients | 28 | 61 | 53 | 53 | 29 | 36 | |
| Mean Change in Weight (lb.) | |||||||
| Baseline to 12 Weeks | 0.0 | 2.9 | 9.3 | 10.7 | -2.1 | 11.2 | |
| % Patients ≥ 5 Pound Gain | |||||||
| At Last Evaluation in 12 weeks | 21 | 44 | 57 | 64 | 28 | 47 | |
| Mean Changes in Body Composition: | |||||||
| Fat Body Mass (lb.) | 0.0 | 2.2 | 2.9 | 5.5 | 1.5 | 5.7 | |
| Lean Body Mass (lb.) | -1.7 | -0.3 | 1.5 | 2.5 | -1.6 | -0.6 | |
| Water (liters) | -1.3 | -0.3 | 0.0 | 0.0 | -0.1 | -0.1 | |
| % Patients With Improved Appetite: | |||||||
| At Time of Maximum Weight Change | 50 | 72 | 72 | 93 | 48 | 69 | |
| At Last Evaluation in 12 Weeks | 50 | 72 | 68 | 89 | 38 | 67 | |
| Mean Change in Daily Caloric Intake: | |||||||
| Baseline to Time of Maximum Weight Change | -107 | 326 | 308 | 646 | 30 | 464 | |
| *Based on bioelectrical impedance analysis determinations at last evaluation in 12 weeks |
Presented below are the results of mean weight changes for patients evaluable for efficacy in trials 1 and 2.