Refissa
nume Generic: tretinoin
forma de dozare: crema
Medical revizuite de Drugs.com. Ultima actualizare la 1 aprilie 2020.
- Prezentare generală
- efecte secundare
- dozare
- profesional
- interacțiuni
- mai multe
pentru utilizare topică numai pe față.
- Refissa descriere
- Refissa – Farmacologie Clinică
- indicații și utilizare pentru Refissa
- date din studiile clinice
- contraindicații
- avertismente
- Precauții
- General
- informații pentru pacienți
- interacțiuni medicamentoase
- carcinogeneza, mutageneza, afectarea fertilității
- sarcina
- sarcina categoria C
- mamele care alăptează
- utilizare pediatrică
- utilizare geriatrică
- reacții Adverse
- supradozajul
- Refissa dozare și Administrare
- cum se livrează Refissa
- depozitare
- panou de afișare PRINCIPAL – cutie de tub de 40 g
- mai multe despre Refissa (tretinoin topic)
- resurse pentru consumatori
- resurse profesionale
- ghiduri de tratament conexe
Refissa descriere
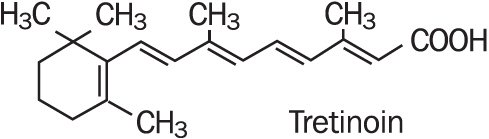
Refissa , conține ingredientul activ tretinoin (un retinoid) într-o bază cremă emolientă. Tretinoina este o pulbere cristalină galben-portocalie având un miros floral caracteristic. Tretinoina este solubilă în dimetilsulfoxid, ușor solubilă în polietilen glicol 400, octanol și 100% etanol. Este practic insolubil în apă și ulei mineral și este insolubil în glicerină. Denumirea chimică pentru tretinoină este acidul(all-e)-3,7-dimetil-9-(2,6,6-Trimetil-1-ciclonexen-1-il)-2,4,6,8-nonatetraenoic. Tretinoina este denumită și acid all-trans-retinoic și are o greutate moleculară de 300,44. Formula structurală este reprezentată mai jos.
Refissa conține tretinoină la o concentrație de 0.05% w/w in a water-in-oil emulsion formulation consisting of light mineral oil, sorbitol solution, hydroxyoctacosanyl hydroxystearate; methoxy PEG-22/dodecyl glycol copolymer, PEG-45/dodecyl glycol copolymer, stearoxytrimethylsilane and stearyl alcohol, dimethicone 50 cs, methylparaben, edetate disodium, propylparaben, butylated hydroxytoluene, citric acid monohydrate, and purified water.
Refissa – Farmacologie Clinică
mecanismul exact de acțiune al tretinoinei nu este cunoscut, deși se crede că retinoizii exercită un efect asupra creșterii și diferențierii diferitelor celule epiteliale. Cu toate acestea, atunci când se aplică local, nu s-a observat o creștere a desmozinei, hidroxiprolinei sau elastinei ARNm în pielea umană. În plus, rolul naturii iritante a acestui produs în efectuarea efectelor pozitive atribuite acestui produs pentru indicarea sa nu a fost încă pe deplin determinat.
absorbția transdermică a tretinoinei din diferite formulări topice a variat de la 1% la 31% din doza aplicată, în funcție de faptul dacă a fost aplicată pe pielea sănătoasă sau pe pielea dermatită. Când absorbția percutanată a cremei de tretinoină, USP (emolient) 0,05% a fost evaluată la subiecți sănătoși de sex masculin (n=14) după o singură aplicare, precum și după aplicații zilnice repetate timp de 28 de zile, absorbția tretinoinei a fost mai mică de 2%, iar concentrațiile endogene de tretinoină și principalii săi metaboliți au fost neschimbate.
indicații și utilizare pentru Refissa
(pentru a înțelege pe deplin indicația pentru acest produs, vă rugăm să citiți întreaga secțiune indicații și utilizare a etichetării.)
Refissa este indicat ca agent adjuvant (Vezi al doilea punct de mai jos) pentru utilizarea în atenuarea (paliația) ridurilor fine, hiperpigmentarea pestriță și rugozitatea tactilă a pielii faciale la pacienții care nu realizează o astfel de paliație folosind programe cuprinzătoare de îngrijire a pielii și de evitare a soarelui (vezi bullet 3 pentru populațiile în care eficacitatea nu a fost stabilită). Refissa nu elimină ridurile, nu repară pielea afectată de soare, nu inversează fotoîmbătrânirea sau nu restabilește un model histologic dermic mai tânăr sau mai tânăr. Mulți pacienți obțin efecte paliative dorite asupra ridurilor fine, hiperpigmentării pestrițe și rugozității tactile a pielii faciale cu utilizarea unor programe cuprinzătoare de îngrijire a pielii și de evitare a soarelui, inclusiv Protecții solare, îmbrăcăminte de protecție și creme emoliente care nu conțin tretinoină.
- cremă de tretinoină, USP (emolient) 0.05% nu a demonstrat niciun efect atenuant asupra semnelor semnificative de expunere cronică la soare, cum ar fi încrețirea grosieră sau profundă, îngălbenirea pielii, lentigine, telangiectazie, laxitate cutanată, atipie keratinocitară, atipie melanocitară sau elastoză dermică.
- Refissa trebuie utilizat sub supraveghere medicală ca adjuvant la un program cuprinzător de îngrijire a pielii și de evitare a soarelui care include utilizarea de produse de protecție solară eficiente (SPF minim de 15) și îmbrăcăminte de protecție atunci când rezultatele dorite privind ridurile fine, hiperpigmentarea pestriță și rugozitatea pielii faciale nu au fost obținute doar cu un program cuprinzător de îngrijire a pielii și de evitare a soarelui.
- eficacitatea Refissa în atenuarea ridurilor fine, hiperpigmentarea pătată și rugozitatea tactilă a pielii faciale nu a fost stabilită la persoanele cu vârsta mai mare de 50 de ani sau la persoanele cu piele moderat până la puternic pigmentată. În plus, pacienții cu keratoză actinică vizibilă și pacienții cu antecedente de cancer de piele au fost excluși din studiile clinice cu cremă de tretinoină, USP (emolient) 0,05%. Astfel, eficacitatea și siguranța Refissa la aceste populații nu sunt cunoscute în acest moment.
- nici siguranța, nici eficacitatea Refissa pentru prevenirea sau tratamentul keratozelor actinice sau neoplasmelor cutanate nu au fost stabilite.
- nici siguranța și nici eficacitatea utilizării Refissa zilnic timp de mai mult de 48 de săptămâni nu au fost stabilite, iar utilizarea zilnică peste 48 de săptămâni nu a fost investigată sistematic și histologic în studii adecvate și bine controlate. (Vezi secțiunea avertismente.)
date din studiile clinice
au fost efectuate două studii adecvate și bine controlate care au implicat un total de 161 de pacienți evaluabili (Sub 50 de ani) tratați cu cremă tretinoină, USP (emolient) 0,05% și 154 de pacienți evaluabili tratați cu crema emolientă vehicul pe față timp de 24 de săptămâni ca adjuvant la un program cuprinzător de îngrijire a pielii și de evitare a soarelui, pentru a evalua efectele asupra ridurilor fine, hiperpigmentării pătate și rugozitatea pielii. Patients were evaluated at baseline on a 10-point scale, and changes from that baseline rating were categorized as follows:
| No Improvement: | No change or an increase of 1 unit or more | |
| Minimal Improvement: | Reduction of 1 unit | |
| Moderate Improvement: | reducerea a 2 unități sau mai mult |
în aceste studii, ridurile fine, hiperpigmentarea pestriță și rugozitatea tactilă a pielii faciale au fost considerate a fi cauzate de mai multe factori care au inclus îmbătrânirea intrinsecă sau factori de mediu, cum ar fi expunerea cronică la soare.
rezultatele acestor evaluări sunt următoarele:
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 36% | 40% | 24% |
| Vehicle + CSP | 62% | 30% | 8% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 35% | 27% | 38% |
| Vehicle + CSP | 53% | 21% | 27% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| * CSP= Comprehensive skin protection and sun avoidance programs included use of sunscreens, protective clothing, and emollient cream. | |||
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 49% | 35% | 16% |
| vehicul + CSP | 67% | 23% | 10% |
majoritatea ameliorării acestor semne a fost observată în primele 24 de săptămâni de tratament. Ulterior, terapia a menținut în primul rând îmbunătățirea realizată în primele 24 de săptămâni.
majoritatea pacienților vor pierde cele mai atenuante efecte ale Refissa asupra ridurilor fine, hiperpigmentării pătate și rugozității tactile a pielii faciale, cu întreruperea unui program cuprinzător de îngrijire a pielii și de evitare a soarelui, inclusiv Refissa; cu toate acestea, siguranța și eficacitatea utilizării Refissa zilnic timp de mai mult de 48 de săptămâni nu au fost stabilite.
contraindicații
acest medicament este contraindicat la persoanele cu antecedente de reacții de sensibilitate la oricare dintre componentele sale. Trebuie întrerupt dacă se observă hipersensibilitate la oricare dintre ingredientele sale.
avertismente
- Refissa este un iritant dermic, iar rezultatele iritației continue a pielii pentru mai mult de 48 de săptămâni în utilizarea cronică pe termen lung nu sunt cunoscute. Există dovezi ale modificărilor atipice ale melanocitelor și keratinocitelor și ale elastozei dermice crescute la unii pacienți tratați cu cremă de tretinoină, USP (emolient) 0,05% pentru mai mult de 48 de săptămâni. Semnificația acestor constatări este necunoscută.
- siguranța și eficacitatea Refissa la persoanele cu piele moderat sau puternic pigmentată nu au fost stabilite.
- Refissa nu trebuie administrată dacă pacientul ia și medicamente cunoscute a fi fotosensibilizante (de exemplu, tiazide, tetracicline, fluorochinolone, fenotiazine, sulfonamide) din cauza posibilității de fototoxicitate mărită.
Din cauza sensibilității crescute la ardere, expunerea la lumina soarelui (inclusiv lămpile solare) trebuie evitată sau minimizată în timpul utilizării Refissa. Pacienții trebuie avertizați să utilizeze produse de protecție solară (SPF minim de 15) și îmbrăcăminte de protecție atunci când utilizează Refissa. Pacienții cu arsuri solare trebuie sfătuiți să nu utilizeze Refissa până la recuperarea completă. Pacienții care pot avea o expunere considerabilă la soare, de exemplu datorită ocupației lor și acei pacienți cu sensibilitate inerentă la lumina soarelui, trebuie să manifeste o precauție deosebită atunci când utilizează Refissa și să se asigure că sunt respectate măsurile de precauție prezentate în prospectul pacientului.
tretinoin Cream, USP (emolient) 0,05% trebuie ținut departe de ochi, gură, unghiuri ale nasului și mucoase. Utilizarea topică poate provoca eritem local sever, prurit, arsură, înțepătură și peeling la locul de aplicare. Dacă gradul de iritare locală justifică, pacienții trebuie îndrumați să utilizeze mai puține medicamente, să scadă frecvența aplicării, să întrerupă temporar utilizarea sau să întrerupă utilizarea cu totul.
s-a raportat că tretinoina provoacă iritații severe pe pielea eczematoasă și trebuie utilizată numai cu precauție la pacienții cu această afecțiune.
aplicarea unor cantități mai mari de medicamente decât cele recomandate nu va duce la rezultate mai rapide sau mai bune și pot apărea roșeață marcată, peeling sau disconfort.
Precauții
General
Refissa trebuie utilizat numai ca adjuvant la un program cuprinzător de îngrijire a pielii și de evitare a soarelui. (Vezi secțiunea indicații și utilizare.)
Dacă apare o sensibilitate la medicament, iritație chimică sau o reacție adversă sistemică, utilizarea Refissa trebuie întreruptă.
condițiile meteorologice extreme, cum ar fi vântul sau frigul, pot fi mai iritante pentru pacienții care utilizează Refissa.
informații pentru pacienți
vezi prospectul pacientului.
interacțiuni medicamentoase
medicamentele topice concomitente, săpunurile medicamentoase sau abrazive, șampoanele, produsele de curățare, produsele cosmetice cu efect puternic de uscare, produsele cu concentrații mari de alcool, astringenții, condimentele sau varul, soluțiile permanente de undă, electroliza, depilatoarele de păr sau cerurile și produsele care pot irita pielea trebuie utilizate cu precauție la pacienții tratați cu Refissa, deoarece pot crește iritarea cu Refissa.
Refissa nu trebuie administrată dacă pacientul ia și medicamente cunoscute ca fiind fotosensibilizante (de ex., tiazide, tetracicline, fluorochinolone, fenotiazine, sulfonamide) datorită posibilității de fototoxicitate mărită.
carcinogeneza, mutageneza, afectarea fertilității
într-un studiu dermic pe viață la șoareci CD-1 la 100 și 200 de ori doza clinică locală medie recomandată la om, au fost observate câteva tumori ale pielii la șoareci femele și tumori hepatice la șoareci masculi. Semnificația biologică a acestor constatări nu este clară deoarece au apărut la doze care au depășit doza maximă tolerată dermică (MTD) de tretinoină și pentru că au fost în fundal rata naturală de apariție a acestor tumori la această tulpină de șoareci. Nu au existat dovezi de potențial carcinogen atunci când tretinoina a fost administrată topic la o doză de 5 ori mai mare decât doza clinică locală recomandată la om. În scopul comparării expunerii la animale cu expunerea la om,” doza clinică topică recomandată la om ” este definită ca 500 mg Refissa aplicată zilnic la o persoană de 50 kg.
într-o biotestare cronică, de doi ani, a acidului vitaminei A la șoareci efectuată de Tsubura și Yamamoto, a fost raportată depunerea generalizată de amiloid în toate grupurile din stratul bazal al pielii tratate cu vitamina A. La șoarecii CD-1, Un studiu similar a raportat hialinizarea locurilor de piele tratate, iar incidența acestei constatări a fost de 0/50, 3/50 și 2/50 la șoarecii masculi și 1/50, 0/50, 4/50 și 2/50 la șoarecii femele din grupul martor al vehiculului, 0,25 mg/kg, 0,5 mg/kg și, respectiv, 1 mg/kg.
studiile efectuate la șoareci albinoși fără păr sugerează că tretinoina poate spori potențialul tumorigen al dozelor cancerigene de lumină UVB și UVA de la un simulator solar. În alte studii, când șoarecii fără păr ușor pigmentați tratați cu tretinoină au fost expuși la doze cancerigene de lumină UVB, incidența și rata de dezvoltare a tumorilor cutanate au fost fie reduse, fie nu s-a observat niciun efect. Datorită condițiilor experimentale semnificativ diferite, nu este posibilă o comparație strictă a acestor date disparate în acest moment. Deși semnificația acestor studii la om nu este clară, pacienții ar trebui să reducă la minimum expunerea la soare.
potențialul mutagen al tretinoinei a fost evaluat în testul Ames și in vivo în testul micronucleilor de șoarece, ambele fiind negative.
studiile de Segment I și III dermice cu cremă de tretinoină, USP (emolient) 0,05% nu au fost efectuate la nicio specie. În studiile orale de Segment I și segment III la șobolani cu tretinoină, supraviețuirea scăzută a nou-născuților și întârzierea creșterii au fost observate la doze mai mari de 2 mg/kg și zi (>de 400 de ori doza clinică locală medie la om).
sarcina
efecte teratogene
sarcina categoria C
tretinoina orală s-a dovedit a fi teratogenă la șobolani, șoareci, iepuri, hamsteri și primate subumane. A fost teratogen și fetotoxic la șobolani atunci când a fost administrat oral sau local în doze de 1000 de ori mai mari decât doza clinică locală recomandată la om. Cu toate acestea, au fost raportate variații ale dozelor teratogene la diferite tulpini de șobolani. La maimuța cynomolgus, care, din punct de vedere metabolic, este mai aproape de om pentru tretinoină decât celelalte specii examinate, malformațiile fetale au fost raportate la doze de 10 mg/kg și zi sau mai mari, dar nu au fost observate la doze de 5 mg/kg și zi (de 1000 de ori doza clinică locală recomandată la om), deși au fost observate variații scheletice crescute la toate dozele. A fost raportată o creștere legată de doză a embrioletalității și a avortului. Rezultate similare au fost raportate și la macacii cu coadă.
tretinoina topică în testele de teratogenitate la animale a generat rezultate echivoce. Există dovezi de teratogenitate (coadă scurtată sau îndoită) a tretinoinei topice la șobolanii Wistar la doze mai mari de 1 mg/kg și zi (de 200 de ori doza clinică topică recomandată la om). Anomalii (humerus: scurt 13%, îndoit 6%, os parietal incomplet osificat 14%) au fost, de asemenea, raportate atunci când 10 mg/kg și zi a fost aplicat dermic.
există și alte raportări la iepurii albi din Noua Zeelandă cărora li s-au administrat doze de aproximativ 80 de ori mai mari decât doza clinică topică recomandată la om, cu o incidență crescută a capului bombat și a hidrocefaliei, tipice malformațiilor fetale induse de retinoid la această specie.
în schimb, mai multe studii bine controlate la animale au arătat că tretinoina aplicată dermic nu a fost teratogenă, la doze de 100 și, respectiv, de 200 de ori mai mari decât doza clinică topică recomandată la om, la șobolani și, respectiv, iepuri.cu utilizarea pe scară largă a oricărui medicament, un număr mic de rapoarte de defecte de naștere asociate temporar cu administrarea medicamentului ar fi de așteptat doar din întâmplare. Treizeci de cazuri de malformații congenitale asociate temporal au fost raportate pe parcursul a două decenii de utilizare clinică a unei alte formulări de tretinoină topică (Retin-A). Deși nu a fost stabilit un model definit de teratogenitate și nici o asociere ocazională din aceste cazuri, 5 dintre rapoarte descriu categoria de defecte congenitale rare holoprosencefalie (defecte asociate cu dezvoltarea incompletă a liniei mediane a creierului anterior). Semnificația acestor rapoarte spontane în ceea ce privește riscul pentru făt nu este cunoscută.
efecte non-teratogene
S-a demonstrat că tretinoina dermică este fetotoxică la iepuri atunci când este administrată în doze de 100 de ori mai mari decât doza clinică locală recomandată la om. Tretinoina orală s-a dovedit a fi fetotoxică la șobolani atunci când este administrată în doze de 500 de ori mai mari decât doza clinică locală recomandată la om.
cu toate acestea, nu există studii adecvate și bine controlate la femeile gravide. Refissa nu trebuie utilizat în timpul sarcinii.
mamele care alăptează
nu se știe dacă acest medicament este excretat în laptele uman. Deoarece multe medicamente sunt excretate în laptele uman, trebuie să aveți precauție atunci când Refissa este administrată unei femei care alăptează.
utilizare pediatrică
siguranța și eficacitatea la pacienții cu vârsta sub 18 ani nu au fost stabilite.
utilizare geriatrică
siguranța și eficacitatea la persoanele cu vârsta peste 50 de ani nu au fost stabilite.
reacții Adverse
(vezi pct.avertismente și precauții.)
în studiile dublu-orb, controlate de vehicule, care au implicat 179 de pacienți care au aplicat cremă de tretinoină, USP (emolient) 0,05% pe față, reacțiile adverse asociate cu utilizarea cremei de tretinoină, USP (emolient) 0,05% au fost limitate în principal la nivelul pielii. În timpul acestor studii, 4% dintre pacienți au trebuit să întrerupă utilizarea cremei Tretinoin, USP (emolient) 0,05% din cauza reacțiilor adverse. Aceste întreruperi s-au datorat iritației pielii sau reacțiilor adverse cutanate asociate.
reacțiile locale, cum ar fi descuamarea, pielea uscată, arsurile, înțepăturile, eritemul și pruritul, au fost raportate de aproape toți subiecții în timpul tratamentului cu cremă de tretinoină, USP (emolient) 0,05%. Aceste semne și simptome au fost de obicei de severitate ușoară până la moderată și, în general, au apărut la începutul tratamentului. La majoritatea pacienților, uscăciunea, peelingul și roșeața au reapărut după o scădere inițială (24 de săptămâni).
supradozajul
aplicarea unor cantități mai mari de medicamente decât cele recomandate nu s-a dovedit a duce la rezultate mai rapide sau mai bune și pot apărea roșeață marcată, peeling sau disconfort. Ingestia orală a medicamentului poate duce la aceleași efecte secundare ca și cele asociate cu aportul oral excesiv de vitamina A.
Refissa dozare și Administrare
- Nu utilizați Refissa dacă pacienta este gravidă sau încearcă să rămână gravidă sau prezintă un risc crescut de sarcină
- nu utilizați Refissa dacă pacienta este arsă de soare sau dacă pacienta are eczeme sau alte afecțiuni cronice ale pielii
- nu utilizați Refissa dacă pacienta este inerent sensibilă la lumina soarelui
- nu utilizați Refissa dacă pacienta ia și medicamente cunoscute ca fiind fotosensibilizatori(de exemplu, tiazide, tetracicline, fluorochinolone, fenotiazine, sulfonamide) datorită posibilității de fototoxicitate mărită.
pacienții necesită instrucțiuni detaliate pentru a obține beneficii maxime și pentru a înțelege toate măsurile de precauție necesare pentru a utiliza acest produs cu cea mai mare siguranță. Medicul trebuie să revizuiască prospectul pacientului.
Refissa trebuie aplicată pe față o dată pe zi înainte de culcare, folosind doar suficient pentru a acoperi ușor întreaga zonă afectată. Pacienții trebuie să-și spele ușor fețele cu un săpun ușor, să se usuce pielea și să aștepte 20 până la 30 de minute înainte de a aplica Refissa. Pacientul trebuie să aplice o cantitate de cremă de mazăre pentru a acoperi ușor întreaga față. O atenție deosebită trebuie acordată aplicării cremei pentru a evita ochii, urechile, nările și gura.
aplicarea Refissa poate provoca o senzație tranzitorie de căldură sau o ușoară înțepătură.
atenuarea (paliația) ridurilor fine faciale, hiperpigmentarea pestriță și rugozitatea tactilă pot apărea treptat pe parcursul terapiei. Până la șase luni de tratament pot fi necesare înainte ca efectele să fie observate. Cea mai mare parte a ameliorării observate cu Refissa se observă în primele 24 de săptămâni de tratament. Ulterior, terapia menține în primul rând îmbunătățirea realizată în primele 24 de săptămâni.
odată cu întreruperea tratamentului cu Refissa, majoritatea pacienților vor pierde cele mai atenuante efecte ale Refissa asupra ridurilor fine, hiperpigmentării pătate și rugozității tactile a pielii feței; cu toate acestea, siguranța și eficacitatea utilizării Refissa zilnic timp de mai mult de 48 de săptămâni nu au fost stabilite.
aplicarea unor cantități mai mari de medicamente decât cele recomandate nu poate duce la rezultate mai rapide sau la rezultate mai bune și pot apărea roșeață, peeling sau disconfort marcate.
pacienții tratați cu Refissa pot folosi produse cosmetice, dar zonele care trebuie tratate trebuie curățate temeinic înainte de aplicarea medicamentului. (Vezi secțiunea precauții.)
cum se livrează Refissa
Refissa este disponibil în:
20 g tuburi NDC 42851-012-20
40 g tuburi NDC 42851-012-40
depozitare
a se păstra la 20-25 inkt .c (68-77 inkt. F). A NU SE CONGELA.
numai Rx.
tipărit în SUA
140904-0118
fabricat de DPT Laboratories, San Antonio, TX 78215
distribuit de ZO Skin Health, Inc., Irvine, CA 92618
Refissa
pentru uz topic doar pe față
care sunt cele mai importante informații despre Refissa ?
Refissa este un medicament serios. Nu elimină ridurile și nu repară pielea afectată de soare. Poate ajuta la tratarea ridurilor fine, a decolorării pete și a pielii cu senzație aspră, dar nu „vindecă” aceste condiții. Refissa trebuie utilizat numai sub supravegherea medicului dumneavoastră, ca parte a unui program larg de îngrijire a pielii. Acest program ar trebui să includă evitarea razelor solare directe (prin utilizarea de îmbrăcăminte de protecție și de protecție solară cu un SPF minim de 15) și utilizarea altor creme faciale hidratante care nu conțin tretinoin.
trebuie să utilizați Refissa numai la culcare. Nu utilizați produse de îngrijire a pielii uscate. Utilizați cea mai mică cantitate de Refissa necesară și evitați să o primiți în ochi, urechi, nas sau gură.
AVERTISMENT: Nu utilizați Refissa dacă sunteți gravidă sau încercați să rămâneți gravidă. Evitați expunerea la soare și orice alte medicamente care vă pot crește sensibilitatea la lumina soarelui (vezi mai jos).
Refissa nu a fost studiată la persoane cu vârsta peste 50 de ani sau la persoane cu piele pigmentată moderat sau închis la culoare.
Ce este Refissa?
(la ce mă pot aștepta de la Refissa?)
Refissa este un medicament serios care poate ajuta la tratarea, dar nu va „vindeca” ridurile fine, decolorarea pielii și pielea aspră.
studiile arată că, după 24 de săptămâni, aproximativ 30% dintre persoanele care au utilizat crema Tretinoin, USP (emolient) 0,05% pentru ridurile fine sau decolorarea petelor au avut o îmbunătățire moderată, alte 35% au avut o îmbunătățire minimă și 35% nu au avut nicio îmbunătățire. Aproximativ 16% dintre persoanele care au folosit crema Tretinoin, USP (emolient) 0,05% pentru pielea aspră au avut o îmbunătățire moderată, 35% au avut o îmbunătățire minimă și 49% nu au avut nicio îmbunătățire. Nu există dovezi că Refissa tratează pielea grosieră, ridurile adânci, îngălbenirea pielii sau alte probleme de îngrijire a pielii.
Refissa trebuie utilizat ca parte a unui program larg de îngrijire a pielii. Acest program ar trebui să includă evitarea razelor solare directe (prin utilizarea de îmbrăcăminte de protecție și de protecție solară cu un SPF minim de 15) și utilizarea altor creme faciale hidratante care nu conțin tretinoin. Mulți oameni pot obține efectele dorite prin utilizarea acestui program fără a utiliza Refissa. Nu trebuie să utilizați Refissa până când nu ați încercat un program larg de tratament al pielii fără Refissa.
când utilizați Refissa, îmbunătățirea ridurilor fine, decolorarea pielii și pielea aspră nu este imediată și apare treptat în timp. În general, este posibil să observați unele efecte în 3 până la 4 luni. Efectele sunt de obicei cele mai vizibile la aproximativ 6 luni, cu puține îmbunătățiri suplimentare după acel moment. Dacă Refissa este oprită, îmbunătățirea se va diminua treptat.
siguranța utilizării Refissa zilnic timp de mai mult de 48 de săptămâni nu a fost stabilită.
cine nu ar trebui să utilizeze Refissa?
nu trebuie să utilizați Refissa dacă sunteți ars de soare sau foarte sensibil la soare, dacă aveți eczeme sau dacă pielea dumneavoastră este iritată. Refissa poate provoca iritații crescute ale pielii și sensibilitate crescută la arsuri solare.
deoarece Refissa vă poate face pielea mai sensibilă la lumina soarelui, trebuie să spuneți personalului medical dacă utilizați și alte medicamente care cresc sensibilitatea la lumina soarelui, deoarece nu trebuie să utilizați Refissa împreună cu aceste medicamente. Acestea includ, dar nu se limitează la: tiazide (utilizate pentru tratarea tensiunii arteriale mari), tetracicline, fluorochinolne sau sulfonamide (utilizate pentru tratarea infecțiilor) și fenotiazine (utilizate pentru tratarea problemelor emoționale grave). Dacă luați orice medicamente eliberate pe bază de rețetă, medicamente fără prescripție medicală sau utilizați orice creme faciale, consultați un profesionist din domeniul sănătății pentru a vă asigura că nu interacționează cu Refissa.
sarcina Avertisment: Utilizarea în condiții de siguranță în timpul sarcinii nu a fost demonstrată. Există rapoarte de malformații congenitale la animalele de laborator și la oameni cărora li s-a administrat tretinoin pe cale orală. Nu trebuie să utilizați Refissa dacă sunteți gravidă sau încercați să rămâneți gravidă.
nu se cunoaște dacă Refissa este transmisă sugarilor prin laptele matern. Utilizarea sigură la copii nu a fost demonstrată.
siguranța și eficacitatea Refissa pentru persoanele cu vârsta peste 50 de ani sau cu o culoare mai închisă a pielii nu au fost dovedite.
cum ar trebui să folosesc Refissa?
trebuie să aplicați Refissa pe față o dată pe zi înainte de a vă retrage, folosind doar suficient pentru a acoperi ușor întreaga zonă afectată. Spălați-vă ușor fața cu un săpun ușor, uscați pielea și așteptați 20 până la 30 de minute înainte de a aplica Refissa. Aplicați o cantitate de cremă de mazăre pentru a vă acoperi întreaga față. Este posibil să simțiți o căldură sau o ușoară înțepătură atunci când Refissa este aplicată pentru prima dată.
trebuie să fiți deosebit de atenți atunci când aplicați crema pentru a evita ochii, urechile, nările sau gura. Refissa poate provoca roșeață severă, mâncărime, arsură, înțepătură și peeling dacă este aplicată în aceste zone.
utilizarea unor cantități mai mari decât cele necesare de Refissa nu va accelera rezultatele și poate provoca o supradoză. O supradoză poate duce la pielea roșie și descuamată, precum și la unele dureri sau disconfort.
puteți utiliza produse cosmetice după aplicarea Refissa. Asigurați-vă că vă curățați bine fața înainte de a aplica din nou Refissa.
Ce ar trebui să evit în timp ce folosesc Refissa?
Refissa crește sensibilitatea la lumina soarelui. Evitați lumina soarelui cât mai mult posibil. Folosiți îmbrăcăminte de protecție și o protecție solară cu un SPF minim de 15. Nu faceți plajă și nu folosiți lămpi solare. Dacă sunteți sensibil la lumina soarelui sau aveți un loc de muncă care necesită să fiți la soare pentru perioade lungi de timp, trebuie să fiți extrem de precauți.
în timp ce utilizați Refissa, evitați orice produse care pot usca sau irita pielea. De exemplu, evitați produsele aplicate pe piele care conțin alcool, condimente sau var. De asemenea, evitați produsele de curățare, îndepărtarea părului sau alte produse care pot irita pielea.
care sunt posibilele efecte secundare ale Refissa?
cele mai frecvente efecte secundare sunt reacțiile cutanate. Au fost raportate mâncărimi, piele roșie și uscată. Deci, aveți pielea arzătoare, înțepătoare și peeling. Acestea sunt cel mai adesea ușoare și sunt cele mai frecvente la începerea tratamentului.
Cum pot obține informații suplimentare?
acest prospect sintetizează cele mai importante informații despre Refissa. Dacă doriți mai multe informații, discutați cu medicul dumneavoastră sau cu alt furnizor de servicii medicale. Există, de asemenea, un prospect scris pentru profesioniștii din domeniul sănătății pe care farmacistul vă poate oferi.
adresați-vă medicului dumneavoastră pentru sfaturi medicale despre reacțiile adverse. PUTEȚI RAPORTA REACȚII ADVERSE LA FDA LA 1-800-FDA-1088.
panou de afișare PRINCIPAL – cutie de tub de 40 g
NDC 42851-012-40
117471-0118
Refissa ulei de tretinoină cremă, USP (emolient) 0.05%
Rx Only
NET WT 40 g
FDA APPROVED

| Refissa TRETINOIN (EMOLLIENT) tretinoin cream |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
Labeler – ZO Skin Health, Inc. (826468527)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| DPT Laboratories, Ltd. | 832224526 | manufacture(42851-012) | |
mai multe despre Refissa (tretinoin topic)
- efecte secundare
- în timpul sarcinii sau alăptării
- informații de dozare
- interacțiuni medicamentoase
- prețuri& cupoane
- En Espa Inktsol
- clasa de medicamente: agenți de acnee topică
resurse pentru consumatori
- informații pentru pacienți
- refissa topică (citire avansată)
resurse profesionale
- informații de prescriere
- tretinoin gel microsferă (FDA)
alte mărci retin-a, renova, Atralin, altreno, … + 2 mai multe
ghiduri de tratament conexe
- Photoaging a pielii
Medical Disclaimer