Un zahăr special: impactul acidului sialic asupra metabolismului, sănătății și bolilor
suntem plini de microbi care trăiesc pe suprafețe din afara și în interiorul corpului nostru. Înțelegerea noastră a microbiomului intestinal în special se îmbunătățește rapid pe măsură ce începem să dezlegăm modul în care comunitățile microbiene complexe interacționează cu dieta noastră, cu alți microbi și cu suprafețele noastre celulare. În timp ce multe substanțe chimice sunt importante în acest mediu, aici ne concentrăm pe acizii sialici ca un set critic de molecule care stau la baza multor dintre aceste interacțiuni și au impact asupra metabolismului, sănătății și bolilor.
cel mai frecvent acid sialic, acidul N-acetil-neuraminic (Neu5Ac) (Fig. 1) este un acid de zahăr relativ simplu care, în afară de sarcina sa, nu are nimic intrinsec neobișnuit în legătură cu acesta. Cu toate acestea, atunci când celulele intră în contact cu alte celule, ele folosesc adesea molecule afișate la suprafață și aici acizii sialici devin atât de importanți, deoarece sunt de obicei zaharurile terminale de pe glicanii gazdă, încât ard proteinele și lipidele așezate pe suprafețele celulare. Glicoproteinele mucinice de suprafață celulară sau secretate sunt exemple bune de structuri acoperite cu acid sialic pe care microbii le-ar putea întâlni la suprafețele mucoasei, cum ar fi tractul respirator sau gastro-intestinal (GI). Această poziție unică ca moleculă ‘meet and greet’ pentru alte celule umane, celule bacteriene și viruși pune acizii sialici în stadiul central pentru multe procese importante.
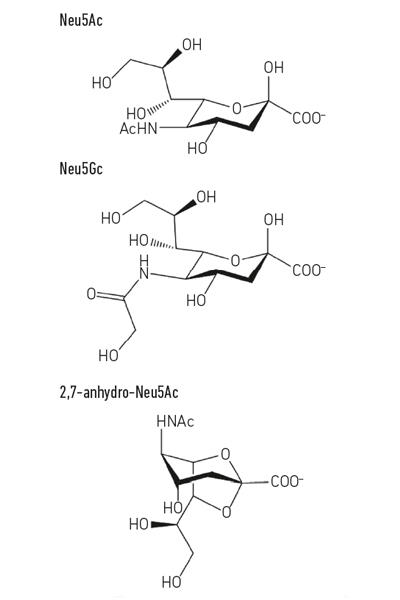
- Fig. 1. Exemplu de derivați ai acidului sialic. Rețineți că acidul n-glicolil-neurnaminic (Neu5Gc) nu poate fi produs de oameni, o diferență biochimică care ne distinge de alte maimuțe mari, dar poate fi încorporată în suprafețele noastre celulare atunci când este dobândită din dietă.
- agenți patogeni înveliți în zahăr
- hrănirea încrucișată- împărțirea dulciurilor în jurul
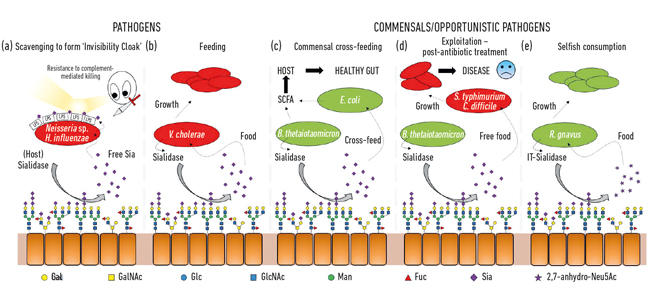
- Fig. 2. Ilustrare de desene animate a diferitelor interacțiuni dintre bacterii și acizi sialici prezenți ca zaharuri terminale pe o serie de glicani gazdă. Acestea sunt scindate de sialidaze și de obicei convertite în Neu5Ac liber, cu excepția IT-sialidazei care eliberează 2,7-anhidro-Neu5Ac. Acidul sialic liber eliberat de gazdă sau sialidaze patogene poate fi apoi utilizat de agenți patogeni ca mantie de invizibilitate (a) sau pentru hrănire (b). Hrănirea încrucișată poate avea loc între membrii microbiotei intestinale sau între bacteriile comensale și patogene care împărtășesc aceeași nișă (c, d), în timp ce alte bacterii au dezvoltat mecanisme egoiste pentru a rezerva acidul sialic pentru consumul propriu (e).
- păstrarea propriilor dulciuri
- virușii intră în act
- lecturi suplimentare
- Andrew Bell
- Emmanuele Severi
- Nathalie Juge
- Gavin H. Thomas
- de ce contează microbiologia?
- ce sfat ai da cuiva care începe în acest domeniu?
Fig. 1. Exemplu de derivați ai acidului sialic. Rețineți că acidul n-glicolil-neurnaminic (Neu5Gc) nu poate fi produs de oameni, o diferență biochimică care ne distinge de alte maimuțe mari, dar poate fi încorporată în suprafețele noastre celulare atunci când este dobândită din dietă.
agenți patogeni înveliți în zahăr
una dintre primele funcții microbiene ale acizilor sialici a fost legată de capacitatea unor agenți patogeni de a coloniza și apoi de a provoca boli la om. Într-adevăr, fostul președinte al Societății de Microbiologie, profesorul Harry Smith FRS, care lucrează la Universitatea din Birmingham, a fost pionierul acestei lucrări cu Neisseria gonorrhoea. Când oamenii de știință din grupul său au izolat bug-ul direct din corp, acesta a fost rezistent la uciderea prin ser uman (uciderea mediată de complement), dar dacă bug-urile au fost cultivate în laborator timp de câteva generații, această protecție a fost pierdută și celulele au fost ucise de ser. Grupul său a descoperit că acești agenți patogeni fură acidul sialic de la gazdă și îl folosesc pentru a-și acoperi propria suprafață celulară pentru a-i umaniza. Cu toate acestea, deoarece pot elimina doar acest acid sialic, absența acestuia în mediile de creștere înseamnă că nu se mai adaugă acid sialic, astfel încât aceștia pierd rapid această ‘protecție serică’ și sunt uciși. Se pare că o serie de alte bug-uri mascate folosesc strategii similare pentru a-și genera propria mantie de invizibilitate folosind acid sialic, cum ar fi Neisseria meningitidis, Campylobacter jejuni sau Haemophilus influenzae (Fig. 2a)
hrănirea încrucișată- împărțirea dulciurilor în jurul
pe lângă faptul că sunt folosiți de agenți patogeni ca mantie de invizibilitate, acizii sialici sunt hrană destul de bună pentru bacterii, deoarece furnizează atât carbon, cât și azot și pot fi folosiți ca sursă de energie. Lucrările anterioare au arătat că agenții patogeni precum Vibrio cholerae erau fericiți doar să mănânce acizi sialici și că, în sine, era important pentru colonizarea cu succes a gazdei (Fig. 2b).
în intestin, o sursă majoră de acizi sialici provine din mucine, care sunt principalele componente structurale ale stratului de mucus care acoperă suprafața epiteliului. Cel mai expus strat de mucus este habitatul diferitelor bacterii comensale, care au învățat cum să se sărbătorească cu proteine de mucină, unde zaharurile reprezintă 80% din masa lor. Dintr-o perspectivă topologică simplă, acizii sialici, ca zaharuri terminale, sunt recoltați mai întâi, expunând zaharurile subiacente care pot fi, de asemenea, eliberate și consumate ulterior. Odată cu apariția secvențierii de generație următoare, am dobândit cunoștințe despre microbii care trăiesc în această nișă și mulți au gene pentru absorbția acidului sialic și catabolismul ulterior. Ceea ce a fost interesant a fost descoperirea că unele dintre anaerobe comensale, cum ar fi Bacteroides thetaiotaomicron, secretă sialidaze pentru a elibera acidul sialic, dar nu au transportori și gene catabolice pentru a-l folosi efectiv. Acest gest aparent altruist este necesar pentru ca bacteriile să acceseze zaharurile subiacente și stă la baza unui proces de hrănire metabolică încrucișată cu alte bug-uri care trăiesc în nișa mucusului, cum ar fi tulpinile comensale de Escherichia coli care nu au o sialidază, dar sunt bune la consumul de acid sialic liber (Fig. 2c). Acest concept este acum recunoscut ca un aspect important al colonizării și adaptării nișelor. O exemplificare strălucitoare a acestui lucru a fost descrisă de grupul lui Justin Sonnenburg de la Universitatea Stanford, folosind un model de șoarece cu o microbiotă intestinală definită simplu. În urma tratamentului cu antibiotice, multe dintre bacteriile care consumă acid sialic au fost șterse, ducând la acumularea de acid sialic liber în intestin. Atunci când sunt provocați cu agenți patogeni precum Salmonella typhimurium sau Clostridium difficile, acești agenți patogeni ar beneficia de acidul sialic liber ca nutrient (Fig. 2d). Tulpinile mutante de agenți patogeni lipsiți de transportori sau gene catabolice nu au avut un avantaj, făcând o legătură directă cu creșterea agentului patogen atunci când comunitatea microbiană intestinală este perturbată. Mecanismele de reducere a bazinului de acid sialic liber în intestin au fost, prin urmare, propuse ca parte a unei noi strategii antiinfecțioase.
Fig. 2. Ilustrare de desene animate a diferitelor interacțiuni dintre bacterii și acizi sialici prezenți ca zaharuri terminale pe o serie de glicani gazdă. Acestea sunt scindate de sialidaze și de obicei convertite în Neu5Ac liber, cu excepția IT-sialidazei care eliberează 2,7-anhidro-Neu5Ac. Acidul sialic liber eliberat de gazdă sau sialidaze patogene poate fi apoi utilizat de agenți patogeni ca mantie de invizibilitate (a) sau pentru hrănire (b). Hrănirea încrucișată poate avea loc între membrii microbiotei intestinale sau între bacteriile comensale și patogene care împărtășesc aceeași nișă (c, d), în timp ce alte bacterii au dezvoltat mecanisme egoiste pentru a rezerva acidul sialic pentru consumul propriu (e).
păstrarea propriilor dulciuri
în timp ce sialomicrobiologia timpurie s-a concentrat asupra agenților patogeni, lucrările mai recente s-au concentrat asupra bacteriilor comensale care locuiesc în aceeași nișă. Studiile de astăzi în domeniul microbiotei intestinale dezvăluie cât de acerbă este concurența pentru Neu5Ac în intestinul nostru și cum poate înclina echilibrul dintre agenții patogeni și comensali. Ce se întâmplă dacă o anumită bacterie ar putea elibera acidul sialic într-o formă pe care numai ea ar putea să o acceseze? Lucrările din grupul Juge Din Norwich au arătat că simbiontul intestinal ruminococcus gnavus a evoluat pentru a face acest lucru, folosind un tip special de sialidază numită trans-sialidază intramoleculară (IT-sialidază) care eliberează 2,7-anhidro-Neu5Ac (vezi Fig. 1) în loc de Neu5Ac. Prin dezvoltarea unei metode de sinteză a 2,7-anhidro-Neu5Ac pur, au arătat că tulpinile R. gnavus au reușit să crească pe 2,7-anhidro-Neu5Ac ca singură sursă de carbon. În plus față de domeniul care catalizează reacția enzimatică, IT-sialidazele cuprind un domeniu de legare a carbohidraților care ajută la medierea legării IT-sialidazei de mucinele bogate în acid sialic. In vivo, acest lucru poate favoriza un mecanism care ajută la direcționarea bacteriilor către regiunile bogate în acid sialic ale tractului GI, promovând astfel colonizarea bacteriană în stratul de mucus. Odată localizată în locul potrivit, IT-sialidaza scindează acidul sialic din lanțurile terminale ale mucinelor și îl eliberează într-o formă, 2,7-anhidro-Neu5Ac, că R. gnavus poate folosi ca sursă proprie de hrană, mai degrabă decât să împartă Neu5Ac cu alte bacterii care locuiesc în nișa mucusului, inclusiv agenți patogeni (Fig. 2e). Acest mecanism oferă un avantaj competitiv față de alte bacterii care consumă acid sialic care locuiesc în nișa mucusului, oferind o sursă de nutrienți pe care o poate accesa preferențial. În plus, R. gnavus poate ajuta, de asemenea, la reducerea creșterii agenților patogeni enterici prin reducerea nivelului de Neu5Ac în mediul mucoasei, deschizând căi către o nouă strategie terapeutică într-o epocă de creștere a rezistenței la antibiotice.
virușii intră în act
virușii folosesc, de asemenea, acizii sialici ca molecule cheie în timpul ciclului lor de infecție, cel mai faimos virus gripal. Atașarea inițială este primul pas cheie, deoarece acizii sialici funcționează ca receptori ai virusului pe celulele epiteliale respiratorii. Tipul de legătură a acidului sialic cu zaharurile subiacente din glicani controlează adesea gama gazdă a virusurilor gripale, iar tulpinile pandemice au adesea proteine de adeziune (hemaglutinină) care recunoaște formele asemănătoare omului de atașare a acidului sialic și, prin urmare, sunt deosebit de virulente. Acidul Sialic este important în ultima etapă a ciclului de viață viral, deoarece eliberarea din celula infectată necesită scindarea acizilor sialici de pe suprafața celulei gazdă. Aceasta este catalizată de o enzimă virală numită sialidază (sau neuraminidază). Inhibarea acestei enzime de către analogii structurali ai acidului sialic, formulați în Tamiflu (fosfat de Oseltamivir) și Zanamivir, sunt tratamentul nostru de primă linie pentru gripă și sunt un triumf al designului medicamentos inspirat de structură/funcție.în concluzie, este clar că acizii sialici sunt molecule critice în multe procese în care celulele microbiene și virușii interacționează cu suprafețele celulelor de mamifere. În acest scurt articol, am atins unele dintre acestea pentru a da o idee despre funcțiile centrale ale acestor zaharuri în comunicare, stealth, colonizare și metabolism în diferite aspecte ale sănătății și bolii. Acizii sialici au fost descriși ca fiind cele mai importante substanțe chimice din lume și vor continua, fără îndoială, să dezvăluie mai multe despre evoluția oamenilor și interacțiunea lor cu microbii lor.
lecturi suplimentare
Thomas, GH. Achiziționarea acidului Sialic în bacterii – un substrat, mulți transportori. Biochem Soc Trans 2016; 44:760-765.
ng KM, Ferreyra JA, Higginbottom SK, Lynch JB, Kashyap PC și colab. Zaharurile gazdă eliberate de microbiotă facilitează expansiunea post-antibiotică a agenților patogeni enterici. Natură 2013; 502: 96-99.
Owen CD, Tailford LE, Monaco S, Eluxuligoj T, Vaux L și colab. Descoperirea specificității și mecanismului recunoașterii acidului sialic de către simbiotul intestinal ruminococcus gnavus. Nat Commun 2017; 8: 2196.
Tailford LE, Owen CD, Walshaw J, Crost EH, Hardy-Goddard J, Le Gall G, de Vos WM, Taylor GL, Juge N. descoperirea trans-sialidazelor intramoleculare în microbiota intestinală umană sugerează mecanisme noi de adaptare a mucoasei. Nat Commun 2015; 6: 7624.
Juge N, Tailford L, Owen CD. Sialidazele din bacteriile intestinale: o mini-recenzie. Biochem Soc Trans 2016; 44:166-175.

Andrew Bell
Quadram Institute Bioscience, Norwich Research Park, NR4 7UQ, Marea Britanie
Andrew Bell este un student postuniversitar în departamentul microbi intestinali și sănătate la Institutul Quadram studiind impactul unui nou mecanism al metabolismului acidului sialic asupra homeostaziei intestinale. A obținut licența în biochimie de la Universitatea din East Anglia și a petrecut 2 ani lucrând la Centrul John Innes privind metabolismul clorofilei din pea (Pisum sativum) înainte de a se alătura grupului Nathalie Juge la Institutul Quadram în 2015 pentru munca sa de doctorat.

Emmanuele Severi
Departamentul de Biologie, Universitatea din York, Wentworth Way, York YO10 5DD, Marea Britanie
@emm_severi
Emmanuele Severi este un asociat de cercetare post-doctorat în cadrul Departamentului de Biologie de la Universitatea din York, care lucrează în laboratorul Prof. A lucrat la transportul și metabolismul acidului sialic în diferite momente ale carierei sale și este membru al societății din 2002.

Nathalie Juge
Quadram Institute Bioscience, Norwich Research Park, NR4 7UQ, Marea Britanie
Nathalie Juge este lider de cercetare la Quadram Institute Bioscience (QIB) Din Norwich, lider adjunct al programului strategic al Institutului, microbii intestinali și sănătatea (GMH) și profesor onorific la școala de științe Biologice, Universitatea din East Anglia. Ea conduce un grup de cercetare privind glicobiologia interacțiunilor gazdă-microb în intestin, cu accent pe metabolismul acidului sialic derivat din mucină de către microbiota intestinală (https://quadram.ac.uk/nathalie-juge).

Gavin H. Thomas
Departamentul de Biologie, Universitatea din York, Wentworth Way, York YO10 5DD, Marea Britanie
@GavinHThomas
Gavin H. Thomas este un Prof.de Microbiologie în cadrul Departamentului de Biologie de la Universitatea din York și au lucrat pe transportul de acid sialic bacterian și catabolism un deceniu. A fost membru al societății din 1995, a fost Editor al Microbiology Today (2003-2006), servind în Consiliu în aceeași perioadă, a servit în Comitetul pentru comunicații (2012-2015) și egalitatea & Comitetul pentru Diversitate (2013-2015). A fost redactor, Senior Editor și este acum redactor-șef adjunct al revistei de conducere a societății Microbiologie (http://thomaslabyork.weebly.com).
de ce contează microbiologia?
Gavin: Contează pentru sănătatea noastră – abia acum începem cu adevărat să înțelegem compoziția moleculară și funcția microbiomului nostru, care probabil are impact asupra corpului nostru în moduri multiple.
ce sfat ai da cuiva care începe în acest domeniu?
Gavin: citiți pe larg și dincolo de ‘bug – ul dvs.’ – microbii pot face aproape totul și de obicei au inventat mai multe moduri diferite de a face acest lucru!
Imagini: particule de virus gripal H3N2. CDC / Biblioteca foto știință.
Fig. 1. Andrew Bell.
Fig. 2. Emmanuele Severi.