19.11: racemisering
optiskt aktiva bifenylderivat (avsnitt 13-5A) racemiseras om de två aromatiska ringarna när som helst passerar genom en samplanar konfiguration genom rotation kring den centrala bindningen. Detta kan åstadkommas mer eller mindre lätt genom värme, såvida inte 2,2′-Orto-substituenterna är mycket stora.
det sätt på vilket föreningar med asymmetriska kolatomer racemiseras är mer komplicerat. En möjlighet skulle vara att ett tetraedralt kiralt kol fäst vid fyra grupper blir plan och achiral utan att bryta några bindningar. Teoretiska beräkningar indikerar att detta inte är en sannolik process för kiralt tetravalent kol, men som vi kommer att se förekommer det med kiralt kol och andra kirala atomer som är bundna till tre grupper:
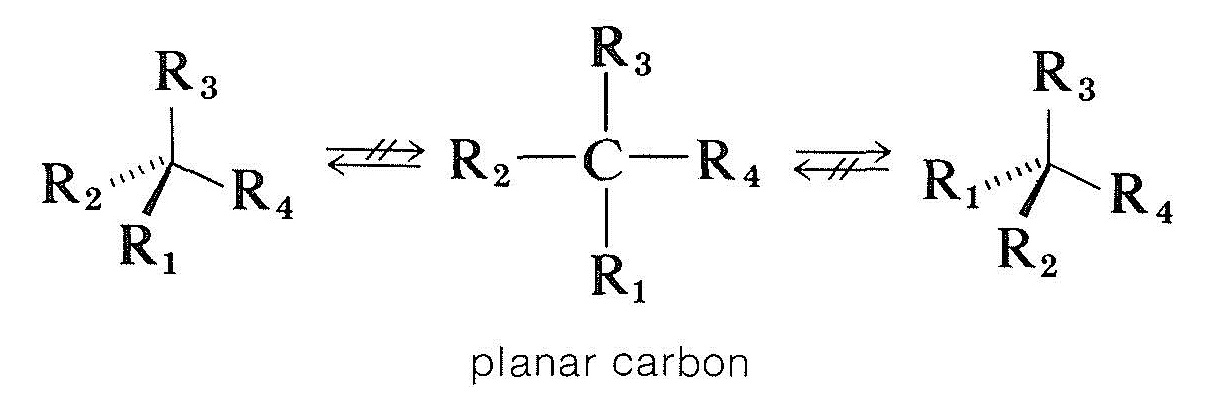
optiskt aktiva karbonylföreningar av typen \(\ce{-CHC=o}\), där alfa-kolet är asymmetriskt, racemiseras av både syror och baser, och från avsnitt 17-1 vi kan vara säkra på att detta är relaterat till enolisering. Bildandet av antingen enol eller enolatanjonen kommer att förstöra asymmetrin hos\ (\alpha\) kolet så att även om endast spårmängder av enol är närvarande vid en given tidpunkt, så småningom kommer hela föreningen att racemiseras. Mekanismen kräver emellertid både att det finns ett \(\alpha\) väte och att symmetriens centrum ligger vid detta \(\alpha\) kol. Annars är syror och baser ineffektiva vid katalysering av racemisering.
.jpg?revision=1)
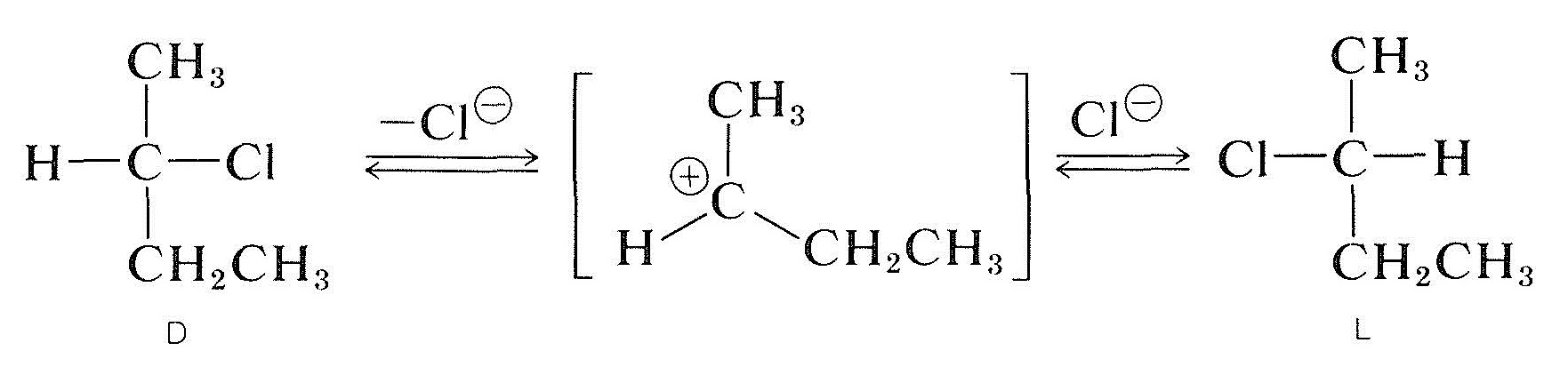
racemiseringen av en optiskt aktiv sekundär Halid med det kirala kolet som bär halogenet (t. ex., 2-klorbutan) kan förekomma ih-lösning och vanligtvis, ju mer polär och bättre joniserande lösningsmedlet är, desto lättare är substansen racemiserad. Jonisering av halogeniden med en\(S_\ text{n}1\) process är förmodligen ansvarig, och detta skulle säkert främjas av polära lösningsmedel (avsnitt 8-6). Alla indikationer är att en alkylkarbokalisering en gång dissocierad från dess medföljande anjon är plan; och när en sådan Jon rekombineras med anjonen har den lika sannolikhet att bilda\ (D\) och\ (L\) enantiomererna:
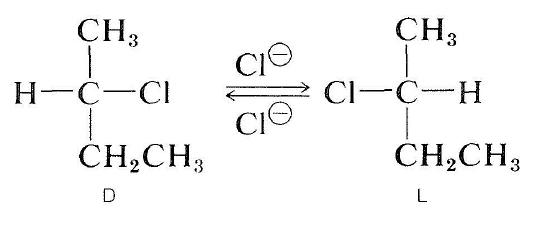
optiskt aktiva halider kan också racemiseras med en \(S_\text{N}2\) mekanism. En lösning av aktiv 2-klorbutan i 2-propanon innehållande upplöst litiumklorid blir racemisk. Förskjutning av halogenidens klorid med kloridjon inverterar konfigurationen vid atomen som genomgår substitution (se avsnitt 8-5). En andra substitution regenererar den ursprungliga enantiomeren. Så småningom producerar denna fram och tillbaka process lika många former av \(D\) och \(L\); ämnet är då racemiskt:
asymmetriska alkoholer racemiseras ofta av starka syror. Utan tvekan sker jonisering och rekombination av karbokokationen med vatten leder till antingen enantiomer:
.jpg?revision=1&size=bestfit&width=590&height=243)
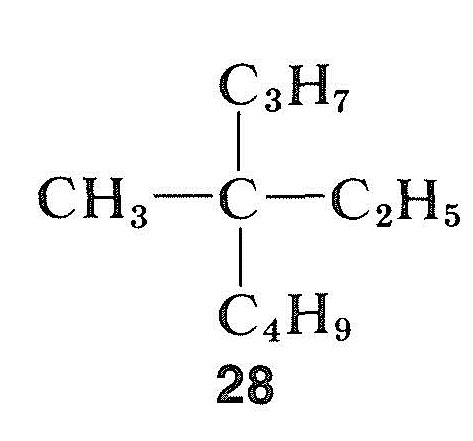
i motsats till halider, alkoholer och karbonylföreningar kan kolväten vara extremt svåra att racemisera. Detta gäller särskilt för en förening med ett kvaternärt asymmetriskt centrum, såsom metyletylpropylbutylmetan, \(28\), som inte har något ”handtag” för att tillåta att man omvandlar det asymmetriska kolet till ett symmetriskt tillstånd med enkla kemiska medel:
emellertid kan kolväten som har en väteatom vid det asymmetriska kolet racemiseras om de kan omvandlas antingen till karbokationer eller till till karbanioner. Lättheten av karbanion-typ racemisering beror på surheten hos det bifogade väte och på den stereokemiska stabiliteten hos den mellanliggande karbanionen som bildas. Om konfigurationen av carbanion intermediate inverterar kommer racemisering att resultera (se även Avsnitt 6-4e):
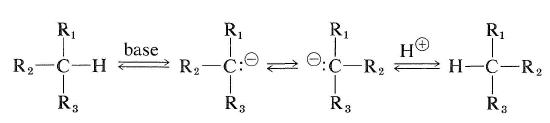
karbokationstypen för racemisering av ett optiskt aktivt kolväte kan uppstå genom utbytesreaktionen som beskrivs i avsnitt 10-9.
bidragsgivare och attribut
- John D. Robert och Marjorie C. Caserio (1977) grundläggande principer för organisk kemi, andra upplagan. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Detta innehåll är upphovsrättsskyddat under följande villkor, ” du får tillstånd för individuell, pedagogisk, forskning och icke-kommersiell reproduktion, distribution, visning och utförande av detta arbete i vilket format som helst.”