gränser i Kardiovaskulär Medicin
introduktion
När man undersöker koordinatsystem som kan användas för olika biologiska enheter, bör specifika egenskaper beaktas. Till exempel bildar kromosomnummer och basparposition ett linjärt koordinatsystem som är tillräckligt för att definiera plats i referensgenomet (1). Ett koordinatsystem för hela människokroppen, som kan tillgodose behoven hos HuBMAP, HCA, HPA och andra kartläggningsinsatser, är dock mycket mer komplex av flera skäl (2-5). Först lever celler i tre dimensioner; och ytterligare information behövs för att beskriva storleken och rotationsorienteringen av alla vävnadsprov som används för att generera data. För det andra, medan genombasparets position inte beror på hur DNA viks och packas in i kärnan, positionerna för enskilda element (t. ex., celler, organ) i kroppen är dynamiska, eftersom de kan förändras med skelett-och muskelrörelser, gravitation, andning, hjärtslag och andra funktioner och krafter som snedvrider vävnad. För det tredje, även om DNA-variationen mellan människor är <1%, spänner människokroppsgeometrin över ett brett spektrum av höjder, vikter och former, som varierar beroende på kön och ras och förändras avsevärt över en persons livslängd.
ett alternativ är att använda ett 3D-kartesiskt koordinatsystem för att beskriva position i kroppen. Kartesiska koordinatsystem har fördelen av att vara bekanta och lättförståeliga. Med kroppen i standard anatomisk position bildar vänster-höger, caudal-kranial och bakre-främre tre vinkelräta (x-y-z) axlar. För mindre skala analyser kan Centrering av ursprunget på ett anatomiskt landmärke vara mest användbart och potentiellt mindre varierande mellan olika människor. Till exempel skulle det vara lättare att mäta avståndet mellan ett vävnadsprov från njurarna till njurens överlägsna Pol än till toppen av en persons huvud. Nackdelen med kartesiska koordinater är att dess axlar inte följer kroppens naturliga form. Som ett resultat skulle skapandet av en referenskroppskarta genom att digitalt ”sy” samman vävnadsprover som samlats in från människor i olika storlekar kräva en komplex process för vridning, rotation och anpassning av data. Att göra detta på ett sätt som skalar till hela kroppen samtidigt som cellulär precision bibehålls skulle vara extremt utmanande.
andra 3D-koordinatsystem har utvecklats för olika applikationer. Till exempel beskriver sfäriska koordinater, med axlar som representerar latitud, longitud och höjd, bekvämt läge på jordens yta. En enkel väg i sfäriska koordinater, som” 1 km öster”, är mycket svårare att kommunicera med kartesiska koordinater. På samma sätt bör koordinatsystem för människokroppen helst ha axlar som följer anatomiska strukturer, genetiska uttrycksmönster, kemiska gradienter och/eller andra biologiskt relevanta vägar. Flera organspecifika koordinatsystem har utvecklats, såsom talairach-Koordinater för funktionell hjärnavbildning, men dessa sträcker sig inte till hela kroppen (6).
vaskulärt baserat koordinatsystem
i 2017 organiserades ett gemensamt Koordinatramverk (CCF) möte av National Institutes of Health, Broad Institute, Sanger Institute och Chan Zuckerberg Initiative. Mötesdeltagare, som inkluderade anatomister, patologer, kliniker och teknikexperter från hela världen, föreslog flera metoder för att kartlägga cellerna i människokroppen, inklusive anatomiskt baserade koordinatsystem (7). En av dessa, som använder vaskulaturen, diskuterades vidare vid en CCF-Workshop 2019, speciellt för lokalisering av njurceller (8). I detta manuskript presenterar vi en konceptuell översikt över detta kärlbaserade koordinatsystem och beskriver dess fördelar och begränsningar (Figur 1).
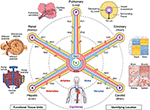
Figur 1. Nav-och-talade strukturen i ett vaskulärt koordinatsystem. Det vaskulära koordinatsystemet består av representativa kärlslingor som börjar och slutar i hjärtkamrarna och sträcker sig till de funktionella enheterna i varje organ (moturs från övre vänstra: alveoler, glomeruli och leverlobuler). ”R ”för njur-och” H ”för lever) och förgreningsnivån för närmaste kärl (t.ex.” RA1 ”för afferenta arterioler i njurslingan). Observera att väggarna i hjärtat ligger längs koronar (”C”) vaskulär slinga, och cellerna i vissa strukturer inre till hjärtat är faktiskt placerade på periferin av koordinatsystemet, nära kapillärerna som ger dem blod. Det finns flera sätt att hitta en ännu mer exakt ”GPS-liknande” position, inklusive att gå medurs från övre högra hörnet, ”hypoxi fingeravtryck” som resulterar från minskande syrenivåer längre från kärlet, det unika ”histologiska fingeravtrycket” och ”genuttryck fingeravtryck” i olika typer av vaskulära endotelceller och det distinkta ”vaskulära arkitekturfingeravtrycket” som finns i olika typer av vävnad. Vaskulaturen sträcker sig till alla delar av kroppen (botten) och ramar alla organ i alla skalor. Källfiler: Bilder av hepatiska lobuler, glomeruli, alveoler, genuttrycksvärmekarta och hela kroppens kärl är anpassade från Wikimedia Commons: https://commons.wikimedia.org/wiki/File:2423_Microscopic_Anatomy_of_Liver.jpg (Public Domain); https://commons.wikimedia.org/wiki/File:Juxtaglomerular_Apparatus_and_Glomerulus.jpg (CC BY 3.0 license); https://commons.wikimedia.org/wiki/File:Alveolus_diagram.svg (Public Domain); https://commons.wikimedia.org/wiki/File:Iris_dendrogram.png (CC BY-SA 4.0 licens); och, https://commons.wikimedia.org/wiki/File:Circulatory_System_en.svg (Public Domain). Genuttryck värme karta återskapas från Guo et al. (9) använda simulerade data. Vaskulär arkitektur baserad på Bosetti et al. (10) (CC BY 4.0 licens).
målet med ett vaskulärt koordinatsystem är inte att bygga en karta över vaskulaturen. Snarare är tanken att använda kända kärlvägar genom kroppen som en axel i ett koordinatsystem som kan beskriva positionen för anatomiska element, såsom celler, i vävnaden som omger vaskulaturen. I detta föreslagna ramverk kan hjärtkamrarna ses som ursprunget i helkroppskartan. Den vaskulära axeln innehåller vaskulära slingor (jämförbara med” vägar ” i Google Map-metaforen) som sträcker sig ut genom aorta eller lungartären, gradvis avsmalnar till enstaka cellstorlek när de närmar sig alla andra celler i varje organ i kroppen och återvänder till hjärtat. Längs dessa vägar följer vaskulaturen den unika biologin hos de olika organen och vävnaderna; och på samma sätt kunde kroppens organ och vävnader inte existera utan de unika egenskaperna hos deras nära integrerade vaskulatur.
precis som genomkartan utvecklar DNA i en linjär sekvens, kan vi föreställa oss att utveckla de komplexa 3D-vridningarna i vaskulaturaxeln till en enklare 2D ”hub-and-spoke” – form med hjärtkamrarna i mitten. Denna schematiska representation av vaskulaturen gör det lättare att (1) beskriva plats i kroppen; (2) anpassa kärlvägar med varierande 3D-former men motsvarande funktion från olika människor; (3)identifiera mönster som förändringar i celltyp och genuttryck som en övergångar från större till mindre kärl i ett organ (längs en eker); och (4) Jämför vävnad på samma nivå (t.ex. kapillärer) i olika organ (över ekrar).
ett organ, såsom njurarna, har tiotusentals kärlvägar om varje kapillär anses tydligt. Men för att göra konstruktionen av en CCF möjlig kommer vi att göra ett ytterligare förenklande antagande att många av dessa vägar är oskiljbara från varandra. I synnerhet är de minsta kärlen (kapillärerna) i mitten av de små specialiserade funktionella enheterna i varje organ (t. ex. i levern, glomeruli i njuren och alveoler i lungan). Ett helt organ kräver många av dessa kärlcentrerade funktionella enheter som är anatomiskt och fysiologiskt lika (11). Denna likhet kan användas för att kollapsa många vaskulära vägar till några representativa (Figur 2). I framtiden, när vi lär oss mer om de biomolekylära profilerna för dessa vägar, kan vi förfina CCF genom att dela upp vägarna i alla undertyper som upptäcks.

Figur 2. Utveckla den renala vaskulära vägen ner till singelcellsnivån. En representativ vaskulär väg kommer in i njuren genom njurartären, passerar genom glomerulus och återvänder ut i njurvenen. Vid makroskala (vänster) och mesoskala (centrum) är etiketter i gula lådor anatomiska strukturer som motsvarar olika kärl längs denna slinga. Vid mikroskalan (höger) är etiketter i gula lådor olika typer av celler som ligger inom ett kort avstånd från ett närliggande kärl i glomerulus. Placeringen av enskilda celler kan beskrivas av närmaste fartygs adress (t. ex., ”RA0 ”för glomerulus kapillär), avståndet i mikrometer eller antal celler från kärlet endotel och en vinkel vinkelrätt mot längden av kärlet (t.ex.” RA0-10 oc-135 oc ”eller”RA0-1C-135 oc”). Längst till höger har varje kärl och dess omgivande vävnad extraherats från originalbilden och justerats vertikalt för att göra det enkelt att se hur celltyper och distribution förändras längs kärlvägen. I det här exemplet har de inriktade bilderna också roterats så att glomerulusens centrum alltid är till höger. Källfiler: Bilder av njure och glomerulus är anpassade från Wikimedia Commons: https://commons.wikimedia.org/wiki/File:KidneyStructures_PioM.svg (CC BY 3.0-licens); och https://commons.wikimedia.org/wiki/File:Renal_corpuscle-en.svg (CC BY-SA 4.0-licens).
en” adress ” för en enskild cell i ett vaskulärt koordinatsystem har fyra komponenter. (1) den första är det närmaste anatomiskt namngivna kärlet som mest exakt identifierar en vaskulär slinga (det vaskulära territoriet eller ”vattendrag”), såsom den högra njurartären. (2) nästa komponent representerar fartygets förgreningsnivå. I njuren inkluderar exempel från proximal till distal interlobarartärerna, kortikala utstråla artärer, afferenta arterioler och glomerulära kapillärer. Förgreningsnivån kan också definieras numeriskt, med kapillärer på nollnivå och högre nivåer med större antal. (3) den tredje komponenten är det vinkelräta avståndet i mikrometer eller antal celler från kärlets endotelskikt. (4) en valfri fjärde komponent kan vara rotationsvinkeln vinkelrätt mot fartygets längd. Noll grader kan definieras på många sätt beroende på applikationen. Till exempel kan det vara relativt en markör på vävnadsprovet, eller det kan peka mot en anatomisk struktur, såsom mitten av närmaste glomerulus i njuren. Verktyget och behovet av dessa komponenter skulle behöva bekräftas genom experimentell testning.
ett annat tillvägagångssätt är att använda endotelceller som” förankringsceller ” för att identifiera de relativa positionerna för de andra cellerna på ett GPS-liknande sätt. Endotel linjer hela vaskulaturen. Distinkta endotelcellstyper (EC) förekommer i olika delar av vaskulaturen, som kan detekteras histologiskt genom unika Cellegenskaper och angränsande celler (det ”histologiska fingeravtrycket”), såväl som genom analys av deras specifika genprofiler (”genuttryckets fingeravtryck”, figur 1 värmekarta) (9, 12, 13). Vascular organisationsmönster, förgrening komplexitet, diameter, etc. ge ytterligare igenkännbara funktioner som bildar en ”vaskulär arkitektur fingeravtryck” för varje vävnad (Figur 1 falsk färg fluorescerande vaskulatur bilder) (10, 14). Varje vävnad har specifika syregradienter, som kan användas för att bestämma avståndet från kärlet. När PO2 inte kan mätas direkt kan man dra slutsatsen cellavståndet från induktions-/expressionsgradienterna för hypoxiinducerbara gener i olika typer av celler (”hypoxifingeravtrycket”, Figur 1 tvärgående vy av ett kärl) (15-17).
fördelar med en vaskulär CCF
ett vaskulaturkoordinatsystem är vettigt biologiskt. Varje levande cell måste ligga inom en liten radie från det närmaste blodkärlet (100-1 mm, beroende på vävnaden) för att ta emot syre (18); och varje kärl är fodrad med samma kontinuerliga lager av endotel (19). Således bildar vaskulaturen en obruten väg som når alla delar av kroppen, sömlöst avsmalnande ner över skalor, från makroskala (hela kroppen/klinisk) till mesoskala till mikroskala (kapillärkärl med en cellstorlek). Som en del av detta hanterar den den gradvisa övergången från stora artärer och vener, som bevaras hos de flesta, ner till de miljoner mikroskopiska kärl som är igenkännliga efter kategori (t.ex. glomerulus kapillär) men inte av enskilda namn. Kärlsystemet anpassar sig till individuell kroppsstorlek och form och står för interindividuella variationer (20, 21). Det definierar formen på funktionella enheter i olika organ, såsom leverlobuler, njurglomeruli och lungalveoler. Normal utveckling av ny vävnad börjar med kärlbildning innan ytterligare celltyper kan växa runt den (22).
kärlsystemet når också alla organ, vävnader och celler på ett sammanhängande sätt. Andra anatomiska strukturer verkar inte ha liknande mångsidighet. Till exempel sträcker sig skelettsystemet till hela kroppen; avståndet från en cell i ett organ till närmaste ben kan dock vara flera centimeter, och det benet är osannolikt att vara en del av organet och ännu mindre sannolikt att vara en del av ett vävnadsprov. Nervsystemet följer många av samma vägar som större kärl investerade med kontraktila egenskaper, men det är inte känt om de sträcker sig för att följa de mindre kärlen som når alla vävnadsceller. Således, till skillnad från cellernas beroende av syre, finns det ingen garanti för att varje cell är i närheten av en nerv. Organspecifika referenssystem är baserade på unika strukturella egenskaper som endast finns i det enskilda organet (t.ex. specifika regioner i hjärnan) och är osannolikt att vara användbara för att representera cellplatser någon annanstans i kroppen.
det finns många praktiska fördelar med ett vaskulärt koordinatsystem. Vaskulära vägar i alla organ har studerats i stor utsträckning och beskrivs i litteraturen i detalj. De är användbara, välkända och har standardiserade namn över många specialdomäner. Vävnadsvaskulariseringsmönster används kliniskt för att diagnostisera sjukdom; och fartyg används i kirurgi och biopsier som de viktigaste anatomiska landmärkena och för att definiera ”vaskulära territorier” (23, 24). Även om den exakta positionen i 3D-kartesiskt utrymme kan vara svårt att bestämma för ett resekterat vävnadsprov, kommer kirurgen vanligtvis att kunna indikera vilken vaskulär vattendrag som inkluderade provet.
begränsningar av en vaskulär CCF
endast att känna till basparen i en genomsekvens ger inte tillräckligt med information för att bestämma hur DNA viks i en viss cell. På samma sätt, även om det utfällda vaskulära koordinatsystemet kan beskriva 3D-rumsliga förhållandet mellan närliggande celler vid mikroskalan, förloras de lindningsvägar som kärlen tar och det relativa avståndet mellan celler vid större skalor. Information om större skala strukturer kan erhållas genom att integrera klinisk bildbehandling och histologisk och molekylär mönstring.
en del ytterligare positionsinformation går förlorad genom att kollapsa vaskulära vägar. Till exempel kan ett vaskulärt koordinatsystem initialt behandla alla glomeruluskapillärer i njuren som samma struktur, vilket potentiellt maskerar skillnader i glomeruli vid de överlägsna och underlägsna njurpolerna. Men när vi lär oss mer om de biomolekylära profilerna för dessa vägar kan vi iterativt förfina den vaskulära CCF över tiden genom att dela vägar i alla subtyper som upptäcks.trots dessa begränsningar behåller ett vaskulärt koordinatsystem tillräckligt med positionsinformation för att svara på många typer av forskningsfrågor genom att låta forskare exakt lokalisera enskilda celler inom funktionella enheter, vävnader och organ eller jämföra effekterna av sammanhang på olika celltyper över hela kroppen på makro – och meso – skalorna.
nästa steg och framtida riktningar
i Figur 1 presenterar vi en mycket förenklad och stiliserad representation av vaskulär CCF för att introducera det allmänna konceptet. De faktiska kärlvägarna är mycket mer komplexa, med den fulla vaskulära CCF som så småningom består av hundratals eller tusentals strukturer samt förgreningsmönster som inte följer en strikt nav-och-talade layout. Till exempel skulle venerna i leverportalsystemet, som bär blod från flera organ till levern, och cirkulationsanastomoser, såsom Willis-cirkeln i hjärnan, springa vinkelrätt mot och korsa över ”ekrarna” i Figur 1.
den vaskulära CCF kommer också att behöva införliva normala anatomiska varianter av vaskulaturen, såsom thyroidea ima och dubbla cystiska artärer, på samma sätt som enkla nukleotidpolymorfismer (SNP) beskriver normala variationer i genomet. När vi expanderar och fyller i detaljerna i den vaskulära CCF kan det ta ett mer snöflinga eller webbliknande utseende, med sannolikheter tilldelade olika sektioner för att indikera sannolikheten för att hitta dem i en viss person.
den faktiska vaskulära CCF kommer att kräva ett mer sofistikerat kodningsschema för namngivning av fartyg än vad som visas i Figur 1, för att representera dess komplexitet mer exakt och göra den ”beräkningsbar” av mjukvarualgoritmer. Ett tillvägagångssätt är att bygga på befintliga anatomiska ontologier, såsom UBERON, som redan innehåller unika enhetliga Resursidentifierare (Uri) för många fartyg och definierar olika relationstyper, till exempel ”branching_part_of”, för att beskriva hur fartyg ansluter (25).
en cell kan vara i närheten av mer än ett fartyg, i vilket fall det är möjligt att tilldela det en separat adress i förhållande till varje fartyg. Framtida forskning behövs för att bestämma vad lämpligt ”cutoff” – avstånd ska vara. Det kan vara önskvärt att lagra flera adresser för celler för att hjälpa triangulera sin position i 3D-rymden.
Även om vår initiala motivation för en vaskulär CCF är att definiera ett koordinatsystem för att specificera cellernas placering, kan den nya radiella layouten av människokroppen runt vaskulär, som avbildad i Figur 1, ha andra vetenskapliga tillämpningar. Till exempel har positionsinformation inom detta ramverk analogier till embryologisk utveckling och kan ge insikt i mekanismer som orsakar sjukdom eller dysreguleringar som uppstår från en grupp celler. Till exempel i vaskulär CCF, makrovaskulära sjukdomar associerade med typ 2-diabetes (t.ex. ischemisk hjärtsjukdom, perifer kärlsjukdom och cerebrovaskulär sjukdom) är grupperade nära centrum, medan mikrovaskulära sjukdomar (t. ex. retinopati, nefropati och neuropati) bildar en ring runt utsidan (26).
sammanfattning
kärlsystemet har flera egenskaper som svarar på de egenskaper som tidigare bedömts vara önskvärda för en CCF för att möjliggöra kartläggning av alla celler i människokroppen (7). (1) Det fungerar över flera skalor. Genom ett kontinuerligt endotel gör det en sömlös övergång från stora anatomiska strukturer ner till cellulär nivå. (2) Det är tillämpligt på alla kroppsvävnader. Eftersom organ utvecklas runt kärl, ramar vaskulaturen organarkitektur i alla skalor. Vaskulära mönster är så distinkta att bilder av kärl ensamma, med alla andra celler borttagna, lätt kan användas för att identifiera organet. (3) Det står för givarskillnader. Vaskularisering anpassar sig naturligt till individuella variationer i vävnad, kroppsstorlek och form. Istället för att behöva kartlägga 3D-koordinaterna för varje glomerulus hos en person till de i en annan person, skulle den vaskulära CCF placera varje cell i en representativ glomeruluskapillär från varje person. (4) vaskulaturen är välkänd för utövare av många olika kliniska specialiteter, som hjälper både att diagnostisera sjukdomar och vägleda operationer och används som landmärken av patologer, radiologer och andra kliniker. Detta skulle underlätta positionering av vävnadsprover i kroppen och registrera placeringen av enskilda celler. Medan ingen enskild CCF är idealisk för alla användningsfall, definierar en vaskulär CCF ett naturligt koordinatsystem som skulle göra det enkelt att kombinera biomolekylära data från flera personer och ställa biologiskt relevanta forskningsfrågor.
datatillgänglighet uttalande
offentligt tillgängliga dataset analyserades i denna studie. Dessa data finns här: https://www.proteinatlas.org.
Författarbidrag
GW utformade denna studie baserat på rapporter från 2017 CCF-mötet och 2019 CCF-Workshop. KB och YJ gav kritisk feedback. GW skrev det första utkastet, med ytterligare text transkriberad från ccfws-01 bildpresentation. Alla författare bidrog till att redigera manuskriptet.
finansiering
denna forskning stöddes av National Institutes of Health (NIH) award OT2OD026671. Detta arbete representerar inte yttrandet från NIH eller National Heart, Lung, and Blood Institute (NHLBI).
intressekonflikt
författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.
bekräftelser
Vi tackar Dr. Zorina S. Galis från National Institutes of Health för att hjälpa till att utveckla tanken på ett kärlbaserat koordinatsystem vid CCF-mötet 2017 och CCF-Workshopen 2019, ge oss presentationer från dessa händelser och delta i många diskussioner som låg till grund för detta manuskript. Expertkommentarer från granskarna hjälpte till att klargöra och detaljera det föreslagna vaskulära baserade gemensamma koordinatsystemet.
3. Uhl C. C., Szigyarto CA, Amini B, Andersen E, et al. En human proteinatlas för normala och cancervävnader baserat på antikroppsproteomik. Mol Cell Proteomics. (2005) 4:1920–32. doi: 10.1074 / mcp.M500279-MCP200
PubMed Abstrakt / CrossRef fulltext / Google Scholar
12. L, M, M, Andrae J, Ando K, Del Gaudio F, et al. En molekylär atlas av celltyper och zonering i hjärnans kärl. Natur. (2018) 554:475–80. doi: 10.1038/nature25739
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Johnson C, Sung HJ, Lessner SM, Fini ME, Galis ZS. Matrix metalloproteinase-9 is required for adequate angiogenic revascularization of ischemic tissues: potential role in capillary branching. Circ Res. (2004) 94:262–8. doi: 10.1161/01.RES.0000111527.42357.62
PubMed Abstract | CrossRef Full Text | Google Scholar
15. De Santis V, sångare M. övervakning av Vävnadssyrespänning av organperfusion: motivering, metoder och litteraturöversikt. Br J Anaesth. (2015) 115:357–65. doi: 10.1093 / bja / aev162
PubMed Abstrakt / CrossRef fulltext / Google Scholar
17. Koch CJ. Mätning av absoluta syrenivåer i celler och vävnader med hjälp av syresensorer och 2-nitroimidazol EF5. Metoder Enzymol. (2002) 352:3–31. doi: 10.1016/S0076-6879(02)52003-6
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Paruchuri V, Salhab KF, Kuzmik G, Gubernikoff G, Fang H, Rizzo JA, et al. Aortic size distribution in the general population: explaining the size paradox in aortic dissection. Cardiology. (2015) 131:265–72. doi: 10.1159/000381281
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Abadi e, Segars WP, Sturgeon GM, Roos JE, Ravin CE, Samei E. modellering lungarkitektur i xcat-serien av fantom: fysiologiskt baserade luftvägar, artärer och vener. IEEE Trans med Avbildning. (2018) 37:693–702. doi: 10.1109 / TMI.2017.2769640
PubMed Abstrakt / CrossRef fulltext / Google Scholar
24. Majno P, Mentha G, Toso C, Morel P, Peitgen HO, Fasel JH. Leverans anatomi: en kontur med tre nivåer av komplexitet–ett ytterligare steg mot skräddarsydda territoriella leverresektioner. J Hepatol. (2014) 60:654–62. doi: 10.1016/j.jhep.2013.10.026
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Cade WT. Diabetes-related microvascular and macrovascular diseases in the physical therapy setting. Phys Ther. (2008) 88:1322–35. doi: 10.2522/ptj.20080008
PubMed Abstract | CrossRef Full Text | Google Scholar