Refissa
Generiskt Namn: tretinoin
doseringsform: kräm
medicinskt granskad av Drugs.com. Senast uppdaterad den 1 April 2020.
- översikt
- biverkningar
- dosering
- Professional
- interaktioner
- mer
endast för lokal användning i ansiktet.
- Refissa beskrivning
- Refissa-klinisk farmakologi
- indikationer och användning för Refissa
- kliniska studier DATA
- kontraindikationer
- varningar
- försiktighetsåtgärder
- allmänt
- information för patienter
- läkemedelsinteraktioner
- karcinogenes, mutagenes, nedsatt fertilitet
- graviditet
- graviditetskategori C
- ammande mödrar
- pediatrisk användning
- geriatrisk användning
- biverkningar
- överdosering
- Refissa dosering och administrering
- hur levereras Refissa
- förvaring
- HUVUDDISPLAYPANEL-40 g Rörkartong
- mer om Refissa (tretinoin topical)
- konsumentresurser
- professionella resurser
- relaterade behandlingsguider
Refissa beskrivning
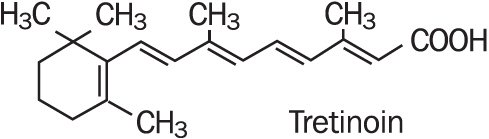
Refissa, innehåller den aktiva ingrediensen tretinoin (en retinoid) i en mjukgörande krämbas. Tretinoin är ett gul-till-orange kristallint pulver med en karakteristisk blommig lukt. Tretinoin är lösligt i dimetylsulfoxid, något lösligt i polyetylenglykol 400, oktanol och 100% etanol. Det är praktiskt taget olösligt i vatten och mineralolja, och det är olösligt i glycerin. Det kemiska namnet för tretinoin är (all-E)-3,7-dimetyl-9-(2,6,6-trimetyl-1-cyklonexen-1-yl) – 2,4,6,8-nonatetraensyra. Tretinoin kallas också all-trans-retinsyra och har en molekylvikt på 300,44. Strukturformeln representeras nedan.
Refissa innehåller tretinoin i en koncentration av 0.05% w/w in a water-in-oil emulsion formulation consisting of light mineral oil, sorbitol solution, hydroxyoctacosanyl hydroxystearate; methoxy PEG-22/dodecyl glycol copolymer, PEG-45/dodecyl glycol copolymer, stearoxytrimethylsilane and stearyl alcohol, dimethicone 50 cs, methylparaben, edetate disodium, propylparaben, butylated hydroxytoluene, citric acid monohydrate, and purified water.
Refissa-klinisk farmakologi
den exakta verkningsmekanismen för tretinoin är okänd även om retinoider tros utöva en effekt på tillväxten och differentieringen av olika epitelceller. När det applicerades topiskt var det emellertid ingen noterad ökning av desmosin, hydroxiprolin eller elastin mRNA i mänsklig hud. Dessutom har rollen av den irriterande naturen hos denna produkt för att åstadkomma de positiva effekterna som tillskrivs denna produkt för dess indikation ännu inte fastställts fullständigt.
den transdermala absorptionen av tretinoin från olika topiska formuleringar varierade från 1% till 31% av den applicerade dosen, beroende på om den applicerades på frisk hud eller dermatitisk hud. Vid perkutan absorption av tretinoinkräm utvärderades USP (mjukgörande) 0,05% hos friska manliga försökspersoner (n=14) efter en enda applicering, liksom efter upprepade dagliga applikationer i 28 dagar, absorptionen av tretinoin var mindre än 2% och endogena koncentrationer av tretinoin och dess huvudmetaboliter var oförändrade.
indikationer och användning för Refissa
(för att förstå indikationen för denna produkt, läs hela avsnittet indikationer och användning i märkningen.)
Refissa är indicerat som ett tilläggsmedel (se andra punktpunkten nedan) för användning vid lindring (palliation) av fina rynkor, fläckig hyperpigmentering och taktil grovhet i ansiktshuden hos patienter som inte uppnår sådan palliation med hjälp av omfattande hudvård och solundvikande program (se punkt 3 för populationer där effektivitet inte har fastställts). Refissa eliminerar inte rynkor, reparerar solskadad hud, omvänd fotografering eller återställer ett mer ungdomligt eller yngre HUDHISTOLOGISKT mönster. Många patienter uppnår önskade palliativa effekter på fina rynkor, fläckig hyperpigmentering och taktil grovhet i ansiktshuden med hjälp av omfattande hudvård och solundvikande program inklusive solskyddsmedel, skyddskläder och mjukgörande krämer som inte innehåller tretinoin.
- tretinoinkräm, USP (mjukgörande) 0.05% har inte visat någon förmildrande effekt på signifikanta tecken på kronisk solexponering såsom grov eller djup rynkning, hudgulning, lentiginer, telangiektasi, hudslakhet, keratinocytisk atypi, melanocytisk atypi eller dermal Elastos.
- Refissa ska användas under medicinsk övervakning som ett komplement till ett omfattande hudvårds-och solskyddsprogram som inkluderar användning av effektiva solskyddsmedel (minimun SPF på 15) och skyddskläder när önskat resultat på fina rynkor, fläckig hyperpigmentering och grovhet i ansiktshuden inte har uppnåtts med ett omfattande hudvårds-och solskyddsprogram ensam.
- effektiviteten av Refissa för att mildra fina rynkor, fläckig hyperpigmentering och taktil grovhet i ansiktshuden har inte fastställts hos personer över 50 år eller hos personer med måttligt till kraftigt pigmenterad hud. Dessutom uteslöts patienter med synliga aktiniska keratoser och patienter med hudcancer i anamnesen från kliniska prövningar av tretinoinkräm, USP (mjukgörande) 0, 05%. Således är effektiviteten och säkerheten för Refissa i dessa populationer inte känd vid denna tidpunkt.
- varken säkerheten eller effekten av Refissa för förebyggande eller behandling av aktiniska keratoser eller hudneoplasmer har fastställts.
- varken säkerheten eller effekten av att använda Refissa dagligen i mer än 48 veckor har fastställts, och daglig användning efter 48 veckor har inte systematiskt och histologiskt undersökts i adekvata och välkontrollerade studier. (Se avsnittet varningar.)
kliniska studier DATA
två adekvata och välkontrollerade studier genomfördes med totalt 161 utvärderbara patienter (under 50 år) behandlade med tretinoinkräm, USP (mjukgörande) 0,05% och 154 utvärderbara patienter behandlade med vehicle mjukgörande kräm i ansiktet i 24 veckor som ett komplement till ett omfattande hudvårds-och solundvikande program, för att bedöma effekterna på fina rynkor, fläckig hyperpigmentering och taktil hud grovhet. Patients were evaluated at baseline on a 10-point scale, and changes from that baseline rating were categorized as follows:
| No Improvement: | No change or an increase of 1 unit or more | |
| Minimal Improvement: | Reduction of 1 unit | |
| Moderate Improvement: | reduktion av 2 enheter eller mer |
i dessa studier ansågs de fina rynkorna, fläckig hyperpigmentering och taktil grovhet i ansiktshuden orsakas av flera faktorer som inkluderade inneboende åldrande eller miljöfaktorer, såsom kronisk solexponering.
resultaten av dessa bedömningar är följande:
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 36% | 40% | 24% |
| Vehicle + CSP | 62% | 30% | 8% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 35% | 27% | 38% |
| Vehicle + CSP | 53% | 21% | 27% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| * CSP= Comprehensive skin protection and sun avoidance programs included use of sunscreens, protective clothing, and emollient cream. | |||
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 49% | 35% | 16% |
| fordon + CSP | 67% | 23% | 10% |
det mesta av förbättringen av dessa tecken noterades under de första 24 veckorna av behandlingen. Därefter bibehöll terapin främst den förbättring som realiserades under de första 24 veckorna.en majoritet av patienterna kommer att förlora de mest förmildrande effekterna av Refissa på fina rynkor, fläckig hyperpigmentering och taktil grovhet i ansiktshuden med avbrytande av ett omfattande hudvård och solundvikande program inklusive Refissa; säkerheten och effektiviteten av att använda Refissa dagligen i mer än 48 veckor har dock inte fastställts.
kontraindikationer
detta läkemedel är kontraindicerat hos individer med en historia av känslighetsreaktioner på någon av dess komponenter. Det bör avbrytas om överkänslighet mot någon av dess ingredienser noteras.
varningar
- Refissa är en hudirritation, och resultaten av fortsatt hudirritation i mer än 48 veckor vid kronisk långvarig användning är inte kända. Det finns tecken på atypiska förändringar i melanocyter och keratinocyter och ökad dermal Elastos hos vissa patienter behandlade med tretinoinkräm, USP (mjukgörande) 0, 05% längre än 48 veckor. Betydelsen av dessa fynd är okänd.
- säkerhet och effekt av Refissa hos individer med måttligt eller kraftigt pigmenterad hud har inte fastställts.
- Refissa ska inte administreras om patienten också tar läkemedel som är kända för att vara fotosensibilisatorer (t.ex. tiazider, tetracykliner, fluorokinoloner, fenotiaziner, sulfonamider) på grund av möjligheten till ökad fototoxicitet.
på grund av ökad brännkänslighet bör exponering för solljus (inklusive sollampor) undvikas eller minimeras under användning av Refissa. Patienter måste varnas för att använda solskyddsmedel (minst SPF på 15) och skyddskläder vid användning av Refissa. Patienter med solbränna bör rådas att inte använda Refissa förrän de är helt återhämtade. Patienter som kan ha betydande solexponering, t.ex. på grund av sitt yrke och de patienter med inneboende känslighet för solljus, bör vara särskilt försiktiga när de använder Refissa och försäkra sig om att de försiktighetsåtgärder som beskrivs i Patientbipacksedeln följs.
Tretinoin Cream, USP (mjukgörande) 0,05% bör hållas borta från ögon, mun, näsvinklar och slemhinnor. Lokal användning kan orsaka allvarlig lokal erytem, klåda, brännande, stickande och skalning på applikationsstället. Om graden av lokal irritation motiverar, bör patienterna instrueras att använda mindre medicinering, minska appliceringsfrekvensen, avbryta användningen tillfälligt eller avbryta användningen helt.
Tretinoin har rapporterats orsaka allvarlig irritation på ekosematös hud och bör endast användas med försiktighet hos patienter med detta tillstånd.
applicering av större mängder medicin än rekommenderat leder inte till snabbare eller bättre resultat, och markerad rodnad, skalning eller obehag kan uppstå.
försiktighetsåtgärder
allmänt
Refissa ska endast användas som ett komplement till ett omfattande hudvårds-och solskyddsprogram. (Se avsnittet indikationer och användning.)
om en läkemedelskänslighet, kemisk irritation eller en systemisk biverkning utvecklas, bör användning av Refissa avbrytas.
väder extremiteter, såsom vind eller kyla, kan vara mer irriterande för patienter som använder Refissa.
information för patienter
se Patientbipacksedeln.
läkemedelsinteraktioner
samtidig topikala läkemedel, medicinerade eller slipande tvålar, schampon, rengöringsmedel, kosmetika med stark torkningseffekt, produkter med höga koncentrationer av alkohol, astringenter, kryddor eller kalk, permanenta våglösningar, elektrolys, hårborttagningsmedel eller vaxer och produkter som kan irritera huden bör användas med försiktighet hos patienter som behandlas med Refissa eftersom de kan öka irritationen med Refissa.
Refissa ska inte administreras om patienten också tar läkemedel som är kända för att vara fotosensibiliserande (t. ex., tiazider, tetracykliner, fluorokinoloner, fenotiaziner, sulfonamider) på grund av möjligheten till ökad fototoxicitet.
karcinogenes, mutagenes, nedsatt fertilitet
i en livstids dermal studie på CD – 1-möss vid 100 och 200 gånger den genomsnittliga rekommenderade humana topiska kliniska dosen observerades några hudtumörer hos honmöss och levertumörer hos hanmöss. Den biologiska betydelsen av dessa fynd är inte tydlig eftersom de inträffade vid doser som överskred den dermala maximalt tolererade dosen (MTD) av tretinoin och eftersom de var inom bakgrunden naturlig förekomst för dessa tumörer i denna stam av möss. Det fanns inga tecken på karcinogen potential när tretinoin administrerades topiskt i en dos 5 gånger den genomsnittliga rekommenderade humana topiska kliniska dosen. För jämförelser av djurexponeringen till den mänskliga exponeringen definieras den ”rekommenderade humana topiska kliniska dosen” som 500 mg Refissa som appliceras dagligen på en 50 kg person.
i en kronisk, tvåårig bioanalys av vitamin A-syra hos möss utförda av Tsubura och Yamamoto rapporterades generaliserad amyloidavsättning i alla grupper i basskiktet i den Vitamin A-behandlade huden. Hos CD – 1-möss rapporterade en liknande studie hyalinisering av de behandlade hudställena och förekomsten av detta fynd var 0/50, 3/50 och 2/50 hos hanmöss och 1/50, 0/50, 4/50 och 2/50 hos honmöss från vehicle control, 0,25 mg/kg, 0,5 mg/kg respektive 1 mg/kg grupper.
studier på hårlösa albinomöss tyder på att tretinoin kan öka tumörpotentialen hos cancerframkallande doser av UVB-och UVA-ljus från en solsimulator. I andra studier, när lätt pigmenterade hårlösa möss behandlade med tretinoin exponerades för cancerframkallande doser av UVB-ljus, var förekomsten och graden av utveckling av hudtumörer antingen reducerad eller ingen effekt sågs. På grund av signifikant olika experimentella förhållanden är ingen strikt jämförelse av dessa olika data möjlig vid denna tidpunkt. Även om betydelsen av dessa studier på människor inte är tydlig, bör patienter minimera exponering för sol.
den Mutagena potentialen för tretinoin utvärderades i Ames-analysen och i in vivo-musmikrokärnanalysen, vilka båda var negativa.
dermal Segment i och III studier med Tretinoin Cream, USP (mjukgörande) 0,05% har inte utförts på någon art. I orala Segment i-och Segment III-studier på råttor med tretinoin observerades minskad överlevnad hos nyfödda och tillväxthämning vid doser över 2 mg/kg/dag (>400 gånger den genomsnittliga humana topiska kliniska dosen).
graviditet
teratogena effekter
graviditetskategori C
Oralt tretinoin har visat sig vara teratogent hos råttor, möss, kaniner, hamstrar och subhumana primater. Det var teratogent och fetotoxiskt hos råttor när det gavs oralt eller topiskt i doser 1000 gånger den genomsnittliga rekommenderade humana topiska kliniska dosen. Variationer i teratogena doser mellan olika stammar av råttor har dock rapporterats. Hos cynomolgusapan, som metaboliskt är närmare människa för tretinoin än de andra undersökta arterna, rapporterades fostermissbildningar vid doser på 10 mg/kg/dag eller mer, men ingen observerades vid 5 mg/kg / dag (1000 gånger den genomsnittliga rekommenderade humana topiska kliniska dosen), även om ökade skelettvariationer observerades vid alla doser. En dosrelaterad ökning av embryoletalitet och abort rapporterades. Liknande resultat har också rapporterats i pigtailmakaker.
topisk tretinoin i djurteratogenicitetstester har genererat tvetydiga resultat. Det finns bevis för teratogenicitet (förkortad eller kinkad svans) av topisk tretinoin hos Wistar-råttor vid doser större än 1 mg/kg/dag (200 gånger den rekommenderade humana topiska kliniska dosen). Anomalier (humerus: kort 13%, böjd 6%, os parietal ofullständigt ossifierad 14%) har också rapporterats när 10 mg/kg/dag applicerades dermalt.
det finns andra rapporter i Nya Zeeland vita kaniner administrerade med doser på cirka 80 gånger den rekommenderade humana topiska kliniska dosen av en ökad förekomst av kupolformat huvud och hydrocefali, typiskt för retinoidinducerade fostermissbildningar hos denna art.
däremot har flera välkontrollerade djurstudier visat att dermalt applicerat tretinoin inte var teratogent, i doser på 100 respektive 200 gånger den rekommenderade humana topiska kliniska dosen, hos råttor respektive kaniner.
med utbredd användning av något läkemedel kan ett litet antal födelsedefektrapporter som är associerade temporärt med administreringen av läkemedlet förväntas av en slump ensam. Trettio fall av temporärt associerade medfödda missbildningar har rapporterats under två decennier av klinisk användning av en annan formulering av topisk tretinoin (Retin-A). Även om inget bestämt mönster av teratogenicitet och ingen avslappnad förening har upprättats från dessa fall, beskriver 5 av rapporterna den sällsynta födelsedefektkategorin holoprosencephaly (defekter associerade med ofullständig mittlinjeutveckling av framhjärnan). Betydelsen av dessa spontana rapporter när det gäller risk för fostret är inte känd.
Icke-teratogena effekter
dermal tretinoin har visats vara fetotoxiskt hos kaniner vid administrering i doser 100 gånger den rekommenderade topiska humana kliniska dosen. Oralt tretinoin har visat sig vara fetotoxiskt hos råttor när det administreras i doser 500 gånger den rekommenderade topiska humana kliniska dosen.
det finns dock inga adekvata och välkontrollerade studier på gravida kvinnor. Refissa ska inte användas under graviditet.
ammande mödrar
det är inte känt om detta läkemedel utsöndras i bröstmjölk. Eftersom många läkemedel utsöndras i bröstmjölk, bör försiktighet iakttas när Refissa administreras till en ammande kvinna.
pediatrisk användning
säkerhet och effektivitet hos patienter under 18 år har inte fastställts.
geriatrisk användning
säkerhet och effekt hos individer äldre än 50 år har inte fastställts.
biverkningar
( se avsnitt varningar och försiktighetsåtgärder.)
i dubbelblinda, vehikelkontrollerade studier med 179 patienter som applicerade tretinoinkräm, USP (mjukgörande) 0, 05% i ansiktet, var biverkningar associerade med användning av tretinoinkräm, USP (mjukgörande) 0, 05% begränsade främst till huden. Under dessa studier var 4% av patienterna tvungna att avbryta användningen av tretinoinkräm, USP (mjukgörande) 0,05% på grund av biverkningar. Dessa avbrott berodde på hudirritation eller relaterade kutana biverkningar.
lokala reaktioner såsom peeling, torr hud, brännande, stickande, erytem och klåda rapporterades av nästan alla försökspersoner under behandling med tretinoinkräm, USP (mjukgörande) 0, 05%. Dessa tecken och symtom var vanligtvis av mild till måttlig svårighetsgrad och inträffade vanligtvis tidigt i behandlingen. Hos de flesta patienter återkom torrhet, skalning och rodnad efter en initial (24 veckor) nedgång.
överdosering
användning av större mängder läkemedel än rekommenderat har inte visat sig leda till snabbare eller bättre resultat, och markerad rodnad, skalning eller obehag kan uppstå. Oral intag av läkemedlet kan leda till samma biverkningar som de som är förknippade med överdriven oral intag av Vitamin A.
Refissa dosering och administrering
- använd inte Refissa om patienten är gravid eller försöker bli gravid eller har hög risk för graviditet
- använd inte Refissa om patienten är solbränd eller om patienten har eksem eller andra kroniska hudförhållanden
- använd inte Refissa om patienten är naturligt känslig för solljus
- använd inte Refissa om patienten också tar läkemedel som är kända för att vara fotosensibiliserande(t.ex. tiazider, tetracykliner, fluorokinoloner, fenotiaziner, sulfonamider) på grund av möjligheten till ökad fototoxicitet.
patienter behöver detaljerade instruktioner för att få maximal nytta och för att förstå alla försiktighetsåtgärder som krävs för att använda denna produkt med största säkerhet. Läkaren bör granska Patientbipacksedeln.
Refissa ska appliceras på ansiktet en gång om dagen innan du går i pension, med bara tillräckligt för att täcka hela det drabbade området lätt. Patienterna ska försiktigt tvätta ansikten med en mild tvål, klappa huden torr och vänta 20 till 30 minuter innan du applicerar Refissa. Patienten ska applicera en ärtstor mängd kräm för att täcka hela ansiktet lätt. Särskild försiktighet bör vidtas vid applicering av grädden för att undvika ögon, öron, näsborrar och mun.
applicering av Refissa kan orsaka en övergående känsla av värme eller lätt stickande.
Mitigation (palliation) av fina rynkor i ansiktet, fläckig hyperpigmentering och taktil grovhet kan uppstå gradvis under behandlingens gång. Upp till sex månaders behandling kan krävas innan effekterna ses. Det mesta av förbättringen som noteras med Refissa ses under de första 24 veckorna av behandlingen. Därefter upprätthåller terapin främst den förbättring som uppnåtts under de första 24 veckorna.
vid avbrytande av Refissa-behandling kommer en majoritet av patienterna att förlora de mest förmildrande effekterna av Refissa på fina rynkor, fläckig hyperpigmentering och taktil grovhet i ansiktshuden; säkerheten och effektiviteten av att använda Refissa dagligen i mer än 48 veckor har dock inte fastställts.
applicering av större mängder läkemedel än rekommenderat kan inte leda till snabbare resultat eller bättre resultat, och markerad rodnad, skalning eller obehag kan uppstå.
patienter som behandlas med Refissa kan använda kosmetika, men de områden som ska behandlas bör rengöras noggrant innan läkemedlet appliceras. (Se avsnittet försiktighetsåtgärder.)
hur levereras Refissa
Refissa finns i:
20 g tuber NDC 42851-012-20
40 g tuber NDC 42851-012-40
förvaring
Förvara vid 20-25 C (68-77 f) . FÅR EJ FRYSAS.
endast Rx.
tryckt i USA
140904-0118
Tillverkad av DPT Laboratories, San Antonio, TX 78215
distribueras av ZO Skin Health, Inc., Irvine, CA 92618
refissa bisexuell
för lokal användning i ansiktet
vad är den viktigaste informationen om Refissa ?
Refissa är ett allvarligt läkemedel. Det eliminerar inte rynkor eller reparerar solskadad hud. Det kan hjälpa till att behandla fina rynkor, fläckig missfärgning och grov hudkänsla, men det ”botar” inte dessa tillstånd. Refissa ska endast användas under överinseende av din vårdgivare som en del av ett brett hudvårdsprogram. Detta program bör omfatta att undvika direkt solljus (genom att använda skyddskläder och solskyddsmedel med minst SPF på 15) och använda andra fuktgivande Ansiktskrämer som inte innehåller tretinoin.
Du bör bara använda Refissa vid sänggåendet. Använd inte torkande hudvårdsprodukter. Använd den minsta mängd Refissa som behövs och undvik att få den i ögon, öron, näsa eller mun.
VARNING: Använd inte Refissa om du är gravid eller försöker bli gravid. Undvik solljus och andra läkemedel som kan öka din känslighet för solljus (se nedan).
Refissa har inte studerats hos personer som är över 50 år eller hos personer med måttligt eller mörkt pigmenterad hud.
vad är Refissa?
(vad kan jag förvänta mig av Refissa?)
Refissa är ett allvarligt läkemedel som kan hjälpa till att behandla men kommer inte att ”bota” fina rynkor, fläckig missfärgning av huden och grov hudkänsla.
studier visar att efter 24 veckor hade cirka 30% av de personer som använde tretinoinkräm, USP (mjukgörande) 0,05% för fina rynkor eller fläckig missfärgning måttlig förbättring, ytterligare 35% hade minimal förbättring och 35% hade ingen förbättring. Cirka 16% av de personer som använde tretinoinkräm, USP (mjukgörande) 0,05% för grov hud hade måttlig förbättring, 35% hade minimal förbättring och 49% hade ingen förbättring. Det finns inga bevis för att Refissa behandlar grov hud, djupa rynkor, gulnande hud eller andra hudvårdsproblem.
Refissa ska användas som en del av ett brett hudvårdsprogram. Detta program bör omfatta att undvika direkt solljus (genom att använda skyddskläder och solskyddsmedel med minst SPF på 15) och använda andra fuktgivande Ansiktskrämer som inte innehåller tretinoin. Många människor kan uppnå önskade effekter genom att använda detta program utan att använda Refissa. Du bör inte använda Refissa förrän du har provat ett brett hudbehandlingsprogram utan Refissa.
När du använder Refissa är förbättring av fina rynkor, fläckig missfärgning av huden och grov hud inte omedelbar och sker gradvis över tiden. Generellt kan du märka några effekter på 3 till 4 månader. Effekterna är vanligtvis mest märkbara på cirka 6 månader med liten ytterligare förbättring efter den tiden. Om Refissa stoppas kommer förbättringen gradvis att minska.
säkerheten vid användning av Refissa dagligen i mer än 48 veckor har inte fastställts.
vem ska inte använda Refissa?
Du ska inte använda Refissa om du är solbränd eller mycket känslig för solen, om du har eksem eller om din hud är irriterad. Refissa kan orsaka ökad hudirritation och ökad mottaglighet för solbränna.
eftersom Refissa kan göra din hud mer känslig för solljus, bör du berätta för din sjukvårdspersonal om du också använder andra läkemedel som ökar känsligheten för solljus eftersom du inte ska använda Refissa med dessa läkemedel. Dessa inkluderar men är inte begränsade till: tiazider (används för att behandla högt blodtryck), tetracykliner, fluorokinolnes eller sulfonamider (används för att behandla infektion) och fenotiaziner (används för att behandla allvarliga känslomässiga problem). Om du tar receptbelagda läkemedel, receptfria läkemedel eller använder Ansiktskrämer, kontakta en sjukvårdspersonal för att se till att de inte interagerar med Refissa.
Graviditetsvarning: säker användning under graviditet har inte visats. Det finns rapporter om fosterskador med laboratoriedjur och människor som fick tretinoin genom munnen. Du ska inte använda Refissa om du är gravid eller försöker bli gravid.
det är inte känt om Refissa överförs till spädbarn genom bröstmjölk. Säker användning hos barn har inte visats.
säkerheten och effektiviteten hos Refissa för personer över 50 år eller med mörkare hudfärgning har inte bevisats.
hur ska jag använda Refissa?
Du bör applicera Refissa i ansiktet en gång om dagen innan du går i pension med bara tillräckligt för att täcka hela det drabbade området lätt. Tvätta ansiktet försiktigt med en mild tvål, klappa huden torr och vänta 20 till 30 minuter innan du applicerar Refissa. Applicera en ärtstor mängd grädde för att täcka hela ansiktet. Du kan känna en värme eller lätt stickande när Refissa appliceras först.
Du måste vara särskilt försiktig när du applicerar grädden för att undvika ögon, öron, näsborrar eller mun. Refissa kan orsaka allvarlig rodnad, klåda, sveda, sveda och peeling om de appliceras på dessa områden.
användning av större än nödvändiga mängder Refissa kommer inte att påskynda resultaten och kan orsaka överdosering. En överdos kan leda till röd och skalande hud samt viss smärta eller obehag.
Du kan använda kosmetika efter applicering av Refissa. Se till att rengöra ansiktet noggrant innan du applicerar Refissa igen.
vad ska jag undvika när jag använder Refissa?
Refissa ökar din känslighet för solljus. Undvik solljus så mycket som möjligt. Använd skyddskläder och solskyddsmedel med minst SPF på 15. Sola inte eller använd sollampor. Om du är känslig för solljus eller har ett jobb som kräver att du är ute i solen under långa perioder, måste du vara mycket försiktig.
undvik produkter som kan torka eller irritera huden när du använder Refissa. Undvik till exempel produkter som appliceras på huden som innehåller alkohol, kryddor eller kalk. Undvik också rengöringsmedel, hårborttagning eller andra produkter som kan irritera huden.
vilka är de möjliga biverkningarna av Refissa?
de vanligaste biverkningarna är hudreaktioner. Klåda, röd och torr hud har rapporterats. Så har brinnande, stickande och skalande hud. Dessa är oftast milda och är vanligast när behandlingen påbörjas.
hur kan jag få ytterligare Information?
denna bipacksedel sammanfattade den viktigaste informationen om Refissa. Om du vill ha mer information, tala med din läkare eller annan vårdgivare. Det finns också en broschyr skriven för vårdpersonal som din apotekare kan ge dig.
ring din läkare för medicinsk rådgivning om biverkningar. DU KAN RAPPORTERA BIVERKNINGAR TILL FDA PÅ 1-800-FDA-1088.
HUVUDDISPLAYPANEL-40 g Rörkartong
NDC 42851-012-40
117471-0118
refissa Portugals
tretinoin Cream,
USP (mjukgörande) 0.05%
Rx Only
NET WT 40 g
FDA APPROVED

| Refissa TRETINOIN (EMOLLIENT) tretinoin cream |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
Labeler – ZO Skin Health, Inc. (826468527)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| DPT Laboratories, Ltd. | 832224526 | manufacture(42851-012) | |
mer om Refissa (tretinoin topical)
- biverkningar
- under graviditet eller amning
- doseringsinformation
- läkemedelsinteraktioner
- prissättning & kuponger
- en Espa Portugol
- läkemedelsklass: topiska akne medel
konsumentresurser
- patientinformation
- refissa aktuell (avancerad läsning)
professionella resurser
- förskrivningsinformation
- tretinoin gel microsphere (FDA)
andra märken Retin-A, Renova, Atralin, altreno, … + 2 fler
relaterade behandlingsguider
- fotografering av huden
Medicinsk ansvarsfriskrivning