SF6 molekylär geometri, Lewis struktur, form och polaritet
svavelhexafluorid eller SF6 är en oorganisk växthusgas. Det är icke brandfarligt, luktfritt och färglöst och är en utmärkt isolator. Det är en hypervalent oktaedrisk molekyl som har varit ett intressant samtalsämne bland kemientusiaster.
Henri Moissan upptäckte förekomsten av SF6. Förresten är han också upptäckaren av fluor. Det vanliga sättet att syntetisera SF6 är att exponera S8 till F2. Denna metod orsakar bildandet av några svavelfluorider, men de kan elimineras genom uppvärmning och sedan använda NaOH för att avlägsna eventuella ytterligare SF4-molekyler.
SF6 kan inte användas omedelbart efter syntes. Det måste renas för att bli av med alla reaktiva fluorider. Därefter måste det gå igenom pyrolys.
här i detta blogginlägg kommer vi att lära oss Lewis-strukturen i SF6 och dess Bindningsvinklar, molekylär geometri och form som kan hjälpa oss att förstå de fysikaliska egenskaperna hos denna molekyl.
| Name of molecule | Sulphur Hexafluoride ( SF6) |
| No of Valence Electrons in the molecule | 48 |
| Hybridization of SF6 | sp3d2 hybridization |
| Bond Angles | 90 degrees |
| Molecular Geometry of SF6 | Octahedral |
Contents
SF6 Valence Electrons
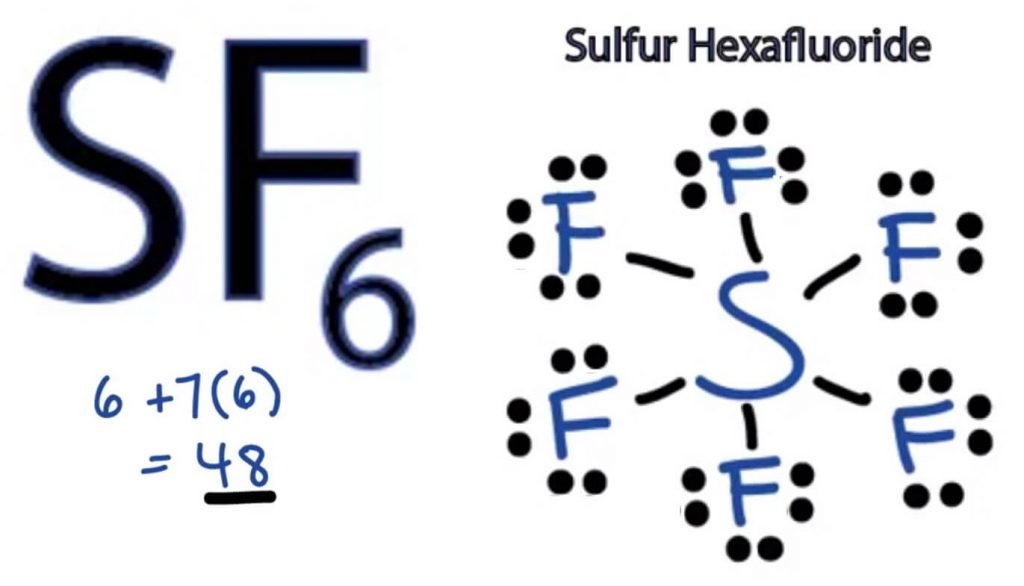
To determine the Lewis Struktur av någon molekyl, måste vi först veta det totala antalet valenselektroner. Här kommer vi att ta reda på det totala antalet valenselektroner för SF6 genom att lägga till valenselektronerna för både svavel-och fluoratomer.
Totalt antal valenselektroner i SF6-valenselektroner av svavel + valenselektroner av fluor
svavel har sex valenselektroner.
Fluor har sju valenselektroner, men eftersom det finns sex fluoratomer i denna molekyl kommer vi att multiplicera detta nummer med 6.
= 6 + 7*6
= 6 + 42
= 48 valenselektroner
således har SF6 48 valenselektroner som hjälper oss att rita Lewis Dot-strukturen i SF6.
SF6 Lewis Structure
Lewis Dot structure av vilken molekyl som helst är en bildrepresentation av de atomer som är involverade i bildandet av strukturen och dess individuella valenselektroner. Denna struktur hjälper oss att känna till bindningsformationerna i molekylen och arrangemanget av elektroner i den.
svavelatom kommer att ta den centrala positionen eftersom den är mindre elektronegativ än Fluor. Så placera den i mitten och alla fluoratomer runt den så här:
fluoratom behöver bara en valenselektron för att slutföra sin oktett. Eftersom varje atom följer oktettregeln för att uppnå en stabil struktur, kommer Fluoratomen att dela en valenselektron av svavelatomen. Således kommer svavel att dela sex av sina valenselektroner med alla fluoratomer som resulterar i att bilda sex enkelbindningar mellan S och F.
I Lewis-strukturen visar vi bindningarna i strukturen genom att dra en rak linje mellan två atomer. Så alla dessa bindningar tar upp 12 valenselektroner av 48.
Placera alla återstående valenselektroner runt Fluoratomerna och kontrollera om oktetterna för alla fluoratomer är fullständiga.
När du gör det kommer du att se valenselektroner i de yttre skalen på alla fluoratomer, men svavel har mer än 8 elektroner i sitt yttre skal. Detta beror på att det är ett undantag från oktettrollen och kan expandera sin orbital för att rymma fler elektroner.
därför är detta rätt Lewis-struktur för SF6.
SF6 hybridisering
Nu när vi känner till Lewis-strukturen för SF6 kan vi nu bestämma atomernas hybridisering i molekylen. Här när svavel delar sina elektroner med Fluoratomerna kommer vi att titta på dess hybridisering.
den elektroniska konfigurationen av SF6 i dess marktillstånd är 3s23p4. Men när den delar elektroner och är i exciterat tillstånd blir elektronparen i både 3s och 3P orbitaler oparade. Dessa elektroner rör sig för att fylla de högre lediga 3D-orbitalerna. Som ett resultat bildas sex hybridorbitaler (en av 3s, tre av 3P och två 3d). Dessa hybridorbitaler är de som rymmer de delade elektronerna. Dessa orbitaler överlappar med 2p-orbitalerna i fluoratomen när svavel-och fluoratomer bildar bindningar. Dessa sex orbitaler är i de sex riktningarna av oktaedronformen. därför har svavelhexafluorid sp3d2-hybridisering.
SF6-bindningsvinkel
eftersom svavel delar sina valenselektroner med 6 fluoratomer kan vi se att alla sex elektroner i svavelatomen delas för att bilda bindningar. Bindningsvinkeln för F-S-F är 90 grader.
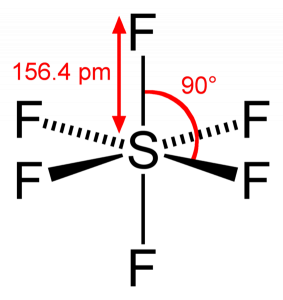
SF6 molekylär geometri
När vi tittar på svavelhexafluoridmolekyl är svavel i det centrala läget med fluoratomerna anordnade symmetriskt runt den. Atomerna placeras i det oktaedriska mönstret, vilket gör att SF6: s molekylära geometri är oktaedrisk.
SF6-form
titta på molekylens molekylära geometri kan vi säga att SF6-molekylen har en oktaedrisk form eftersom den har åtta sidor. Emellertid är de centrala atombindningarna med sex fluoratomer, formen av SF6 oktaedrisk.

är SF6 polär eller icke-polär?
SF6 är en icke-polär molekyl. Detta beror på att VSEPR-teorin säger att när sex fluoratomer är ordnade symmetriskt runt svavelatomen avbryts bindningsdipolerna. Som ett resultat är det en icke-polär molekyl.

det har också samma egenskaper som icke-polära molekyler, såsom att vara icke-lösliga i vatten och lösliga i icke-polära organiska lösningsmedel.
avslutande anmärkningar
för att sammanfatta denna artikel kan vi säga att I Lewis dot-strukturen i SF6 används alla valenselektroner, vilket resulterar i att sex enkelbindningar bildas mellan S-F utan ensamma elektronpar.
hybridiseringen av svavel i denna molekyl är sp3d2 med bindningsvinklarna på 90 grader.
SF6: s molekylära geometri är oktaedrisk och det är en icke-polär molekyl.