7.18: Vinyl Halogenidy a Aryl Halogenidy
Nucleophilic substitution v aryl halogenidy
podíváme se podrobněji na strukturu chlorbenzen. Bromobenzen a jodobenzen jsou stejné. Nejjednodušší způsob, jak nakreslit strukturu chlorbenzenu, je:
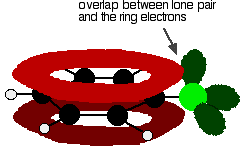
pochopit, chlorbenzen správně, budete muset kopat trochu hlouběji, než je tato. Existuje interakce mezi delokalizovanými elektrony v benzenovém kruhu a jedním z osamělých párů na atomu chloru. To se překrývá s delokalizovaným kruhovým elektronovým systémem . . .
dávají strukturu, spíše jako toto:
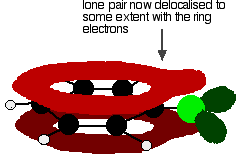
delokalizace je v žádném případě úplný, ale má významný vliv na vlastnosti obou uhlík-chlór dluhopisů a polarita molekuly. Delokalizace zavádí určité zvláštní spojení mezi uhlíkem a chlorem, čímž je vazba silnější. To má významný vliv na reakce sloučenin, jako je chlorbenzen.
existuje také určitý pohyb elektronů od chloru směrem k kruhu. Chlor je poměrně elektronegativní a obvykle přitahuje elektrony ve vazbě uhlík-chlor k sobě. V tomto případě je to do jisté míry kompenzováno pohybem elektronů zpět směrem k kruhu v delokalizaci. Molekula je méně polární, než byste jinak očekávali.
jednoduché arylhalogenidy jako chlorbenzen jsou velmi odolné vůči nukleofilní substituci. Chlor je možné nahradit-OH, ale pouze za velmi náročných průmyslových podmínek – například při 200°C a 200 atmosférách. V laboratoři se tyto reakce nestávají. Existují dva důvody – v závislosti na tom, o kterém z výše uvedených mechanismů mluvíte.
- extra sílu uhlík-halogen bond v aryl halogenidy: uhlík-chlór dluhopisů v chlorbenzenu je silnější, než byste mohli očekávat. Existuje interakce mezi jedním z osamělých párů na atomu chloru a delokalizovanými kruhovými elektrony, což posiluje vazbu. Oba výše uvedené mechanismy zahrnují přerušení vazby uhlík-halogen v určité fázi. Čím obtížnější je zlomit, tím pomalejší bude reakce.
- Odpuzování od prstence elektronů: To bude platit pouze tehdy, pokud sodný ion napadl chlorbenzen mechanismem jako první je popsáno výše. V tomto mechanismu hydroxidový ion útočí na mírně pozitivní uhlík, ke kterému je atom halogenu připojen.Pokud je atom halogenu připojen k benzenovému kruhu, příchozí hydroxidový ion bude čelit delokalizovaným kruhovým elektronům nad a pod tímto atomem uhlíku. Negativní hydroxidový iont bude jednoduše odpuzován. Tento konkrétní mechanismus je prostě nestartér!