Refissa
Generic Name: tretinoin
Léková Forma: krém
Lékařsky přezkoumány Drugs.com. Naposledy aktualizován dne 1. dubna 2020.
- Přehled
- Nežádoucí Účinky
- Dávkování
- Odborné
- Interakce
- Další
PRO LOKÁLNÍ POUŽITÍ NA OBLIČEJ.
- Refissa popis
- Refissa – Klinická Farmakologie
- indikace a použití přípravku Refissa
- ÚDAJE o KLINICKÝCH HODNOCENÍCH
- Kontraindikace
- Varování
- bezpečnostní Opatření
- Obecné
- informace pro pacienty
- lékové Interakce
- Karcinogeneze, Mutageneze, Poškození Fertility
- Těhotenství
- Těhotenství Kategorie C
- kojící matky
- pediatrické použití
- geriatrické použití
- nežádoucí účinky
- Předávkování
- Refissa Dávkování a způsob Podání
- Jak je Refissa Dodávané
- Ukládání
- HLAVNÍ DISPLEJ – 40 g Trubice Kartonu
- Více o Refissa (tretinoin aktuální)
- Spotřebitelské zdroje
- Odborné zdroje
- související průvodce léčbou
Refissa popis
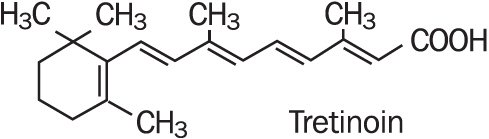
Refissa, obsahuje účinnou látku tretinoin (retinoid) ve zvláčňující krémové bázi. Tretinoin je žlutooranžový krystalický prášek s charakteristickým květinovým zápachem. Tretinoin je rozpustný v dimethylsulfoxidu, mírně rozpustný v polyethylenglykolu 400, oktanolu a 100% ethanolu. Je prakticky nerozpustný ve vodě a minerálním oleji a je nerozpustný v glycerinu. Chemický název pro tretinoin je(all-E)-3,7-dimethyl-9-(2,6,6-trimethyl-1-cyklonexen-1-yl)-2,4,6,8-nonatetraenová kyselina. Tretinoin je také označován jako kyselina all – trans-retinová a má molekulovou hmotnost 300,44. Strukturální vzorec je uveden níže.
Refissa obsahuje tretinoin v koncentraci 0.05% w/w in a water-in-oil emulsion formulation consisting of light mineral oil, sorbitol solution, hydroxyoctacosanyl hydroxystearate; methoxy PEG-22/dodecyl glycol copolymer, PEG-45/dodecyl glycol copolymer, stearoxytrimethylsilane and stearyl alcohol, dimethicone 50 cs, methylparaben, edetate disodium, propylparaben, butylated hydroxytoluene, citric acid monohydrate, and purified water.
Refissa – Klinická Farmakologie
přesný mechanismus účinku tretinoin je neznámé, i když retinoidy jsou věřil vyvíjet vliv na růst a diferenciaci různých buněk epitelu. Při lokální aplikaci však nebylo zaznamenáno zvýšení mRNA desmosinu, hydroxyprolinu nebo elastinu v lidské kůži. Kromě toho úloha dráždivé povahy tohoto přípravku při provádění pozitivních účinků přisuzovaných tomuto přípravku pro jeho indikaci nebyla dosud plně stanovena.
transdermální absorpce tretinoin z různých topické formulace pohybovala od 1% do 31% aplikované dávky, v závislosti na tom, zda to byl aplikován na zdravou kůži nebo dermatitic kůže. Když perkutánní absorpce Tretinoin Krém, USP (Změkčovadlo) 0.05% byla hodnocena u zdravých dobrovolníků mužského pohlaví (n=14) po jediné aplikaci, stejně jako po opakované denní aplikace po dobu 28 dnů, absorpce tretinoin bylo méně než 2% a endogenní koncentrace tretinoin a jeho hlavní metabolity byly v nezměněném stavu.
indikace a použití přípravku Refissa
(Chcete-li plně porozumět indikaci tohoto přípravku, přečtěte si prosím celou část označení a použití na štítku.)
Refissa je indikován jako přídatná látka (viz druhá odrážka níže) pro použití v mitigaci (zmírnění) jemné vrásky, skvrnité hyperpigmentace a drsnost kůže obličeje u pacientů, kteří nedosahují takové zmírnění pomocí komplexní péči o pleť a slunce vyhýbání programy (viz kulka, 3 pro populace, ve které účinnost nebyla stanovena). Refissa neodstraňuje vrásky, opravit sluncem poškozenou pokožku, reverzní PHOTOAGING, nebo obnovit mladší nebo mladší dermální histologický vzor. Mnoho pacientů dosáhnout požadovaného paliativní účinky na jemné zmačkání, skvrnité hyperpigmentace a drsnost pleti s použitím komplexní péči o pleť a slunce vyhýbání programů, včetně ochranu proti slunečnímu záření, ochranné oděvy a zvláčňující krémy obsahující tretinoin.
- Tretinoin Cream, USP (změkčovadlo) 0.05% prokázala žádné POLEHČUJÍCÍ VLIV na významné známky chronické expozice slunci, jako jsou hrubé nebo hlubokých vrásek, kůže žloutnutí, lentigines, teleangiektázie, kůže laxnost, keratinocytic atypie, melanocytární atypie, nebo dermální elastosis.
- Refissa by měl být používán pod lékařským dohledem jako doplněk k komplexní péče o pleť a slunce vyhýbání program, který zahrnuje použití účinné opalovací krém (minimálně SPF 15) a ochranný oděv při požadované výsledky na jemné vrásky, skvrnité hyperpigmentace a drsnost kůže obličeje nebylo dosaženo komplexní péči o pleť a slunce vyhýbání se program sám.
- účinnost Refissa ve zmírnění jemných vrásek, skvrnité hyperpigmentace a drsnost pleti nebyla stanovena u lidí větší než 50 let NEBO u osob s mírně až silně pigmentované pokožky. Kromě toho, u pacientů s viditelnými aktinické keratózy a u pacientů s anamnézou rakoviny kůže byly vyloučeny z klinických studií Tretinoin Krém, USP (Změkčovadlo) výši 0,05%. Účinnost a bezpečnost přípravku Refissa u těchto populací tedy v tuto chvíli není známa.
- Ani bezpečnost ani účinnost Refissa pro prevenci nebo léčbě aktinické keratózy nebo kožní novotvary byla stanovena.
- Ani bezpečnost ani účinnost pomocí Refissa denně po dobu delší než 48 týdnů byla zřízena, a každodenní použití po 48 týdnech nebylo systematicky a histologicky vyšetřeny v přiměřených a dobře kontrolovaných studiích. (Viz část varování.)
ÚDAJE o KLINICKÝCH HODNOCENÍCH
Dvě adekvátní a dobře kontrolované studie byly provedeny zahrnujících celkem 161 hodnocených pacientů (pod 50 let věku) léčených s Tretinoin Krém, USP (Změkčovadlo) 0,05% a 154 hodnotitelných pacientů léčených přípravkem vozidla zvláčňující krém na obličej, po dobu 24 týdnů jako doplněk k komplexní péče o pleť a slunce vyhýbání programu, k posouzení vlivů na jemné zmačkání, skvrnité hyperpigmentace, a taktilní kožní nerovnosti. Patients were evaluated at baseline on a 10-point scale, and changes from that baseline rating were categorized as follows:
| No Improvement: | No change or an increase of 1 unit or more | |
| Minimal Improvement: | Reduction of 1 unit | |
| Moderate Improvement: | Snížení o 2 nebo více jednotek |
V těchto studiích, jemné vrásky, skvrnité hyperpigmentace a drsnost pokožky obličeje byly myšlenka být způsoben více faktory, které zahrnovaly vnitřní stárnutí nebo faktory životního prostředí, , jako je chronická expozice slunci.
výsledky těchto hodnocení jsou následující:
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 36% | 40% | 24% |
| Vehicle + CSP | 62% | 30% | 8% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 35% | 27% | 38% |
| Vehicle + CSP | 53% | 21% | 27% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| * CSP= Comprehensive skin protection and sun avoidance programs included use of sunscreens, protective clothing, and emollient cream. | |||
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 49% | 35% | 16% |
| Vozidlo + CSP | 67% | 23% | 10% |
Většina zlepšení těchto příznaků byla zaznamenána během prvních 24 týdnů léčby. Poté terapie primárně udržovala zlepšení realizované během prvních 24 týdnů.
většina pacientů ztratí nejvíce zmírnit účinky Refissa na jemné vrásky, skvrnité hyperpigmentace a drsnost pleti s přerušení komplexní péči o pleť a slunce vyhýbání program včetně Refissa; nicméně, bezpečnost a účinnost použití Refissa denně po dobu delší než 48 týdnů nebyly stanoveny.
Kontraindikace
Tento lék je kontraindikován u osob s anamnézou hypersenzitivní reakce na některou z jeho složek. Mělo by být přerušeno, pokud je zaznamenána přecitlivělost na kteroukoli z jejích složek.
Varování
- Refissa je dermální dráždivosti, a výsledky pokračující podráždění kůže po dobu delší než 48 týdnů, u chronické dlouhodobé užívání nejsou známy. Existují důkazy o atypické změny v melanocyty a keratinocyty, a zvýšené kožní elastosis u některých pacientů léčených s Tretinoin Krém, USP (Změkčovadlo) 0.05% po dobu delší než 48 týdnů. Význam těchto zjištění není znám.
- bezpečnost a účinnost přípravku Refissa u jedinců se středně nebo silně pigmentovanou kůží nebyla stanovena.
- Refissa by neměl být podáván v případě, že pacient je také užívání drog známo, že je photosensitizers (např. thiazidy, tetracykliny, fluorochinolony, fenothiaziny, sulfonamidy), protože možnosti rozšířené fototoxicity.
z důvodu zvýšené citlivosti na pálení je třeba se během používání přípravku Refissa vyhnout nebo minimalizovat vystavení slunečnímu světlu (včetně slunečních lamp). Pacienti musí být upozorněni, aby při používání přípravku Refissa používali opalovací krémy (minimální SPF 15) a ochranný oděv. Pacientům se spálením sluncem by mělo být doporučeno, aby přípravek Refissa nepoužívali, dokud se úplně nezotaví. Pacientů, kteří mohou mít značné slunci, např. vzhledem k jejich povolání a pacienty s vlastní citlivost na sluneční světlo, by měly věnovat zvláštní opatrnosti při použití Refissa a zajistit, aby opatření uvedené v Pacienta příbalová jsou pozorovány.
Tretinoin Krém, USP (Změkčovadlo) 0.05% by měl být uchováván mimo oči, ústa, úhly nosu a sliznic. Topické použití může v místě aplikace způsobit závažný lokální erytém, pruritus, pálení, píchání a loupání. V případě, že míra lokální podráždění zaručuje, pacientů by měla být zaměřena na použití méně léků, snížení frekvence aplikace, přestaňte používat dočasně, nebo přestat používat úplně.
bylo hlášeno, že Tretinoin způsobuje silné podráždění ekzematózní kůže a měl by být používán pouze s opatrností u pacientů s tímto onemocněním.
aplikace většího množství léků, než je doporučeno, nepovede k rychlejším nebo lepším výsledkům a může dojít k výraznému zarudnutí, loupání nebo nepohodlí.
bezpečnostní Opatření
Obecné
Refissa by měl být používán pouze jako doplněk komplexní péče o pleť a slunce vyhýbání program. (Viz část indikace a použití.
Pokud se objeví citlivost na léčivo, chemické podráždění nebo systémový nežádoucí účinek, je třeba léčbu přípravkem Refissa přerušit.
extrémy Počasí, jako je vítr nebo chlad, může být více dráždí pacientů pomocí Refissa.
informace pro pacienty
viz příbalová informace pro pacienty.
lékové Interakce
Současné lokální léky, léčivé nebo abrazivní mýdla, šampony, čistící prostředky, kosmetika s silný účinek sušení, produkty s vysokou koncentrací alkoholu, astringents, koření nebo vápna, trvalé vlny řešení, elektrolýza, vlasy nebo depilační vosky a přípravky, které mohou dráždit kůži by měl být používán s opatrností u pacientů, kteří byli léčeni Refissa, protože se může zvýšit podráždění s Refissa.
Refissa by neměl být podáván v případě, že pacient je také užívání drog známo, že je photosensitizers (např., thiazidy, tetracykliny, fluorochinolony, fenothiaziny, sulfonamidy) kvůli možnosti rozšířené fototoxicity.
Karcinogeneze, Mutageneze, Poškození Fertility
V životě dermální studii u CD-1 myší na 100 a 200 násobek průměrné doporučené humánní lokální dávka klinická, několik kožních nádorů u samic myší a nádory jater u myších samců byly pozorovány. Biologický význam těchto zjištění není jasná, protože se objevily při dávkách, překročení dermální tolerované dávce (MTD), tretinoin, a protože byli v pozadí přirozené frekvence výskytu těchto nádorů u tohoto kmene myší. Nebyl prokázán kancerogenní potenciál, pokud byl tretinoin podáván lokálně v dávce 5násobné, než je průměrná doporučená topická klinická dávka u člověka. Pro účely srovnání expozice zvířat expozici člověka je „doporučená lokální klinická dávka pro člověka“ definována jako 500 mg přípravku Refissa aplikovaného denně na osobu o hmotnosti 50 kg.
V chronické, dva-rok biotest Vitaminu A, kyseliny u myší provádí Tsubura a Yamamoto, generalizované amyloid depozice byl zaznamenán ve všech skupinách v bazální vrstvě Vitamin A ošetřené kůže. V CD-1 myší, podobné studie uvádí, hyalinization ošetřené kůže lokalit a výskyt tohoto zjištění byl 0/50, 3/50, a 2/50 u myších samců a 1/50, 0/50, 4/50 a 2/50 u myších samic z řízení vozidla, 0,25 mg/kg, 0,5 mg/kg a 1 mg/kg skupin, respektive.
Studie v lysé albinotických myších naznačují, že tretinoin může zvýšit tumorigenní potenciál karcinogenní dávky UVB a UVA světlo ze sluneční simulátor. V jiných studiích, kdy byly lehce pigmentované bezsrsté myši léčené tretinoinem vystaveny karcinogenním dávkám UVB světla, byl výskyt a rychlost vývoje kožních nádorů buď snížen, nebo nebyl pozorován žádný účinek. Vzhledem k výrazně odlišným experimentálním podmínkám není v současné době možné striktní srovnání těchto nesourodých údajů. Ačkoli význam těchto studií u lidí není jasný, pacienti by měli minimalizovat vystavení slunci.
mutagenní potenciál tretinoinu byl hodnocen v amesově testu a v mikronukleárním testu na myších in vivo, oba byly negativní.
dermální Segment I a III studie s Tretinoinovým krémem, USP (změkčovadlo) 0,05% nebyly provedeny u žádného druhu. V ústní Segmentu i a Segmentu III studie u potkanů s tretinoin, snížení přežití novorozenců a zpomalení růstu byly pozorovány při dávkách nad 2 mg/kg/den (>400 násobek průměrné lidské lokální klinické dávky).
Těhotenství
Teratogenní účinky
Těhotenství Kategorie C
ÚSTNÍ tretinoin se ukázaly být teratogenní u potkanů, myší, králíků, křečků, a nelidských primátů. U potkanů byl teratogenní a fetotoxický, pokud byl podáván perorálně nebo lokálně v dávkách 1000krát vyšších, než je průměrná doporučená lokální klinická dávka u člověka. Byly však hlášeny rozdíly v teratogenních dávkách u různých kmenů potkanů. U opic makaka jávského, který, metabolicky, je blíže k lidem, pro tretinoin než ostatní druhy zkoumal, malformací plodu byly zaznamenány při dávkách 10 mg/kg/den nebo větší, ale žádný nebyl pozorován při dávce 5 mg/kg/den (1000 násobek průměrné doporučené humánní lokální dávka klinická), i když zvýšení kostních změn byly pozorovány při všech dávkách. Bylo hlášeno zvýšení embryoletality a potratů v závislosti na dávce. Podobné výsledky byly hlášeny také u pigtail makaků.
lokální tretinoin v testech teratogenity na zvířatech vyvolal nejednoznačné výsledky. Tam je důkaz teratogenity (zkrátit nebo zalomený ocas) lokální tretinoin v Wistar potkanů při dávkách vyšších než 1 mg/kg/den (200 násobek doporučené lidských aktuální klinické dávky). Při dermální aplikaci 10 mg/kg/den byly také hlášeny anomálie (humerus: krátký 13%, ohnutý 6%, os parietální neúplně osifikovaný 14%).
Existují i jiné zprávy, na Novém Zélandu Bílých králíků, kterým byl podáván v dávkách přibližně 80 násobek doporučené lidských aktuální klinické dávce zvýšený výskyt klenutá hlava a hydrocefalu, typické pro retinoid-indukované poškození plodu u tohoto druhu.
naproti tomu několik dobře kontrolovaných studií na zvířatech prokázalo, že dermálně aplikovaný tretinoin nebyl teratogenní v dávkách 100 a 200násobku doporučené lokální klinické dávky u člověka u potkanů a králíků.
S rozšířené používání jakékoliv drogy, malý počet vrozenou vadu hlásí associated časně s podáváním léku by se očekávalo náhodou sám. Třicet případů časově-přidružené vrozené vady byly hlášeny během dvou desetiletí klinické použití jiné formulace lokální tretinoin (Retin-A). I když ne definitivní vzor teratogenity a ne neformální asociace byla založena z těchto případů bylo 5 zpráv popisu vzácnou vrozenou vadou kategorie holoprosencefalie (vady spojené s neúplnou podélné osy rozvoj předního mozku). Význam těchto spontánních hlášení z hlediska rizika pro plod není znám.
Non-teratogenní účinky
Dermální tretinoin byl prokázán fetotoxický u králíků, pokud byl podáván v dávkách 100 násobek doporučené aktuální humánní klinické dávky. Bylo prokázáno, že perorální tretinoin je u potkanů fetotoxický, pokud je podáván v dávkách 500krát vyšších, než je doporučená lokální klinická dávka pro člověka.
neexistují však žádné adekvátní a dobře kontrolované studie u těhotných žen. Přípravek Refissa by neměl být používán během těhotenství.
kojící matky
není známo, zda se tento lék vylučuje do mateřského mléka. Protože se mnoho léků vylučuje do mateřského mléka, je třeba při podávání přípravku Refissa ošetřující ženě postupovat opatrně.
pediatrické použití
bezpečnost a účinnost u pacientů mladších 18 let nebyla stanovena.
geriatrické použití
bezpečnost a účinnost u jedinců starších 50 let nebyla stanovena.
nežádoucí účinky
(Viz body upozornění a opatření.)
V dvojitě zaslepených, vehikulem kontrolovaná studie zahrnující 179 pacientů, kteří aplikovaných Tretinoin Krém, USP (Změkčovadlo) 0.05% na jejich tváře, nežádoucí účinky spojené s užíváním Tretinoin Krém, USP (Změkčovadlo) 0.05% byly omezeny především na kůži. V průběhu těchto studií, 4% pacientů mělo přestat používat Tretinoin Krém, USP (Změkčovadlo) výši 0,05% z důvodu nežádoucích účinků. Tato přerušení byla způsobena podrážděním kůže nebo souvisejícími kožními nežádoucími účinky.
Místní reakce jako olupování, suchá pokožka, pálení, štípání, zarudnutí a svědění byly hlášeny u téměř všech předmětů během terapie s Tretinoin Krém, USP (Změkčovadlo) výši 0,05%. Tyto příznaky a symptomy byly obvykle mírné až střední závažnosti a obvykle se objevily na začátku léčby. U většiny pacientů se suchost, peeling a zarudnutí opakovaly po počátečním (24týdenním) poklesu.
Předávkování
Aplikace většího množství léku než je doporučeno není prokázáno, že vede k rychlejší nebo lepší výsledky, a označené zarudnutí, peeling, nebo nepohodlí může dojít. Perorální požití léku může vést ke stejné nežádoucí účinky jako ty, které jsou spojeny s nadměrným perorální příjem Vitaminu a.
Refissa Dávkování a způsob Podání
- nepoužívejte Refissa, pokud je pacient těhotná nebo se snaží otěhotnět, nebo je při vysoké riziko těhotenství
- nepoužívejte Refissa případě, že pacient je spálená, nebo pokud má pacient ekzém nebo jiné chronické kožní onemocnění(s)
- nepoužívejte Refissa pokud pacient je ze své podstaty citlivé na sluneční světlo
- nepoužívejte Refissa případě, že pacient je také užívání drog známo, že je photosensitizers (např. thiazidy, tetracykliny, fluorochinolony, fenothiaziny, sulfonamidy), protože možnosti rozšířené fototoxicity.
Pacienti vyžadují podrobné instrukce k získání maximální výhody a pochopit všechny pokyny nezbytné, aby tento výrobek používat s největší bezpečnost. Lékař by měl zkontrolovat příbalovou informaci pacienta.
Refissa by měla být aplikována na obličej jednou denně před odchodem do důchodu a měla by být použita pouze tak, aby lehce pokryla celou postiženou oblast. Pacienti by si měli jemně umýt tváře jemným mýdlem, osušit pokožku a počkat 20 až 30 minut před aplikací přípravku Refissa. Pacient by měl aplikovat množství krému o velikosti hrášku, aby lehce pokryl celou tvář. Při aplikaci krému je třeba dbát zvláštní opatrnosti, aby se zabránilo očím, uším, nosním dírkám a ústům.
aplikace přípravku Refissa může způsobit přechodný pocit tepla nebo mírné bodnutí.
v průběhu léčby se může postupně objevit zmírnění (blednutí) jemných vrásek obličeje, skvrnité hyperpigmentace a hmatové drsnosti. Před pozorováním účinků může být vyžadováno až šest měsíců léčby. Většina zlepšení poznamenal s Refissa je vidět během prvních 24 týdnů léčby. Poté terapie primárně udržuje zlepšení realizované během prvních 24 týdnů.
S přerušení Refissa terapie, většina pacientů ztratí nejvíce zmírnit účinky Refissa na jemné vrásky, skvrnité hyperpigmentace a drsnost pokožky obličeje; nicméně, bezpečnost a účinnost použití Refissa denně po dobu delší než 48 týdnů nebyly stanoveny.
aplikace většího množství léků, než je doporučeno, nemusí vést k rychlejším výsledkům nebo lepším výsledkům a může dojít k výraznému zarudnutí, loupání nebo nepohodlí.
pacienti léčení přípravkem Refissa mohou používat kosmetiku, ale oblasti, které mají být léčeny, by měly být před aplikací léku důkladně vyčištěny. (Viz bod opatření.)
Jak je Refissa Dodávané
Refissa je k dispozici v:
20 g trubky NDC 42851-012-20
40 g trubky NDC 42851-012-40
Ukládání
Skladujte při teplotě 20-25°C (68-77°F) . CHRAŇTE PŘED MRAZEM.
pouze Rx.
vytištěno v USA
140904-0118
vyrobeno společností Dpt Laboratories, San Antonio, TX 78215
distribuováno společností zo Skin Health, Inc., Irvine, CA 92618
Refissa®
pro topické použití pouze na obličeji
jaké jsou nejdůležitější informace o přípravku Refissa ?
Refissa je závažný lék. Neodstraňuje vrásky ani neopravuje pokožku poškozenou sluncem. Může pomoci léčit jemné vrásky, skvrnité zabarvení a drsnou pokožku, ale tyto podmínky „nevyléčí“. Refissa by měl být používán pouze pod dohledem svého poskytovatele zdravotní péče, jako součást denního programu péče o pleť. Tento program by měl zahrnovat vyhýbání se přímému slunečnímu záření (použitím ochranného oděvu a opalovacích krémů s minimálním SPF 15) a použití jiných hydratačních krémů na obličej, které neobsahují tretinoin.
přípravek Refissa byste měli používat pouze před spaním. Nepoužívejte sušicí přípravky pro péči o pleť. Použijte nejmenší množství Refissa potřeba, a vyhnout se dostat do očí, uší, nosu nebo úst.upozornění: nepoužívejte přípravek Refissa, pokud jste těhotná nebo se pokoušíte otěhotnět. Vyhněte se slunečnímu záření a dalším lékům, které mohou zvýšit vaši citlivost na sluneční světlo(viz níže).
přípravek Refissa nebyl studován u osob starších 50 let nebo u osob se středně nebo tmavě pigmentovanou kůží.
Co je Refissa?
(Co mohu očekávat od Refissy?)
Refissa je závažný lék, který může pomoci léčit, ale nebude „léčit“ jemné vrásky, skvrnité zbarvení kůže a drsnou pokožku.
Studie ukazují, že po 24 týdnech, asi 30% lidí, kteří používají Tretinoin Krém, USP (Změkčovadlo) 0,05% pro jemné vrásky nebo skvrnité zabarvení měl mírné zlepšení, dalších 35% minimální zlepšení a 35% žádné zlepšení. Asi 16% lidí, kteří používají Tretinoin Krém, USP (Změkčovadlo) 0,05% pro hrubou kůži měl mírné zlepšení, 35% minimální zlepšení, a 49% žádné zlepšení. Neexistuje žádný důkaz, že Refissa zachází s hrubou kůží, hlubokými vráskami, žloutnutím kůže nebo jinými problémy s péčí o pleť.
Refissa by měla být použita jako součást širokého programu péče o pleť. Tento program by měl zahrnovat vyhýbání se přímému slunečnímu záření (použitím ochranného oděvu a opalovacích krémů s minimálním SPF 15) a použití jiných hydratačních krémů na obličej, které neobsahují tretinoin. Mnoho lidí může dosáhnout požadovaných efektů pomocí tohoto programu bez použití Refissa. Přípravek Refissa byste neměli používat, dokud nezkoušíte široký program ošetření pleti bez přípravku Refissa.
při použití přípravku Refissa není zlepšení jemných vrásek, skvrnitého zabarvení kůže a hrubé kůže okamžité a postupně se objevuje. Obecně si můžete všimnout některých účinků za 3 až 4 měsíce. Účinky jsou obvykle nejvíce patrné asi za 6 měsíců s malým dalším zlepšením po této době. Pokud je Refissa zastavena, zlepšení se postupně snižuje.
bezpečnost používání přípravku Refissa denně po dobu delší než 48 týdnů nebyla stanovena.
kdo by neměl používat Refissa?
neměli Byste používat Refissa pokud jste opálené, nebo vysoce citlivé na slunce, pokud máte ekzém, nebo-li vaše pokožka je podrážděná. Refissa může způsobit zvýšené podráždění kůže a zvýšenou náchylnost k spálení.
Od Refissa může vaše pokožka citlivější na sluneční záření, měl byste říct své zdraví starat profesionální, pokud také používáte jiné léky, které zvyšují citlivost na sluneční světlo, protože ty by neměly být pomocí Refissa s těmito léky. Tyto zahrnují, ale nejsou omezeny na: thiazidy (používané k léčbě vysokého krevního tlaku), tetracykliny, fluoroquinolnes nebo sulfonamidy (používané k léčbě infekcí), a fenothiaziny (užívané k léčbě závažné emoční problémy). Pokud užíváte léky na předpis, léky bez lékařského předpisu nebo používáte pleťové krémy, poraďte se se zdravotnickým pracovníkem a ujistěte se, že s přípravkem Refissa neinteragují.
těhotenství upozornění: bezpečné používání během těhotenství nebylo prokázáno. Existují zprávy o vrozených vadách u laboratorních zvířat a lidí, kterým byl podáván tretinoin ústy. Neužívejte přípravek Refissa, pokud jste těhotná nebo se snažíte otěhotnět.
není známo, zda je přípravek Refissa podáván kojencům prostřednictvím mateřského mléka. Bezpečné použití u dětí nebylo prokázáno.
bezpečnost a účinnost přípravku Refissa u osob starších 50 let nebo s tmavším zbarvením kůže nebyla prokázána.
Jak mám přípravek Refissa používat?
měli Byste použít Refissa na obličej jednou denně před spaním použijte jen tolik, aby pokrýt celou postiženou oblast na lehkou váhu. Jemně umyjte obličej jemným mýdlem, osušte pokožku a počkejte 20 až 30 minut před aplikací přípravku Refissa. Naneste množství krému o velikosti hrášku na pokrytí celé tváře. Při prvním použití přípravku Refissa můžete cítit teplo nebo mírné bodnutí.
při aplikaci krému musíte být obzvláště opatrní, abyste se vyhnuli očím, uším, nosním dírkám nebo ústům. Refissa může při aplikaci na tyto oblasti způsobit silné zarudnutí, svědění, pálení, píchání a loupání.
použití většího množství přípravku Refissa nezrychlí výsledky a může způsobit předávkování. Předávkování může mít za následek červené a loupání kůže, stejně jako některé bolesti nebo nepohodlí.
po aplikaci přípravku Refissa můžete použít kosmetiku. Před opětovným nanesením přípravku Refissa důkladně očistěte obličej.
čemu se mám při používání přípravku Refissa vyhnout?
Refissa zvyšuje citlivost na sluneční světlo. Vyhněte se slunečnímu záření co nejvíce. Používejte ochranný oděv a opalovací krém s minimálním SPF 15. Neopalujte se ani nepoužívejte sluneční lampy. Pokud jste citliví na sluneční světlo nebo máte práci, která vyžaduje, abyste byli na slunci po dlouhou dobu, musíte být velmi opatrní.
během používání přípravku Refissa se vyhněte přípravkům, které mohou pokožku vysušit nebo dráždit. Vyhněte se například výrobkům aplikovaným na kůži, které obsahují alkohol, koření nebo vápno. Vyhněte se také čisticím prostředkům, odstraňování chloupků nebo jiným produktům, které mohou dráždit pokožku.
jaké jsou možné nežádoucí účinky přípravku Refissa?
nejčastějšími nežádoucími účinky jsou kožní reakce. Bylo hlášeno svědění, zarudnutí a suchá kůže. Takže máte pálení, bodání a loupání kůže. Ty jsou nejčastěji mírné a jsou nejčastější při zahájení léčby.
Jak mohu získat další informace?
tato příbalová informace shrnuje nejdůležitější informace o přípravku Refissa. Pokud chcete získat více informací, poraďte se se svým lékařem nebo jiným poskytovatelem zdravotní péče. K dispozici je také leták napsaný pro zdravotnické pracovníky, který vám může poskytnout váš lékárník.
vyhledejte lékařskou pomoc ohledně nežádoucích účinků. MŮŽETE HLÁSIT NEŽÁDOUCÍ ÚČINKY FDA NA 1-800-FDA-1088.
HLAVNÍ DISPLEJ – 40 g Trubice Kartonu
NDC 42851-012-40
117471-0118
Refissa ®
Tretinoin Krém,
USP (Změkčovadlo) 0.05%
Rx Only
NET WT 40 g
FDA APPROVED

| Refissa TRETINOIN (EMOLLIENT) tretinoin cream |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
Labeler – ZO Skin Health, Inc. (826468527)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| DPT Laboratories, Ltd. | 832224526 | manufacture(42851-012) | |
Více o Refissa (tretinoin aktuální)
- Nežádoucí Účinky
- Během Těhotenství nebo Kojení
- Dávkování Informací
- lékové Interakce
- Ceny & Kupóny
- En Español
- třída Lék: aktuální akné činidla
Spotřebitelské zdroje
- Informace pro Pacienta
- Refissa Lokální (Pokročilé Čtení)
Odborné zdroje
- Předepisování Informace
- Tretinoin Gel Microsphere (FDA)
Jiných značek Retin-A, Renova, Atralin, Altreno, … + 2 další
související průvodce léčbou
- Fotoaging kůže
lékařské vyloučení odpovědnosti