VoLumen
Generic Name: síran barnatý
Léková Forma: perorální suspenze
Lékařsky přezkoumány Drugs.com. Naposledy aktualizovány dne Říjen 1, 2020.
- Přehled
- Nežádoucí Účinky
- Dávkování
- Odborné
- Těhotenství
- Další
Upozornění: Tento lék nebyl nalezen FDA jako bezpečné a účinné, a toto označení není schválen FDA. Další informace o neschválených lécích, klikněte zde.
- VoLumen popis
- Klinická farmakologie
- indikace a použití
- Kontraindikace
- upozornění
- bezpečnostní Opatření
- Obecné
- Informace pro Pacienty
- lékové Interakce
- použití v těhotenství
- kojící matky
- NEŽÁDOUCÍ ÚČINKY
- ALERGICKÉ REAKCE
- předávkování
- DÁVKOVÁNÍ A způsob PODÁNÍ
- pro perorální podání: označení GI traktu
- skladování
- jak se VoLumen dodává
- More about Volumen (barium sulfate)
- Spotřebitelské zdroje
- Odborné zdroje
- související léčebné příručky
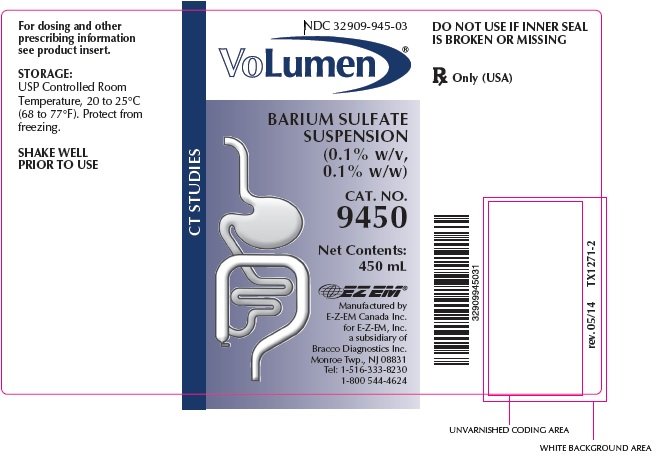
VoLumen popis
VoLumen® je suspenze síranu barnatého 0,1% hmotnostních, 0,1% hmotnostních pro orální podání. Každých 100 mL obsahuje 0,1 g síranu barnatého. Síran barnatý je díky své vysoké molekulové hustotě neprůhledný vůči rentgenovým paprskům, a proto působí jako pozitivní kontrastní látka pro radiografické studie. Aktivní složkou je síran barnatý a jeho strukturní vzorec je BaSO4. Barium sulfát se vyskytuje jako jemný, bílý, bez zápachu, bez chuti, objemný prášek, který je netvořící hrudky. Jeho vodné suspenze jsou neutrální vůči lakmusu. Je prakticky nerozpustný ve vodě, roztocích kyselin a zásad a organických rozpouštědlech.
Neaktivní Složky: kyselina citronová, přírodní guma, kyselina benzoová, dihydrát citronanu sodného, přírodní a umělé borůvkové aroma, sorban draselný, čištěná voda, sodná sůl sacharinu, simetikon emulze, benzoát sodný a sorbitol.
Klinická farmakologie
síran barnatý je díky své vysoké molekulové hustotě neprůhledný vůči rentgenovým paprskům, a proto působí jako pozitivní kontrastní látka pro radiografické studie. Síran barnatý je biologicky inertní, a proto není absorbován nebo metabolizován tělem a je vylučován z GI traktu beze změny.
indikace a použití
pro použití v počítačové tomografii k opacifikaci GI traktu.
Kontraindikace
Tento produkt by neměl být používán u pacientů se známou nebo suspektní gastrointestinální perforace nebo přecitlivělost na barium sulfát nebo na kteroukoli složku tohoto síran barnatý formulace.
upozornění
vzácně byly po podání kontrastních látek síranu barnatého hlášeny závažné alergické reakce anafylaktoidní povahy. Pro nouzovou léčbu závažných reakcí by měl být k dispozici náležitě vyškolený personál a zařízení a měl by zůstat k dispozici po dobu nejméně 30 až 60 minut po podání, protože se mohou objevit opožděné reakce.
bezpečnostní Opatření
Obecné
Diagnostické postupy, které zahrnují použití rtg kontrastní kontrastní látky by měly být prováděny pod vedením pracovníků s potřebnou odbornou přípravu a důkladné znalosti v konkrétní postup, které mají být provedeny. Historie bronchiálního astmatu, atopie, o čemž svědčí senná rýma a ekzém, nebo předchozí reakce na kontrastní látku, vyžadují zvláštní pozornost. U těžce oslabených pacientů a u pacientů s výraznou hypertenzí nebo pokročilým srdečním onemocněním je třeba postupovat opatrně. Požití barya se nedoporučuje u pacientů s anamnézou aspirace potravin. Pokud jsou vyžadovány studie barya u těchto pacientů nebo u pacientů, u nichž není známa integrita polykacího mechanismu, postupujte opatrně. Pokud je baryum nasáváno do hrtanu, mělo by být další podávání okamžitě přerušeno.
Informace pro Pacienty
Před podáním tohoto přípravku, u pacientů užívajících síran barnatý diagnostické přípravky, měla by být poučeni, aby:
- Informujte svého lékaře, pokud jsou těhotné.
- informujte svého lékaře, pokud jsou alergičtí na jakékoli léky nebo potraviny nebo pokud měli nějaké předchozí reakce na přípravky síranu barnatého nebo jiné kontrastní látky používané při rentgenových procedurách (viz opatření-obecné).
- informujte svého lékaře o všech dalších lécích, které v současné době užívají.
- okamžitě vyhledejte lékařskou pomoc, pokud se u nich po použití tohoto přípravku objeví alergická reakce.
lékové Interakce
přítomnost síranu barnatého formulace v GI traktu může ovlivnit vstřebávání léčivé látky užívány společně. Aby se minimalizovala jakákoli potenciální změna absorpce, mělo by se zvážit samostatné podání síranu barnatého od podání jiných látek.
použití v těhotenství
je známo, že záření způsobuje poškození nenarozeného plodu vystaveného in utero. Radiografické postupy by se proto měly používat pouze tehdy, pokud je podle úsudku lékaře jeho použití považováno za nezbytné pro blaho těhotné pacientky.
kojící matky
produkty síranu barnatého mohou být použity během laktace.
NEŽÁDOUCÍ ÚČINKY
Nežádoucí účinky, jako je nevolnost, zvracení, průjem a břišní křeče, doprovázející použití síranu barnatého formulace jsou časté a obvykle mírné. Vyskytly se závažné reakce (přibližně 1 z 1 000 000) a úmrtí (přibližně 1 z 10 000 000). Procedurální komplikace jsou vzácné, ale mohou zahrnovat aspirační pneumonitidu, tvorbu granulomu, intravazaci, embolizaci a peritonitidu po perforaci střeva, vazovagální a synkopální epizody a úmrtí.
ALERGICKÉ REAKCE
Vzhledem ke zvýšenému nebezpečí alergických reakcí u atopických pacientů, je důležité, aby kompletní historie známý a podezření na alergii, stejně jako alergické příznaky jako např. rýma, bronchiální astma, ekzém a kopřivka, být získáno před zahájením jakékoli lékařské procedury s využitím těchto produktů. Mírná alergická reakce by s největší pravděpodobností zahrnovala generalizovaný pruritus, erytém nebo kopřivku (přibližně 1 z 250 000). Takové reakce obecně reagují na antihistaminikum, jako je 50 mg difenhydraminu nebo jeho ekvivalentu. U vzácnějších se mohou vyvinout závažnější reakce (přibližně 1 z 1 000 000) laryngeální edém, bronchospazmus nebo hypotenze. Závažné reakce, které mohou vyžadovat mimořádná opatření jsou často charakterizován periferní vazodilatace, hypotenze, reflexní tachykardie, dušnost, neklid, zmatenost a cyanóza, postupuje do bezvědomí. Léčba by měla být zahájena okamžitě subkutánně 0, 3 až 0, 5 ccm epinefrinu 1:1000. Pokud převládá bronchospazmus, měl by být podáván pomalu 0, 25 až 0, 50 gramů intravenózního aminofylinu. Mohou být vyžadovány vhodné vazopresory. Adrenokortikosteroidy, i když jsou podávány intravenózně, nevykazují žádný významný účinek na akutní alergické reakce po dobu několika hodin. Podávání těchto látek by nemělo být považováno za nouzová opatření pro léčbu alergických reakcí. U pacientů s obavami se může po podání jakéhokoli diagnostického činidla vyvinout slabost, bledost, tinnitus, diaforéza a bradykardie. Takové reakce jsou obvykle nealergické povahy a nejlépe se léčí tím, že pacient leží na pozorování dalších 10 až 30 minut.
předávkování
ve vzácných případech po opakovaném podání se mohou objevit těžké žaludeční křeče, nauzea, zvracení, průjem nebo zácpa. Tyto indikované odpovědi mohou být přítomny v fluoroskopických i CT postupech. Jsou přechodné povahy a nejsou považovány za závažné. Symptomy mohou být léčeny podle aktuálně uznávaných standardů lékařské péče.
DÁVKOVÁNÍ A způsob PODÁNÍ
objem CT síran barnatý suspenze se podává, bude záviset na stupni a rozsahu kontrastu nutné v oblasti(y) na základě vyšetření a na techniku.
pro perorální podání: označení GI traktu
pacient by měl začít pít VoLumen® přibližně 20 – 30 minut před plánovaným zákrokem. Doporučuje se, aby pacient spotřeboval více lahví, přibližně 900 mL až 1350 ml celkový objem před vyšetřením nebo použitím podle pokynů lékaře. Pro lepší žaludeční značení mají pacient konzumovat konečné 200 mL bezprostředně před skenováním. Značení střev je konzistentní díky jednotnosti 0,1% koncentrace BaSO4. Značení lumen střeva lze zlepšit zvýšením objemu spotřebovaného VoLumen® (viz níže). Podle potřeby lze dodržovat další dávkovací režimy. U pacientů, kde je označení problematické, jako je obezita a zpoždění tranzitu, lepší označení může být možné tím, že zvyšuje celkový objem VoLumen® podáván až 1800 mL nebo čtyř (4) láhve.
skladování
USP řízená pokojová teplota 20 až 25°C (68 až 77°F). Chraňte před mrazem.
jak se VoLumen dodává
VoLumen® se dodává v následujícím množství: 450 mL lahvičky,
Kat. No. 9450, NDC 32909-945-03
pouze Rx (USA)
před použitím dobře protřepejte
patentovaný
vyrobeno společností
E-Z-EM Canada Inc.
Pro E-Z-EM, A.S.
dceřiná společnost Bracco Diagnostics Inc.
Monroe Township, NJ 08831
Tel: 1-516-333-8230 1-800 544-4624
rev. 05/14 TX1272-3 ©2006 E-Z-EM, Inc.
suspenze VoLumen – síranu barnatého
NDC: 32909-945-03
| VoLumen barium sulfate suspension |
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
Labeler – E-Z-EM Canada Inc (204211163)
Registrant – E-Z-EM, INC. (002041226)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| E-Z-EM Canada Inc | 204211163 | PACK(32909-945), ANALYSIS(32909-945), LABEL(32909-945), MANUFACTURE(32909-945) | |
More about Volumen (barium sulfate)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Pricing & Kupóny
- En Español
- 1 Recenze
- Lék třída: non-jodovaných kontrastních látek
Spotřebitelské zdroje
- Pokročilé Čtení
Odborné zdroje
- Předepisování Informace
Jiných značek NeuLumEX, Kapalina E-Z Paque, HD 200 Plus, Entrobar, … + 30 více
související léčebné příručky
- počítačová tomografie
lékařské vyloučení odpovědnosti