7.18: Vinylhalogenider og Arylhalogenider
nukleofil substitution i arylhalogeniderne
vi vil se nærmere på strukturen af chlorbensen. Brombensen og iodobensen er de samme. Den enkleste måde at tegne strukturen af chlorobensen på er:
for at forstå chlorobensen korrekt, skal du har brug for at grave lidt dybere end dette. Der er en interaktion mellem de delokaliserede elektroner i ringen og et af de ensomme par på kloratomet. Dette overlapper med det delokaliserede ringelektronsystem . . .
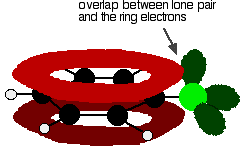
til at give en struktur snarere som denne:
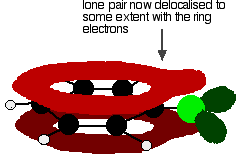
klorbinding og molekylets polaritet. Delokaliseringen introducerer en vis ekstra binding mellem kulstof og klor, hvilket gør bindingen stærkere. Dette har en væsentlig virkning på reaktionerne af forbindelser som f.eks.
der er også en vis bevægelse af elektroner væk fra kloren mod ringen. Klor er ret elektronegativt og trækker normalt elektroner i kulstofchlorbindelsen mod sig selv. I dette tilfælde modregnes dette til en vis grad af bevægelsen af elektroner tilbage mod ringen i delokaliseringen. Molekylet er mindre polært, end du ellers ville have forventet.
Simple arylhalogenider som chlorbensen er meget resistente over for nukleofil substitution. Det er muligt at erstatte klor med-OH, men kun under meget svære industrielle forhold – for eksempel ved 200 liter C og 200 atmosfærer. I laboratoriet sker disse reaktioner ikke. Der er to grunde til dette – afhængigt af hvilken af de ovennævnte mekanismer du taler om.
- den ekstra styrke af carbon-halogenbindingen i arylhalogenider: carbon-chlorbindingen i chlorobensen er stærkere end man kunne forvente. Der er en interaktion mellem et af de ensomme par på kloratomet og de delokaliserede ringelektroner, og dette styrker bindingen. Begge ovennævnte mekanismer involverer at bryde carbon-halogenbindingen på et eller andet tidspunkt. Jo vanskeligere det er at bryde, jo langsommere vil reaktionen være.
- afstødning af ringelektronerne: dette gælder kun, hvis hydroksidionen angreb chlorobensen ved hjælp af en mekanisme som den første beskrevet ovenfor. I denne mekanisme angriber hydroksidionen det lidt positive kulstof, som halogenatomet er bundet til.Hvis halogenatomet er fastgjort til en ring, vil den indkommende hydroksidion blive konfronteret med de delokaliserede ringelektroner over og under det carbonatom. Den negative hydroksidion vil simpelthen blive afstødt. Den særlige mekanisme er simpelthen en ikke-starter!