det universelle opløsningsmiddel
det universelle opløsningsmiddel
Dette er naturligvis en anden vigtig egenskab ved vand, fordi flere stoffer opløses i vand end nogen anden almindelig væske. Dette skyldes, at det polære vandmolekyle forbedrer “opløsningskraft.”Opløsning indebærer at bryde” salte “i komponent” ioner.”For eksempel bryder NaCl (almindeligt salt) ned i ionerne Na+ og Cl – på grund af tiltrækningen for ioner (atomer eller grupper af atomer med en ladning) til vandmolekyler er høj.
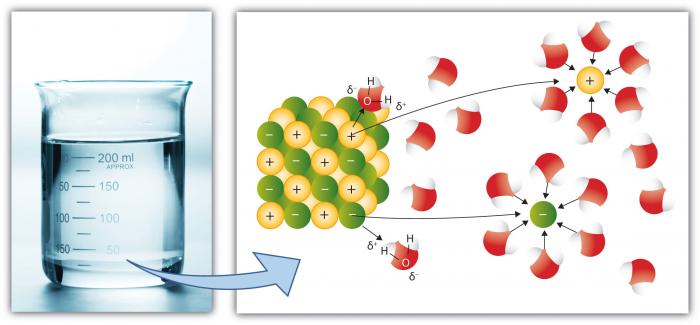
figur 4. Tegning af Salt (NaCl), der bryder ned i ionerne Na+ og Cl-
kilde: kationer, såsom Na (natrium), har en nettopositiv ladning, mens anioner (såsom Cl, chlorid) har en nettopositiv ladning. Der er mange individuelle elementer og forbindelser, der danner ioner. Vand kan således indeholde betydelige koncentrationer af forskellige kemiske arter afhængigt af deres særlige egenskaber. Bemærk, hvordan vandmolekylerne omgiver de enkelte ioner og holder dem isoleret fra andre ioner i opløsning. Dette sker, indtil vandets kapacitet til at isolere ionerne overskrides, på hvilket tidspunkt opløsningen er “mættet” med disse ioner og ikke kan opløses mere (salt begynder at udfælde—danne et fast stof).