grænser inden for kardiovaskulær medicin
introduktion
Ved undersøgelse af koordinatsystemer, der kan anvendes til forskellige biologiske enheder, bør specifikke egenskaber overvejes. For eksempel danner kromosomnummer og baseparposition et lineært koordinatsystem, der er tilstrækkeligt til at definere placering i referencegenomet (1). Imidlertid er et koordinatsystem for hele menneskekroppen, der kan imødekomme behovene hos HuBMAP, HCA, HPA og andre kortlægningsindsatser, langt mere komplekst af flere grunde (2-5). For det første lever celler i tre dimensioner; og yderligere oplysninger er nødvendige for at beskrive størrelsen og rotationsorienteringen af enhver vævsprøve, der bruges til at generere dataene. For det andet, mens genombaseparposition ikke afhænger af, hvordan DNA foldes og pakkes ind i kernen, positionerne for individuelle elementer (f. eks., celler, organer) i kroppen er dynamiske, da de kan ændre sig med skelet-og muskelbevægelser, tyngdekraft, vejrtrækning, hjerteslag og andre funktioner og kræfter, der fordrejer væv. For det tredje, selvom variabiliteten af DNA mellem mennesker er <1%, spænder menneskets kropsgeometri over en bred vifte af højder, vægte og former, som varierer efter køn og race og ændrer sig markant over en persons levetid.
en mulighed er at bruge et 3D-kartesisk koordinatsystem til at beskrive position i kroppen. Kartesiske koordinatsystemer har fordelen ved at være velkendte og let forståelige. Med kroppen i standard anatomisk position, venstre-højre, kaudal-kranial og posterior-anterior form tre vinkelrette akser. Til mindre skalaanalyser kan centrering af oprindelsen på et anatomisk vartegn være mest nyttigt og potentielt mindre variabelt mellem forskellige mennesker. For eksempel ville det være lettere at måle afstanden af en vævsprøve fra nyren til nyrens overlegne pol end til toppen af en persons hoved. Ulempen ved kartesiske koordinater er, at dens akser ikke følger kroppens naturlige form. Som et resultat ville oprettelse af et referencekropskort ved digitalt at “sy” sammen vævsprøver indsamlet fra mennesker i forskellige størrelser kræve en kompleks proces med vridning, rotation og tilpasning af dataene. At gøre dette på en måde, der skaleres til hele kroppen, mens du opretholder præcision på celleniveau, ville være ekstremt udfordrende.
andre 3D-koordinatsystemer er udviklet til forskellige applikationer. For eksempel beskriver sfæriske koordinater med akser, der repræsenterer breddegrad, længdegrad og højde, bekvemt placering på jordens overflade. En simpel sti i sfæriske koordinater, såsom “1 km øst”, er meget vanskeligere at kommunikere ved hjælp af kartesiske koordinater. Tilsvarende bør koordinatsystemer til den menneskelige krop ideelt set have akser, der følger anatomiske strukturer, genetiske ekspressionsmønstre, kemiske gradienter og/eller andre biologisk relevante veje. Flere organspecifikke koordinatsystemer er blevet udviklet, såsom Talairach-koordinater til funktionel hjerneafbildning, men disse strækker sig ikke til hele kroppen (6).
vaskulært baseret koordinatsystem
i 2017 blev der arrangeret et fælles Koordinatramme (CCF) møde af National Institutes of Health, Broad Institute, Sanger Institute og CHAN Guckerberg-initiativet. Mødedeltagere, som omfattede anatomister, patologer, klinikere og teknologieksperter fra hele verden, foreslog flere tilgange til kortlægning af cellerne i den menneskelige krop, herunder anatomisk baserede koordinatsystemer (7). En af disse, der bruger vaskulaturen, blev yderligere diskuteret på et CCF-værksted i 2019, specifikt til lokalisering af nyreceller (8). I dette manuskript præsenterer vi en konceptuel oversigt over dette vaskulære baserede koordinatsystem og beskriver dets fordele og begrænsninger (Figur 1).
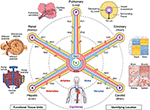
Figur 1. Hub-and-spoke-strukturen i et vaskulært koordinatsystem. Det vaskulære koordinatsystem består af repræsentative karsløjfer, der begynder og slutter i hjertets kamre og strækker sig til de funktionelle enheder i hvert organ (mod uret fra øverste venstre: alveoler, glomeruli og hepatiske lobuler). “Adressen “på en celle inkluderer navnet på sløjfen (f.eks.” R “for nyre og” H “for lever) og forgreningsniveauet for det nærmeste kar (f. eks.” RA1 ” for afferente arterioler i nyresløjfen). Bemærk, at hjertets vægge ligger langs koronar (“C”) vaskulær sløjfe, og cellerne i nogle strukturer, der er indre for hjertet, er faktisk placeret på periferien af koordinatsystemet, nær kapillærerne, der giver dem Blod. Der er flere måder at lokalisere en endnu mere præcis “GPS-lignende” position, herunder at gå med uret fra øverst til højre, “hypoksi fingeraftryk”, der skyldes faldende iltniveauer længere væk fra karret, det unikke “histologiske fingeraftryk” og “genekspression fingeraftryk” i forskellige typer vaskulære endotelceller og det karakteristiske “vaskulære arkitektur fingeraftryk”, der findes i forskellige typer væv. Vaskulaturen strækker sig til alle dele af kroppen (bunden) og rammer alle organer på alle skalaer. kildefil: Billeder af hepatiske lobuler, glomeruli, alveoler, genekspressionsvarmekort og helkropsvaskulatur er tilpasset fra Commons: https://commons.wikimedia.org/wiki/File:2423_Microscopic_Anatomy_of_Liver.jpg (Public Domain); https://commons.wikimedia.org/wiki/File:Juxtaglomerular_Apparatus_and_Glomerulus.jpg (CC BY 3.0 license); https://commons.wikimedia.org/wiki/File:Alveolus_diagram.svg (Public Domain); https://commons.wikimedia.org/wiki/File:Iris_dendrogram.png (CC BY-SA 4.0-licens); og https://commons.wikimedia.org/wiki/File:Circulatory_System_en.svg (offentligt domæne). Genekspression varme kort genskabt fra Guo et al. (9) brug af simulerede data. Vaskulær arkitektur baseret på Bosetti et al. (10) (CC BY 4.0 licens).
målet med et vaskulært koordinatsystem er ikke at opbygge et kort over vaskulaturen. Ideen er snarere at bruge kendte vaskulære veje gennem kroppen som en akse i et koordinatsystem, der kan beskrive placeringen af anatomiske elementer, såsom celler, i vævet omkring vaskulaturen. I denne foreslåede ramme kan hjertekamrene ses som oprindelsen på hele kropskortet. Den vaskulære akse indeholder vaskulære sløjfer (sammenlignelig med “veje” i Google Map-metaforen), der strækker sig ud gennem aorta eller lungearterien, gradvist tilspidses til enkeltcellestørrelse, når de nærmer sig hver anden celle i hvert organ i kroppen og vender tilbage til hjertet. Langs disse veje følger vaskulaturen den unikke biologi af de forskellige organer og væv; og ligeledes kunne kroppens organer og væv ikke eksistere uden de unikke egenskaber ved deres tæt integrerede vaskulatur.
ligesom genomkortet udfolder DNA ‘ et i en lineær sekvens, kan vi forestille os at udfolde de komplekse 3D-vendinger af vaskulaturaksen til en enklere 2D “hub-and-spoke” – form med hjertets kamre i midten. Denne skematiske repræsentation af vaskulaturen gør det lettere at (1) beskrive placering i kroppen; (2) justere vaskulære veje med forskellige 3D-former, men ækvivalent funktion fra forskellige mennesker; (3) identificere mønstre såsom ændringer i celletype og genekspression som en overgang fra større til mindre kar i et organ (langs en eger); og (4) sammenlign væv på samme niveau (f.eks. kapillærer) i forskellige organer (på tværs af eger).
et organ, såsom nyrerne, har titusinder af vaskulaturveje, hvis hver kapillær betragtes tydeligt. Imidlertid, for at gøre konstruktionen af en CCF mulig, vi vil gøre en yderligere forenkling antagelse om, at mange af disse veje ikke kan skelnes fra hinanden. Især er de mindste kar (kapillærer) i centrum for de små specialiserede funktionelle enheder i hvert organ (f. eks., hepatiske lobuler i leveren, glomeruli i nyrerne og alveoler i lungen). Et helt organ kræver mange af disse vaskulære centrerede funktionelle enheder, der er anatomisk og fysiologisk ens (11). Denne lighed kan bruges til at kollapse adskillige vaskulære veje i nogle få repræsentative (figur 2). I fremtiden, når vi lærer mere om de biomolekylære profiler af disse veje, vi kan forfine CCF ved at opdele stierne i alle undertyper, der opdages.

figur 2. Udfoldning af den renale vaskulære vej ned til enkeltcelleniveauet. En repræsentativ vaskulær vej kommer ind i nyren gennem nyrearterien, passerer gennem glomerulus og returnerer nyrevenen. Ved makroskalaen (venstre) og mesoskalaen (midten) er etiketter i gule kasser anatomiske strukturer, der svarer til forskellige kar langs denne løkke. Ved mikroskalaen (til højre) er etiketter i gule kasser forskellige typer celler, der ligger inden for kort afstand fra et nærliggende kar i glomerulus. Placeringen af de enkelte celler kan beskrives ved det nærmeste fartøjs adresse (f. eks., “RA0 “for glomerulus kapillær), afstanden i mikrometer eller antal celler fra karets endotel og en vinkel vinkelret på karrets længde (f.eks.” RA0-10 liter-135 liter “eller”RA0-1C-135 liter”). Yderst til højre er hvert kar og dets omgivende væv ekstraheret fra det originale billede og justeret lodret for at gøre det let at se, hvordan celletyper og fordeling ændres langs den vaskulære vej. I dette eksempel er de justerede billeder også blevet roteret, så centrum af glomerulus altid er til højre. kildefil: https://commons.wikimedia.org/wiki/File:KidneyStructures_PioM.svg(CC BY 3.0 licens); og https://commons.wikimedia.org/wiki/File:Renal_corpuscle-en.svg (CC BY-SA 4.0 licens).
en “adresse” af en individuel celle i et vaskulært koordinatsystem har fire komponenter. (1) Den første er det nærmeste anatomisk navngivne kar, der mest præcist identificerer en vaskulær løkke (det vaskulære område eller “vandskel”), såsom den højre nyrearterie. (2) Den næste komponent repræsenterer fartøjets forgreningsniveau. I nyrerne inkluderer eksempler fra proksimal til distal interlobar arterier, kortikale udstråle arterier, afferente arterioler og glomerulære kapillærer. Forgreningsniveauet kan også defineres numerisk med kapillærer på nulniveauet og højere niveauer med større antal. (3) den tredje komponent er den vinkelrette afstand i mikrometer eller antal celler fra endotellaget af karret. (4) en valgfri fjerde komponent kan være rotationsvinklen vinkelret på fartøjets længde. Nul grader kan defineres på mange måder afhængigt af applikationen. For eksempel kan det være i forhold til en markør på vævsprøven, eller det kan pege mod en anatomisk struktur, såsom midten af den nærmeste glomerulus i nyren. Nytten og behovet for disse komponenter skal bekræftes ved eksperimentel test.
en anden tilgang er at bruge endotelceller som “forankringsceller” til at identificere de relative positioner for de andre celler på en GPS-lignende måde. Endotel linjer hele vaskulaturen. Forskellige endotelceller (EC) – typer vises i forskellige dele af vaskulaturen, som kan detekteres histologisk gennem unikke cellekarakteristika og naboceller (“histologisk fingeraftryk”) såvel som gennem analyse af deres specifikke genprofiler (“genekspression fingeraftryk”, Figur 1 varmekort) (9, 12, 13). Vaskulær organisatorisk mønster, forgreningskompleksitet, diameter osv. give yderligere genkendelige funktioner, der danner en” vaskulær arkitektur fingeraftryk ” for hvert væv (Figur 1 falsk-farve fluorescerende vaskulatur billeder) (10, 14). Hvert væv har specifikke iltgradienter, som kan bruges til at bestemme afstanden fra karret. Når PO2 ikke kan måles direkte, kan man udlede celleafstanden fra induktions-/ekspressionsgradienterne af hypoksi-inducerbare gener i forskellige typer celler (“hypoksi-fingeraftrykket”, Figur 1 tværgående billede af et kar) (15-17).
fordele ved en vaskulær CCF
et vaskulaturkoordinatsystem giver mening biologisk. Hver levende celle skal være inden for en lille radius af det nærmeste blodkar (100 liter til 1 mm, afhængigt af vævet) for at modtage ilt (18); og hvert fartøj er foret med det samme kontinuerlige lag af endotel (19). Således danner vaskulaturen en ubrudt vej, der når alle dele af kroppen, sømløst aftagende ned over skalaer, fra makroskala (hele kroppen/klinisk) til mesoskala til mikroskala (enkeltcellestørrelse kapillære kar). Som en del af dette håndterer den den gradvise overgang fra store arterier og vener, som er bevaret hos de fleste mennesker, ned til de millioner af mikroskopiske kar, der kan genkendes efter kategori (f.eks. Det vaskulære system tilpasser sig individuel kropsstørrelse og form og tegner sig for interindividuelle variationer (20, 21). Det definerer formen på funktionelle enheder i forskellige organer, såsom leverlobuler, nyreglomeruli og lungealveoler. Normal udvikling af nyt væv begynder med dannelse af kar, før yderligere celletyper kan vokse omkring det (22).
det vaskulære system når også alle organer, væv og celler på en sammenhængende måde. Andre anatomiske strukturer synes ikke at have lignende alsidighed. For eksempel strækker skeletsystemet sig til hele kroppen; imidlertid kan afstanden fra en celle i et organ til den nærmeste knogle være flere centimeter, og det er usandsynligt, at knoglen er en del af organet og endnu mindre sandsynligt, at den er en del af et vævsprøve. Nervesystemet følger mange af de samme veje som større kar investeret med kontraktile egenskaber, men det vides ikke, om de strækker sig til at følge de mindre kar, der når alle vævsceller. I modsætning til cellernes afhængighed af ilt er der således ikke en garanti for, at hver celle er tæt på en nerve. Organspecifikke referencesystemer er baseret på unikke strukturelle egenskaber, der kun findes i det enkelte organ (f.eks. specifikke regioner i hjernen) og er sandsynligvis ikke nyttige til at repræsentere celleplaceringer andre steder i kroppen.
der er mange praktiske fordele ved et vaskulært koordinatsystem. Vaskulære veje i alle organer er blevet undersøgt grundigt og er beskrevet i litteraturen i detaljer. De er nyttige, velkendte og har standardiserede navne på tværs af mange specialdomæner. Vævsvaskulariseringsmønstre bruges klinisk til at diagnosticere sygdom; og skibe anvendes i kirurgi og biopsier som de vigtigste anatomiske landemærker og til at definere “vaskulære territorier” (23, 24). Selvom den nøjagtige position i 3D-kartesisk rum kan være vanskelig at bestemme for en resekteret vævsprøve, vil kirurgen typisk være i stand til at indikere, hvilket vaskulært vandskel der inkluderede prøven.
begrænsninger af en vaskulær CCF
kun at kende baseparene i en genomsekvens giver ikke tilstrækkelig information til at bestemme, hvordan DNA ‘ et foldes i en bestemt celle. Tilsvarende, selvom det udfoldede vaskulære koordinatsystem kan beskrive det 3D-rumlige forhold mellem nærliggende celler ved mikroskalaen, går de snoede stier, som kar tager, og den relative afstand mellem celler i større skalaer tabt. Oplysninger om strukturer i større skala kunne opnås ved at integrere klinisk billeddannelse og histologisk og molekylært mønster.
nogle yderligere positionsoplysninger går tabt ved at kollapse vaskulære veje. For eksempel kan et vaskulært koordinatsystem oprindeligt behandle alle glomeruluskapillærer i nyren som den samme struktur, hvilket potentielt maskerer forskelle i glomeruli ved de overlegne og ringere nyrepoler. Selvom vi lærer mere om de biomolekylære profiler af disse veje, kan vi iterativt forfine den vaskulære CCF over tid ved at opdele veje i alle undertyper, der opdages.
På trods af disse begrænsninger bevarer et vaskulært koordinatsystem tilstrækkelig positionsinformation til at besvare mange typer forskningsspørgsmål ved at give forskere mulighed for nøjagtigt at lokalisere individuelle celler inden for funktionelle enheder, væv og organer eller sammenligne virkningerne af kontekst på forskellige celletyper på tværs af hele kroppen ved makro – og meso – skalaer.
næste trin og fremtidige retninger
i Figur 1 præsenterer vi en meget forenklet og stiliseret repræsentation af den vaskulære CCF for at introducere det generelle koncept. De faktiske vaskulære veje er langt mere komplekse, med den fulde vaskulære CCF til sidst bestående af hundreder eller tusinder af strukturer såvel som forgreningsmønstre, der ikke følger et strengt hub-and-spoke layout. For eksempel vil venerne i leverportalsystemet, som fører blod fra flere organer til leveren, og cirkulationsanastomoser, såsom cirkel af vilje i hjernen, løbe vinkelret på og krydse over “egerne” i Figur 1.
den vaskulære CCF skal også inkorporere normale anatomiske varianter af vaskulaturen, såsom thyroidea ima og dobbelt cystiske arterier, på samme måde som enkelt nukleotidpolymorfier (SNP ‘ er) beskriver normale variationer i genomet. Når vi udvider og udfylder detaljerne i den vaskulære CCF, det kan få et mere snefnug eller netlignende udseende, med sandsynligheder tildelt forskellige sektioner for at indikere sandsynligheden for at finde dem hos en given person.
den egentlige vaskulære CCF vil kræve en mere sofistikeret kodningsordning til navngivning af fartøjer end det, der er vist i Figur 1, for at repræsentere dens kompleksitet mere præcist og gøre den “beregnelig” ved hjælp af programalgoritmer. En tilgang er at bygge videre på eksisterende anatomiske ontologier, såsom UBERON, som allerede indeholder unikke ensartede Ressourceidentifikatorer (Uri ‘ er) for mange fartøjer og definerer forskellige forholdstyper, såsom “branching_part_of”, for at beskrive, hvordan Skibe forbinder (25).
en celle kan være i nærheden af mere end et fartøj, i hvilket tilfælde Det er muligt at tildele det en separat adresse i forhold til hvert fartøj. Fremtidig forskning er nødvendig for at bestemme, hvad den passende “cutoff” – afstand skal være. Det kan være ønskeligt at gemme flere adresser til celler for at hjælpe med at triangulere deres position i 3D-rum.
selvom vores oprindelige motivation for en vaskulær CCF er at definere et koordinatsystem til at specificere placeringen af celler, kunne det nye radiale layout af den menneskelige krop omkring det vaskulære, som afbildet i Figur 1, have andre videnskabelige anvendelser. For eksempel har positionsinformation inden for denne ramme analogier til embryologisk udvikling og kan give indsigt i mekanismer, der forårsager sygdom eller dysreguleringer, der opstår fra en gruppe celler. I den vaskulære CCF er makrovaskulære sygdomme forbundet med type 2-diabetes (f.eks. iskæmisk hjertesygdom, perifer vaskulær sygdom og cerebrovaskulær sygdom) grupperet nær centrum, mens de mikrovaskulære sygdomme (f. eks. retinopati, nefropati og neuropati) danner en ring omkring ydersiden (26).
Resume
det vaskulære system har flere egenskaber, der reagerer på de egenskaber, der tidligere blev anset for ønskelige for en CCF for at muliggøre kortlægning af alle celler i den menneskelige krop (7). (1) Det virker på tværs af flere skalaer. Gennem et kontinuerligt endotel gør det en sømløs overgang fra store anatomiske strukturer ned til det cellulære niveau. (2) Det gælder for alle kropsvæv. Fordi organer udvikler sig omkring skibe, rammer vaskulaturen orgelarkitektur på alle skalaer. Vaskulære mønstre er så karakteristiske, at billeder af kar alene, med alle andre celler fjernet, let kan bruges til at identificere organet. (3) Det tegner sig for donorforskelle. Vaskularisering tilpasser sig naturligt til individuelle variationer i væv, kropsstørrelse og form. I stedet for at skulle kortlægge 3D-koordinaterne for hver glomerulus i en person til dem i en anden person, ville den vaskulære CCF placere hver celle inden for en repræsentativ glomerulus kapillær fra hver person. (4) vaskulaturen er velkendt for udøvere af mange forskellige kliniske specialiteter, der hjælper både med at diagnosticere sygdom og guide operationer og bruges som vartegn af patologer, radiologer og andre klinikere. Dette ville lette positionering af vævsprøver i kroppen og registrering af placeringen af individuelle celler. Mens ingen enkelt CCF er ideel til alle brugssager, definerer en vaskulær CCF et naturligt koordinatsystem, der gør det nemt at kombinere biomolekylære data fra flere personer og stille biologisk relevante forskningsspørgsmål.
Datatilgængelighedserklæring
offentligt tilgængelige datasæt blev analyseret i denne undersøgelse. Disse data kan findes her: https://www.proteinatlas.org.
Forfatterbidrag
GV udtænkte denne undersøgelse baseret på rapporter fra CCF-mødet i 2017 og CCF-værkstedet i 2019. KB og YJ gav kritisk feedback. Det oprindelige udkast blev skrevet med yderligere tekst transskriberet fra CCF-01-diaspræsentationen. Alle forfattere bidrog til redigering af manuskriptet.
finansiering
denne forskning blev støttet af National Institutes of Health (NIH) pris OT2OD026671. Dette arbejde repræsenterer ikke udtalelsen fra NIH eller National Heart, Lung og Blood Institute (NHLBI).
interessekonflikt
forfatterne erklærer, at forskningen blev udført i mangel af kommercielle eller økonomiske forhold, der kunne fortolkes som en potentiel interessekonflikt.
anerkendelser
Vi takker Dr. Galis fra National Institutes of Health for at hjælpe med at udvikle ideen om et vaskulært baseret koordinatsystem på CCF-mødet i 2017 og CCF-værkstedet i 2019, give os præsentationer fra disse begivenheder og deltage i adskillige diskussioner, der dannede grundlaget for dette manuskript. Ekspertkommentarer fra korrekturlæserne hjalp med at afklare og specificere det foreslåede vaskulære baserede fælles koordinatsystem.
3. Uhl Larsen M, BJ Larsen E, Agaton C, Amini B, Andersen E, et al. Et humant proteinatlas til normale og kræftvæv baseret på antistofproteomics. Mol Celle Proteomics. (2005) 4:1920–32. doi: 10.1074 / mcp.M500279-MCP200
PubMed abstrakt | CrossRef Fuld tekst | Google Scholar
12. M, he L, M Larsen MA, Andrae J, Ando K, del Gaudio F, et al. Et molekylært atlas af celletyper og område i hjernens vaskulatur. Natur. (2018) 554:475–80. doi: 10.1038/nature25739
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Johnson C, Sung HJ, Lessner SM, Fini ME, Galis ZS. Matrix metalloproteinase-9 is required for adequate angiogenic revascularization of ischemic tissues: potential role in capillary branching. Circ Res. (2004) 94:262–8. doi: 10.1161/01.RES.0000111527.42357.62
PubMed Abstract | CrossRef Full Text | Google Scholar
15. De Santis V, sanger M. overvågning af iltspænding i væv af organperfusion: begrundelse, metoder, og litteraturgennemgang. Br J Anaesth. (2015) 115:357–65. doi: 10.1093 / bja / aev162
PubMed abstrakt | CrossRef Fuld tekst | Google Scholar
17. Koch CJ. Måling af absolutte iltniveauer i celler og væv ved hjælp af iltfølere og 2-nitroimidasol EF5. Metoder. (2002) 352:3–31. doi: 10.1016/S0076-6879(02)52003-6
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Paruchuri V, Salhab KF, Kuzmik G, Gubernikoff G, Fang H, Rizzo JA, et al. Aortic size distribution in the general population: explaining the size paradox in aortic dissection. Cardiology. (2015) 131:265–72. doi: 10.1159/000381281
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Abadi e, Segars, Sturgeon GM, Roos je, Ravin CE, Samei E. modellering af lungearkitektur i phantoms-serien: fysiologisk baserede luftveje, arterier og vener. IEEE Trans med Imaging. (2018) 37:693–702. doi: 10.1109 / TMI.2017.2769640
PubMed abstrakt | CrossRef Fuld tekst | Google Scholar
24. Majno P, Mentha G, Toso C, Morel P, Peitgen HO, Fasel JH. Leverens anatomi: en oversigt med tre niveauer af kompleksitet–et yderligere skridt mod skræddersyede territoriale leverresektioner. J Hepatol. (2014) 60:654–62. doi: 10.1016/j.jhep.2013.10.026
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Cade WT. Diabetes-related microvascular and macrovascular diseases in the physical therapy setting. Phys Ther. (2008) 88:1322–35. doi: 10.2522/ptj.20080008
PubMed Abstract | CrossRef Full Text | Google Scholar