Refissa
generisk navn: tretinoin
doseringsform: creme
medicinsk gennemgået af Drugs.com. sidst opdateret den 1. April 2020.
- oversigt
- bivirkninger
- dosering
- professionel
- interaktioner
- mere
kun til topisk brug i ansigtet.
- Refissa beskrivelse
- Refissa – Klinisk Farmakologi
- indikationer og brug for Refissa
- kliniske forsøgsdata
- kontraindikationer
- advarsler
- forholdsregler
- generelt
- Information til patienter
- lægemiddelinteraktioner
- carcinogenese, mutagenese, nedsat fertilitet
- graviditet
- graviditetskategori C
- ammende mødre
- pædiatrisk anvendelse
- geriatrisk anvendelse
- bivirkninger
- overdosering
- Refissa Dosering og Administration
- hvordan leveres Refissa
- opbevaring
- HOVEDDISPLAYPANEL – 40 g Rørkarton
- mere om Refissa (tretinoin topisk)
- forbrugerressourcer
- professionelle ressourcer
- relaterede behandlingsvejledninger
Refissa beskrivelse
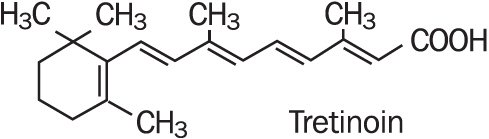
Refissa , indeholder den aktive ingrediens tretinoin (et retinoid) i en blødgørende creme base. Tretinoin er et gul-til-orange krystallinsk pulver med en karakteristisk blomsterlugt. Tretinoin er opløseligt i dimethylsulfilte, let opløseligt i polyethylenglycol 400, octanol og 100% ethanol. Det er praktisk talt uopløseligt i vand og mineralolie, og det er uopløseligt i glycerin. Det kemiske navn for tretinoin er (all-E)-3,7-dimethyl-9-(2,6,6-trimethyl-1-cykloneks-1-yl)-2,4,6,8-nonatetraensyre. Tretinoin kaldes også all-trans-retinsyre og har en molekylvægt på 300,44. Strukturformlen er repræsenteret nedenfor.
Refissa indeholder tretinoin i en koncentration på 0.05% w/w in a water-in-oil emulsion formulation consisting of light mineral oil, sorbitol solution, hydroxyoctacosanyl hydroxystearate; methoxy PEG-22/dodecyl glycol copolymer, PEG-45/dodecyl glycol copolymer, stearoxytrimethylsilane and stearyl alcohol, dimethicone 50 cs, methylparaben, edetate disodium, propylparaben, butylated hydroxytoluene, citric acid monohydrate, and purified water.
Refissa – Klinisk Farmakologi
den nøjagtige virkningsmekanisme for tretinoin er ukendt, selvom retinoider antages at have en effekt på væksten og differentieringen af forskellige epitelceller. Når det blev anvendt topisk, var der imidlertid ingen bemærket stigning i desmosin, hydroksyprolin eller elastin mRNA i human hud. Desuden er den rolle, som dette produkts irritative karakter spiller ved virkningen af de positive virkninger, der tilskrives dette produkt for dets indikation, endnu ikke fuldt ud bestemt.
den transdermale absorption af tretinoin fra forskellige topiske formuleringer varierede fra 1% til 31% af den påførte dosis, afhængigt af om den blev påført på sund hud eller dermatitisk hud. Når perkutan absorption af Tretinoincreme, USP (blødgøringsmiddel) 0,05% blev vurderet hos raske mandlige forsøgspersoner (n=14) efter en enkelt applikation såvel som efter gentagne daglige applikationer i 28 dage, var absorptionen af tretinoin mindre end 2%, og endogene koncentrationer af tretinoin og dets vigtigste metabolitter var uændrede.
indikationer og brug for Refissa
(for fuldt ud at forstå indikationen for dette produkt, skal du læse hele afsnittet indikationer og brug af mærkningen.)
Refissa er indiceret som et supplerende middel (se andet punktpunkt nedenfor) til brug ved afbødning (lindring) af fine rynker, flettet hyperpigmentering og taktil ruhed i ansigtshuden hos patienter, der ikke opnår en sådan lindring ved hjælp af omfattende hudplejeprogrammer og solundgåelsesprogrammer (se punkt 3 for populationer, hvor effektivitet ikke er fastlagt). Refissa fjerner ikke rynker, reparerer solbeskadiget hud, omvendt fotografering eller gendanner et mere ungdommeligt eller yngre HUDHISTOLOGISK mønster. Mange patienter opnår ønskede palliative effekter på fine rynker, flettet hyperpigmentering og taktil ruhed i ansigtshuden ved hjælp af omfattende hudplejeprogrammer og solundgåelsesprogrammer, herunder solcreme, beskyttelsesbeklædning og blødgørende cremer, der ikke indeholder tretinoin.
- Tretinoin creme, USP (blødgøringsmiddel) 0.05% har ikke vist nogen formildende virkning på signifikante tegn på kronisk soleksponering, såsom grov eller dyb rynker, gulfarvning af huden, lentiginer, telangiektasi, hudslaphed, keratinocytisk atypi, melanocytisk atypi eller dermal elastose.
- Refissa bør anvendes under lægeligt tilsyn som et supplement til et omfattende hudpleje-og solundgåelsesprogram, der omfatter brug af effektive solcreme (minimun SPF på 15) og beskyttelsesbeklædning, når de ønskede resultater på fine rynker, flettet hyperpigmentering og ruhed i ansigtshuden ikke er opnået med et omfattende hudplejeprogram og solundgåelsesprogram alene.
- effektiviteten af Refissa til afbødning af fine rynker, flettet hyperpigmentering og taktil ruhed i ansigtshuden er ikke fastlagt hos mennesker over 50 år eller hos mennesker med moderat til stærkt pigmenteret hud. Derudover blev patienter med synlige aktiniske keratoser og patienter med hudkræft i anamnesen udelukket fra kliniske forsøg med Tretinoincreme, USP (blødgøringsmiddel) 0, 05%. Således er effektiviteten og sikkerheden af Refissa i disse populationer ikke kendt på nuværende tidspunkt.
- hverken sikkerheden eller effektiviteten af Refissa til forebyggelse eller behandling af aktiniske keratoser eller hudneoplasmer er blevet fastslået.
- hverken sikkerheden eller effekten af at bruge Refissa dagligt i mere end 48 uger er blevet fastslået, og daglig brug ud over 48 uger er ikke systematisk og histologisk undersøgt i tilstrækkelige og velkontrollerede forsøg. (Se afsnittet advarsler.)
kliniske forsøgsdata
to tilstrækkelige og velkontrollerede forsøg blev udført med i alt 161 evaluerbare patienter (under 50 år) behandlet med Tretinoincreme, USP (blødgørende) 0,05% og 154 evaluerbare patienter behandlet med vehicle emollient cream i ansigtet i 24 uger som et supplement til et omfattende program til hudpleje og solundgåelse for at vurdere virkningerne på fin rynke, flettet hyperpigmentering og taktil hud ruhed. Patients were evaluated at baseline on a 10-point scale, and changes from that baseline rating were categorized as follows:
| No Improvement: | No change or an increase of 1 unit or more | |
| Minimal Improvement: | Reduction of 1 unit | |
| Moderate Improvement: | reduktion af 2 enheder eller mere |
i disse forsøg blev de fine rynker, flettet hyperpigmentering og taktil ruhed i ansigtshuden antaget at være forårsaget af flere faktorer som omfattede iboende aldring eller miljømæssige faktorer, såsom kronisk soleksponering.
resultaterne af disse vurderinger er som følger:
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 36% | 40% | 24% |
| Vehicle + CSP | 62% | 30% | 8% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 35% | 27% | 38% |
| Vehicle + CSP | 53% | 21% | 27% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| * CSP= Comprehensive skin protection and sun avoidance programs included use of sunscreens, protective clothing, and emollient cream. | |||
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 49% | 35% | 16% |
| vehicle + CSP | 67% | 23% | 10% |
det meste af forbedringen af disse tegn blev noteret i løbet af de første 24 ugers behandling. Derefter opretholdt terapi primært den forbedring, der blev realiseret i løbet af de første 24 uger.
et flertal af patienterne mister de fleste formildende virkninger af Refissa på fine rynker, flettet hyperpigmentering og taktil ruhed i ansigtshuden med ophør af et omfattende hudplejeprogram og solundgåelsesprogram inklusive Refissa; sikkerheden og effektiviteten ved at bruge Refissa dagligt i mere end 48 uger er dog ikke fastlagt.
kontraindikationer
dette lægemiddel er kontraindiceret hos personer med en historie med følsomhedsreaktioner over for nogen af dets komponenter. Det bør seponeres, hvis overfølsomhed over for nogen af dets ingredienser er noteret.
advarsler
- Refissa er en hudirriterende, og resultaterne af fortsat irritation af huden i mere end 48 uger ved kronisk langvarig brug er ikke kendt. Der er tegn på atypiske ændringer i melanocytter og keratinocytter og øget dermal elastose hos nogle patienter behandlet med Tretinoincreme, USP (blødgøringsmiddel) 0, 05% i længere tid end 48 uger. Betydningen af disse fund er ukendt.
- sikkerhed og effektivitet af Refissa hos personer med moderat eller stærkt pigmenteret hud er ikke blevet fastslået.Refissa bør ikke administreres, hvis patienten også tager lægemidler, der vides at være fotosensibilisatorer (f.eks.
på grund af øget brændende følsomhed bør udsættelse for sollys (inklusive sollamper) undgås eller minimeres under brug af Refissa. Patienter skal advares om at bruge solcreme (minimum SPF på 15) og beskyttelsesbeklædning, når de bruger Refissa. Patienter med solskoldning bør rådes til ikke at bruge Refissa, før de er fuldt ud genoprettet. Patienter, der kan have betydelig soleksponering, f.eks. på grund af deres erhverv, og patienter med iboende følsomhed over for sollys, skal udvise særlig forsigtighed, når de bruger Refissa og sikre, at de forholdsregler, der er beskrevet i Patientpakningsindsatsen, overholdes.
Tretinoin creme, USP (blødgørende) 0,05% bør holdes ude af øjne, mund, vinkler af næsen, og slimhinder. Lokal anvendelse kan forårsage alvorlig lokal erytem, kløe, brændende, stikkende og skrælning på applikationsstedet. Hvis graden af lokal irritation berettiger, skal patienter rettes mod at bruge mindre medicin, mindske hyppigheden af påføring, afbryde brugen midlertidigt eller afbryde brugen helt.
Tretinoin er rapporteret at forårsage alvorlig irritation på eksematisk hud og bør kun anvendes med forsigtighed til patienter med denne tilstand.
anvendelse af større mængder medicin end anbefalet vil ikke føre til hurtigere eller bedre resultater, og der kan forekomme markant rødme, skrælning eller ubehag.
forholdsregler
generelt
Refissa bør kun bruges som et supplement til et omfattende hudplejeprogram og solundgåelsesprogram. (Se afsnittet indikationer og brug.)
Hvis der udvikles en lægemiddelfølsomhed, kemisk irritation eller en systemisk bivirkning, skal brugen af Refissa seponeres.
ekstreme vejrforhold, såsom vind eller kulde, kan være mere irriterende for patienter, der bruger Refissa.
Information til patienter
se indlægssedlen.
lægemiddelinteraktioner
samtidig topisk medicin, medicinske eller slibende sæber, shampoo, rensemidler, kosmetik med en stærk tørreffekt, produkter med høje koncentrationer af alkohol, astringenter, krydderier eller kalk, permanente bølgeopløsninger, elektrolyse, hårfjerningsmidler eller voks og produkter, der kan irritere huden, skal bruges med forsigtighed hos patienter, der behandles med Refissa, fordi de kan øge irritationen med Refissa.
Refissa bør ikke administreres, hvis patienten også tager lægemidler, der vides at være fotosensibilisatorer (f. eks. på grund af muligheden for øget fototoksicitet.
carcinogenese, mutagenese, nedsat fertilitet
i en lifetime dermal undersøgelse i CD-1 mus ved 100 og 200 gange den gennemsnitlige anbefalede humane topiske kliniske dosis blev der observeret nogle få hudtumorer hos hunmus og levertumorer hos hanmus. Den biologiske betydning af disse fund er ikke klar, fordi de forekom ved doser, der oversteg den dermale maksimalt tolererede dosis (MTD) af tretinoin, og fordi de var inden for baggrunden naturlig forekomsthastighed for disse tumorer i denne stamme af mus. Der var ingen tegn på karcinogent potentiale, når tretinoin blev administreret topisk i en dosis 5 gange den gennemsnitlige anbefalede humane topiske kliniske dosis. Med henblik på sammenligninger af dyrets eksponering for den humane eksponering defineres den “anbefalede humane topiske kliniske dosis” som 500 mg Refissa, der påføres dagligt til en person på 50 kg.
i et kronisk, to-årigt bioassay af Vitamin A-syre hos mus udført af Tsubura og Yamamoto blev generaliseret amyloidaflejring rapporteret i alle grupper i det basale lag af den vitamin A-behandlede hud. I CD – 1-mus rapporterede en lignende undersøgelse hyalinisering af de behandlede hudsteder, og forekomsten af dette fund var henholdsvis 0/50, 3/50 og 2/50 hos hanmus og 1/50, 0/50, 4/50 og 2/50 hos hunmus fra vehicle control, 0,25 mg/kg, 0,5 mg/kg og 1 mg/kg grupper.
undersøgelser med hårløse albinomus antyder, at tretinoin kan øge det tumorigeniske potentiale for kræftfremkaldende doser af UVB-og UVA-lys fra en solsimulator. I andre undersøgelser, hvor let pigmenterede hårløse mus behandlet med tretinoin blev udsat for kræftfremkaldende doser af UVB-lys, blev forekomsten og udviklingshastigheden af hudtumorer enten reduceret, eller der blev ikke set nogen effekt. På grund af signifikant forskellige eksperimentelle forhold er ingen streng sammenligning af disse forskellige data mulig på nuværende tidspunkt. Selvom betydningen af disse undersøgelser hos mennesker ikke er klar, bør patienter minimere udsættelse for sol.
tretinoins mutagene potentiale blev evalueret i Ames-analysen og i In vivo-mikronukleus-analysen hos mus, som begge var negative.
Dermal Segment i og III studier med Tretinoin creme, USP (blødgøringsmiddel) 0,05% er ikke udført i nogen art. I orale Segment i-og Segment III-studier på rotter med tretinoin blev nedsat overlevelse af nyfødte og væksthæmning observeret ved doser på over 2 mg/kg/dag (>400 gange den gennemsnitlige humane topiske kliniske dosis).
graviditet
teratogene virkninger
graviditetskategori C
ORAL tretinoin har vist sig at være teratogent hos rotter, mus, kaniner, hamstere og subhumane primater. Det var teratogent og føtotoksisk hos rotter, når det blev givet oralt eller topisk i doser 1000 gange den gennemsnitlige anbefalede humane topiske kliniske dosis. Der er dog rapporteret om variationer i teratogene doser blandt forskellige rottestammer. Hos cynomolgusaben, som metabolisk er tættere på mennesker for tretinoin end de andre undersøgte arter, blev der rapporteret føtale misdannelser ved doser på 10 mg/kg/dag eller derover, men ingen blev observeret ved 5 mg/kg/dag (1000 gange den gennemsnitlige anbefalede humane topiske kliniske dosis), skønt der blev observeret øgede skeletvariationer ved alle doser. En dosisrelateret stigning i embryoletalitet og abort blev rapporteret. Lignende resultater er også rapporteret i pigtail makaker.
topisk tretinoin i dyreteratogenicitetstest har genereret tvetydige resultater. Der er tegn på teratogenicitet (forkortet eller knækket hale) af topisk tretinoin hos Vistar-rotter ved doser større end 1 mg/kg/dag (200 gange den anbefalede humane topiske kliniske dosis). Anomalier (humerus: kort 13%, bøjet 6%, OS parietal ufuldstændigt forbenet 14%) er også rapporteret, når 10 mg/kg/dag blev anvendt dermalt.80 gange den anbefalede humane topiske kliniske dosis af en øget forekomst af kuplet hoved og hydrocephaly, typisk for retinoidinducerede føtale misdannelser hos denne art.
i modsætning hertil har flere velkontrollerede dyreforsøg vist, at dermalt anvendt tretinoin ikke var teratogent ved doser på henholdsvis 100 og 200 gange den anbefalede humane topiske kliniske dosis hos henholdsvis rotter og kaniner.
Ved udbredt brug af ethvert lægemiddel forventes et lille antal fødselsdefektrapporter, der er forbundet midlertidigt med administrationen af lægemidlet, tilfældigt alene. Tredive tilfælde af midlertidigt associerede medfødte misdannelser er rapporteret i løbet af to årtier med klinisk anvendelse af en anden formulering af topisk tretinoin (Retin-A). Selvom der ikke er fastlagt et bestemt mønster af teratogenicitet og ingen afslappet tilknytning fra disse tilfælde, beskriver 5 af rapporterne den sjældne fødselsdefektkategori holoprosencephaly (defekter forbundet med ufuldstændig midtlinjeudvikling af forhjernen). Betydningen af disse spontane rapporter med hensyn til risiko for fosteret er ikke kendt.
ikke-teratogene virkninger
Dermal tretinoin har vist sig at være føtotoksisk hos kaniner, når det administreres i doser 100 gange den anbefalede topiske humane kliniske dosis. Oral tretinoin har vist sig at være føtotoksisk hos rotter, når det administreres i doser 500 gange den anbefalede topiske humane kliniske dosis.
der er dog ingen tilstrækkelige og velkontrollerede undersøgelser hos gravide kvinder. Refissa bør ikke anvendes under graviditet.
ammende mødre
det vides ikke, om dette lægemiddel udskilles i modermælk. Da mange lægemidler udskilles i modermælk, skal der udvises forsigtighed, når Refissa administreres til en ammende kvinde.
pædiatrisk anvendelse
sikkerhed og effektivitet hos patienter under 18 år er ikke fastlagt.
geriatrisk anvendelse
sikkerhed og virkning hos personer over 50 år er ikke fastlagt.
bivirkninger
(se afsnittene advarsler og forsigtighedsregler.)
i dobbeltblinde, køretøjskontrollerede studier, der involverede 179 patienter, der påførte Tretinoincreme, USP (blødgøringsmiddel) 0, 05% på deres ansigter, var bivirkninger forbundet med brugen af Tretinoincreme, USP (blødgøringsmiddel) 0, 05% primært begrænset til huden. Under disse forsøg måtte 4% af patienterne afbryde brugen af Tretinoincreme, USP (blødgøringsmiddel) 0, 05% på grund af bivirkninger. Disse seponeringer skyldtes hudirritation eller relaterede kutane bivirkninger.
lokale reaktioner såsom skrælning, tør hud, brændende, stikkende, erytem og kløe blev rapporteret af næsten alle forsøgspersoner under behandling med Tretinoincreme, USP (blødgøringsmiddel) 0,05%. Disse tegn og symptomer var normalt af let til moderat sværhedsgrad og forekom generelt tidligt i behandlingen. Hos de fleste patienter gentog tørheden, skrælningen og rødmen sig efter en indledende (24 ugers) tilbagegang.
overdosering
anvendelse af større mængder medicin end anbefalet har ikke vist sig at føre til hurtigere eller bedre resultater, og der kan forekomme markant rødme, skrælning eller ubehag. Oral indtagelse af lægemidlet kan føre til de samme bivirkninger som dem, der er forbundet med overdreven oral indtagelse af vitamin A.
Refissa Dosering og Administration
- Brug ikke Refissa, hvis patienten er gravid eller forsøger at blive gravid eller har høj risiko for graviditet
- Brug ikke Refissa, hvis patienten er solbrændt, eller hvis patienten har eksem eller anden kronisk hudtilstand
- Brug ikke Refissa, hvis patienten i sagens natur er følsom over for sollys
- Brug ikke Refissa, hvis patienten også tager medicin, der vides at være på grund af muligheden for øget fototoksicitet.
patienter kræver detaljeret instruktion for at opnå maksimale fordele og for at forstå alle de forholdsregler, der er nødvendige for at bruge dette produkt med størst sikkerhed. Lægen bør gennemgå patientens indlægsseddel.
Refissa bør påføres ansigtet en gang om dagen før pensionering, idet man kun bruger nok til at dække hele det berørte område let. Patienter skal forsigtigt vaske deres ansigter med en mild sæbe, klappe huden tør og vente 20 til 30 minutter, før de påfører Refissa. Patienten skal anvende en ærtestørrelse creme for at dække hele ansigtet let. Der skal udvises særlig forsigtighed ved påføring af cremen for at undgå øjne, ører, næsebor og mund.
anvendelse af Refissa kan forårsage en forbigående følelse af varme eller let stikkende.
afbødning (lindring) af fine rynker i ansigtet, flettet hyperpigmentering og taktil ruhed kan forekomme gradvist i løbet af behandlingen. Op til seks måneders behandling kan være påkrævet, før virkningerne ses. Det meste af den forbedring, der er bemærket med Refissa, ses i løbet af de første 24 ugers behandling. Derefter opretholder terapi primært den forbedring, der blev realiseret i løbet af de første 24 uger.
ved seponering af Refissa-behandling vil et flertal af patienterne miste de fleste formildende virkninger af Refissa på fine rynker, flettet hyperpigmentering og taktil ruhed i ansigtshuden; sikkerheden og effektiviteten ved at bruge Refissa dagligt i mere end 48 uger er imidlertid ikke fastlagt.
anvendelse af større mængder medicin end anbefalet fører muligvis ikke til hurtigere resultater eller bedre resultater, og der kan forekomme markant rødme, skrælning eller ubehag.
patienter, der behandles med Refissa, kan bruge kosmetik, men de områder, der skal behandles, skal rengøres grundigt, inden medicinen påføres. (Se afsnittet forholdsregler.)
hvordan leveres Refissa
Refissa Fås i:
20 g rør NDC 42851-012-20
40 g rør NDC 42851-012-40
opbevaring
opbevares ved 20-25 liter C (68-77 liter F) . MÅ IKKE NEDFRYSES.
kun rk.
trykt i USA
140904-0118
fremstillet af DPT Laboratories, San Antonio, 78215
distribueret af Skin Health, Inc., Irvine, CA 92618
Refissa kar
til topisk brug kun i ansigtet
Hvad er de vigtigste oplysninger om Refissa ?
Refissa er en alvorlig medicin. Det fjerner ikke rynker eller reparerer solbeskadiget hud. Det kan hjælpe med at behandle fine rynker, plettet misfarvning, og ru følelse hud, men det gør ikke “helbrede” disse betingelser. Refissa bør kun anvendes under tilsyn af din sundhedspleje udbyder som en del af en bred hudpleje program. Dette program bør omfatte at undgå direkte sollys (ved at bruge beskyttelsestøj og solcreme med et minimum SPF på 15) og bruge andre fugtgivende ansigtscremer, der ikke indeholder tretinoin.
Du bør kun bruge Refissa ved sengetid. Brug ikke tørrende hudplejeprodukter. Brug den mindste mængde Refissa, der er nødvendig, og undgå at få det i dine øjne, ører, næse eller mund.ADVARSEL: Brug ikke Refissa, hvis du er gravid eller forsøger at blive gravid. Undgå sollys og andre lægemidler, der kan øge din følsomhed over for sollys (se nedenfor).
Refissa er ikke undersøgt hos personer over 50 år eller hos personer med moderat eller mørkt pigmenteret hud.
Hvad er Refissa?
(Hvad kan jeg forvente af Refissa?)
Refissa er en alvorlig medicin, der kan hjælpe med at behandle, men vil ikke “helbrede” fine rynker, plettet hud misfarvning og ru følelse hud.
undersøgelser viser, at efter 24 uger havde omkring 30% af de mennesker, der brugte Tretinoincreme, USP (blødgørende) 0,05% til fine rynker eller plettet misfarvning moderat forbedring, yderligere 35% havde minimal forbedring og 35% havde ingen forbedring. Omkring 16% af de mennesker, der brugte Tretinoin creme, USP (blødgørende) 0,05% for ru hud havde moderat forbedring, 35% havde minimal forbedring, og 49% havde ingen forbedring. Der er ingen tegn på, at Refissa behandler grov hud, dybe rynker, gulende hud eller andre hudplejeproblemer.
Refissa bør bruges som en del af et bredt hudplejeprogram. Dette program bør omfatte at undgå direkte sollys (ved at bruge beskyttelsestøj og solcreme med et minimum SPF på 15) og bruge andre fugtgivende ansigtscremer, der ikke indeholder tretinoin. Mange mennesker kan opnå ønskede effekter ved at bruge dette program uden at bruge Refissa. Du bør ikke bruge Refissa, før du har prøvet et bredt hudbehandlingsprogram uden Refissa.
Når du bruger Refissa, er forbedring af fine rynker, plettet misfarvning af huden og ru hud ikke øjeblikkelig og forekommer gradvist over tid. Generelt kan du bemærke nogle effekter i 3 til 4 måneder. Virkningerne er normalt mest synlige på omkring 6 måneder med lidt yderligere forbedring efter den tid. Hvis Refissa stoppes, vil forbedringen gradvist falde.
sikkerheden ved brug af Refissa dagligt i mere end 48 uger er ikke fastlagt.
hvem bør ikke bruge Refissa?
Du bør ikke bruge Refissa, hvis du er solbrændt eller meget følsom over for solen, hvis du har eksem, eller hvis din hud er irriteret. Refissa kan forårsage øget hudirritation og øget modtagelighed for solskoldning.
da Refissa kan gøre din hud mere følsom over for sollys, skal du fortælle det til din læge, hvis du også bruger anden medicin, der øger følsomheden over for sollys, fordi du ikke bør bruge Refissa sammen med disse lægemidler. Disse inkluderer, men er ikke begrænset til: tetracycliner, fluorokinolner eller sulfonamider (bruges til at behandle infektion) og phenothiasiner (bruges til at behandle alvorlige følelsesmæssige problemer). Hvis du tager receptpligtig medicin, ikke-receptpligtig medicin eller bruger nogen ansigtscremer, tjekke med en sundhedsperson for at sikre, at de ikke interagerer med Refissa.
graviditet advarsel: sikker brug under graviditet er ikke vist. Der er rapporter om fosterskader hos forsøgsdyr og mennesker, der fik tretinoin gennem munden. Du bør ikke bruge Refissa, hvis du er gravid eller forsøger at blive gravid.
Det vides ikke, om Refissa overføres til spædbørn gennem modermælk. Sikker brug til børn er ikke påvist.
sikkerheden og effektiviteten af Refissa for personer over 50 år eller med mørkere hudfarve er ikke bevist.
hvordan skal jeg bruge Refissa?
Du skal anvende Refissa på dit ansigt en gang om dagen, før du går på pension, og kun bruge nok til at dække hele det berørte område let. Vask forsigtigt dit ansigt med en mild sæbe, klapp huden tør, og vent 20 til 30 minutter, før du påfører Refissa. Påfør en mængde creme i ærtestørrelse for at dække hele dit ansigt. Du kan føle en varme eller let stikkende, når Refissa først påføres.
du skal være særlig forsigtig, når du påfører cremen for at undgå dine øjne, ører, næsebor eller mund. Refissa kan forårsage alvorlig rødme, kløe, brændende, stikkende og skrælning, hvis den anvendes på disse områder.
brug af større end nødvendige mængder Refissa vil ikke fremskynde resultaterne og kan forårsage overdosering. En overdosis kan resultere i rød og skrælende hud samt nogle smerter eller ubehag.
Du kan bruge kosmetik efter påføring af Refissa. Sørg for at rengøre dit ansigt grundigt, inden du påfører Refissa igen.
Hvad skal jeg undgå, mens jeg bruger Refissa?
Refissa øger din følsomhed over for sollys. Undgå sollys så meget som muligt. Brug beskyttelsesbeklædning og en solcreme med et minimum SPF på 15. Må ikke solbade eller bruge solarier. Hvis du er følsom over for sollys eller har et job, der kræver, at du er ude i solen i lange perioder, skal du være meget forsigtig.
undgå produkter, der kan tørre eller irritere huden, mens du bruger Refissa. Undgå for eksempel produkter, der påføres huden, der indeholder alkohol, krydderier eller kalk. Undgå også rensemidler, hårfjerning eller andre produkter, der kan irritere huden.
Hvad er de mulige bivirkninger af Refissa?
de mest almindelige bivirkninger er hudreaktioner. Kløe, rød og tør hud er blevet rapporteret. Så har brændende, stikkende og skrælende hud. Disse er oftest milde og er mest almindelige, når behandlingen påbegyndes.
hvordan kan jeg få yderligere oplysninger?
denne indlægsseddel opsummerede de vigtigste oplysninger om Refissa. Hvis du ønsker mere information, skal du tale med din læge eller anden sundhedsudbyder. Der er også en folder skrevet til sundhedspersonale, som din apotek kan give dig.
ring til din læge for lægehjælp om bivirkninger. DU KAN RAPPORTERE BIVIRKNINGER TIL FDA PÅ 1-800-FDA-1088.
HOVEDDISPLAYPANEL – 40 g Rørkarton
NDC 42851-012-40
117471-0118
Refissa kar
Tretinoin creme,
USP (blødgøringsmiddel) 0.05%
Rx Only
NET WT 40 g
FDA APPROVED

| Refissa TRETINOIN (EMOLLIENT) tretinoin cream |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
Labeler – ZO Skin Health, Inc. (826468527)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| DPT Laboratories, Ltd. | 832224526 | manufacture(42851-012) | |
mere om Refissa (tretinoin topisk)
- bivirkninger
- under graviditet eller amning
- doseringsinformation
- lægemiddelinteraktioner
- prisfastsættelse& kuponer
- en espa>
forbrugerressourcer
- patientinformation
- refissa Aktuel (avanceret læsning)
professionelle ressourcer
- ordineringsinformation
- tretinoin gel microsphere (FDA)
andre mærker Retin-A, Renova, Atralin, Altreno, … + 2 mere
relaterede behandlingsvejledninger
- fotografering af huden
medicinsk ansvarsfraskrivelse