19.11: Racemisierung
Optisch aktive Biphenylderivate (Abschnitt 13-5A) werden racemisiert, wenn die beiden aromatischen Ringe zu irgendeinem Zeitpunkt durch Rotation um die Zentralbindung eine koplanare Konfiguration durchlaufen. Dies kann mehr oder weniger leicht durch Wärme bewirkt werden, es sei denn, die 2,2′-Ortho-Substituenten sind sehr groß.
Die Art und Weise, wie Verbindungen mit asymmetrischen Kohlenstoffatomen racemisiert werden, ist komplizierter. Eine Möglichkeit wäre, dass ein tetraedrischer chiraler Kohlenstoff, der an vier Gruppen gebunden ist, planar und achiral wird, ohne irgendwelche Bindungen zu brechen. Theoretische Berechnungen zeigen, dass dies kein wahrscheinlicher Prozess für chiralen vierwertigen Kohlenstoff ist, aber wie wir sehen werden, tritt er bei chiralem Kohlenstoff und anderen chiralen Atomen auf, die an drei Gruppen gebunden sind:
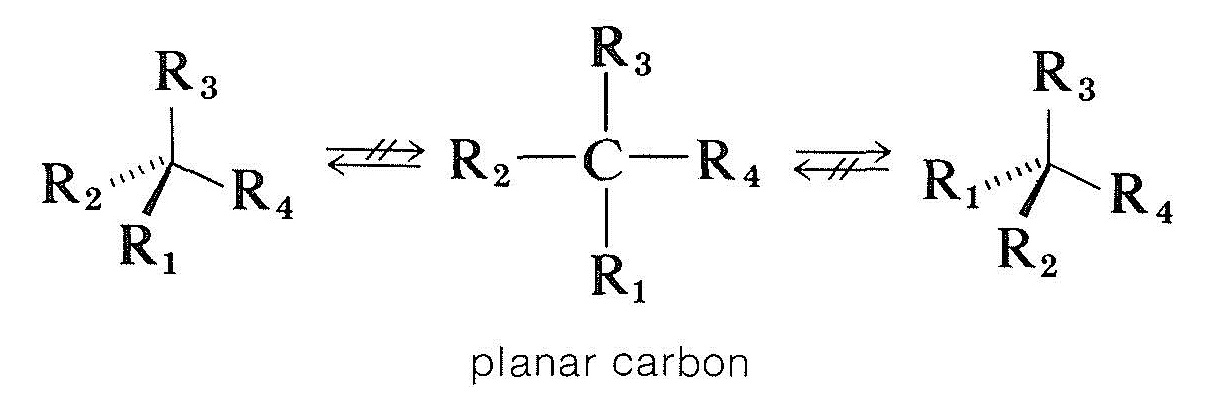
Optisch aktive Carbonylverbindungen vom Typ \(\ce{-CHC=O}\), bei denen der Alpha-Kohlenstoff asymmetrisch ist, werden sowohl von Säuren als auch von Basen racemisiert, und aus Abschnitt 17-1 kann sicher sein, dass dies mit der Enolisierung zusammenhängt. Die Bildung entweder des Enols oder des Enolatanions zerstört die Asymmetrie des \ (\ alpha \) Kohlenstoffs, so dass, selbst wenn zu einem bestimmten Zeitpunkt nur Spuren von Enol vorhanden sind, schließlich die gesamte Verbindung racemisiert wird. Der Mechanismus erfordert jedoch sowohl, dass es einen \ (\alpha \) Wasserstoff gibt, als auch, dass sich das Symmetriezentrum an diesem \ (\alpha \) Kohlenstoff befindet. Andernfalls sind Säuren und Basen bei der Katalyse der Racemisierung unwirksam.
.jpg?revision=1)
Die Racemisierung eines optisch aktiven sekundären Halogenids mit dem das Halogen tragenden chiralen Kohlenstoff (z.B., 2-Chlorbutan) kann ih-Lösung auftreten und je polar und besser ionisierend das Lösungsmittel ist, desto leichter wird die Substanz racemisiert. Die Ionisierung des Halogenids durch einen \(S_\ text{N} 1\) -Prozess ist wahrscheinlich verantwortlich, und dies würde sicherlich durch polare Lösungsmittel gefördert werden (Abschnitt 8-6). Alle Hinweise darauf sind, dass ein Alkylcarbokation einmal von seinem begleitenden Anion dissoziiert ist planar; und wenn ein solches Ion mit dem Anion rekombiniert, hat es die gleiche Wahrscheinlichkeit, die \ (D \) und \ (L \) Enantiomere zu bilden:
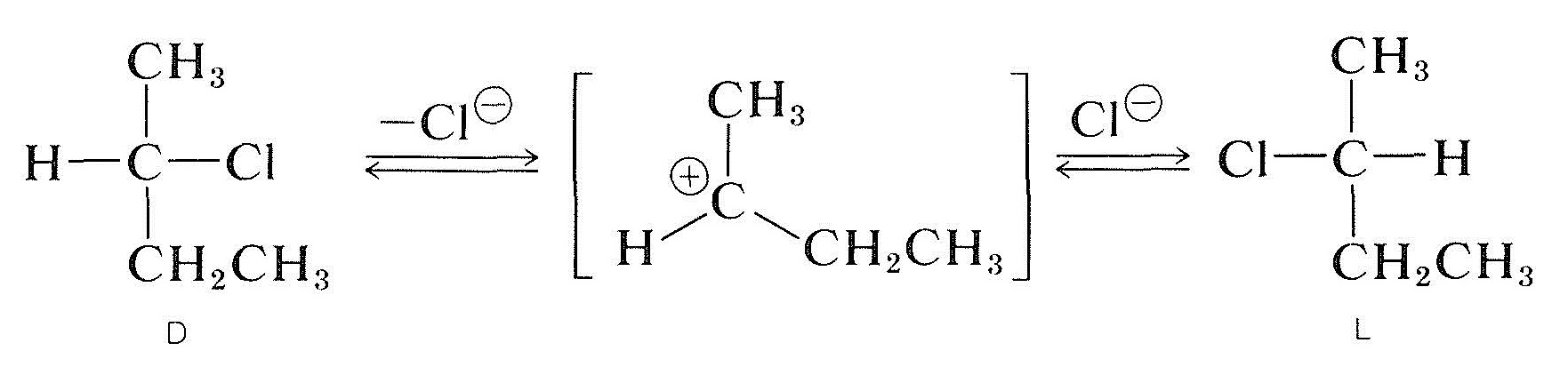
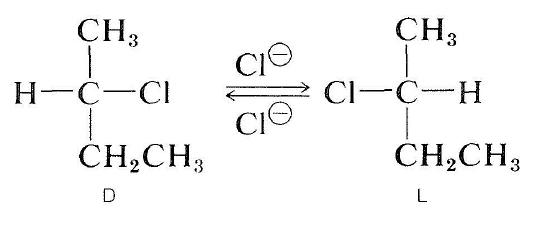
Optisch aktive Halogenide können auch durch einen \(S_\text{N}2\) Mechanismus racemisiert werden. Eine Lösung von aktivem 2-Chlorbutan in 2-Propanon, die gelöstes Lithiumchlorid enthält, wird racemisch. Die Verdrängung des Chlorids des Halogenids durch Chloridionen invertiert die Konfiguration am substituierten Atom (siehe Abschnitt 8-5). Eine zweite Substitution regeneriert das ursprüngliche Enantiomer. Schließlich erzeugt dieser Hin- und-Her-Prozess die gleiche Anzahl der \ (D \) und \ (L \) Formen; Die Substanz ist dann racemisch:
Asymmetrische Alkohole werden oft durch starke Säuren racemisiert. Zweifellos findet eine Ionisierung statt, und die Rekombination der Carbokation mit Wasser führt zu beiden Enantiomeren:
.jpg?revision=1&size=bestfit&width=590&height=243)
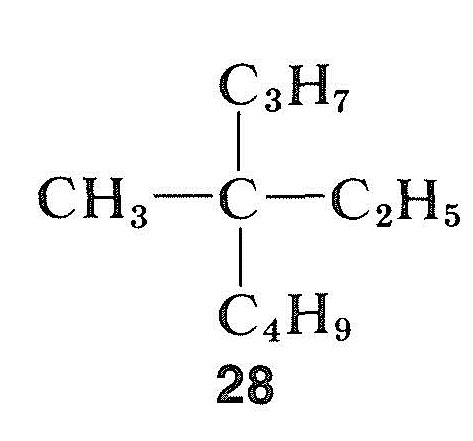
Im Gegensatz zu Halogeniden, Alkoholen und Carbonylverbindungen können Kohlenwasserstoffe äußerst schwierig zu racemisieren sein. Dies gilt insbesondere für eine Verbindung mit einem quaternären asymmetrischen Zentrum, wie Methylethylpropylbutylmethan, \(28\), die keinen „Griff“ hat, um den asymmetrischen Kohlenstoff mit einfachen chemischen Mitteln in einen symmetrischen Zustand umzuwandeln:
Kohlenwasserstoffe, die am asymmetrischen Kohlenstoff ein Wasserstoffatom haben, können jedoch racemisiert werden, wenn sie entweder in Carbokationen oder in Carbanionen umgewandelt werden können. Die Leichtigkeit der carbanionartigen Racemisierung hängt von der Acidität des gebundenen Wasserstoffs und von der stereochemischen Stabilität des gebildeten intermediären Carbanions ab. Wenn die Konfiguration des Carbanionzwischenprodukts invertiert, führt dies zu einer Racemisierung (siehe auch Abschnitt 6-4E):
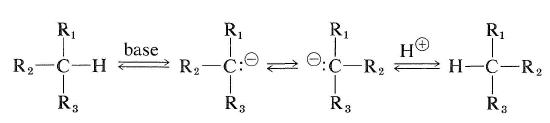
Die Carbokationsart der Racemisierung eines optisch aktiven Kohlenwasserstoffs kann durch die in Abschnitt 10-9 beschriebene Austauschreaktion erfolgen.
Mitwirkende und Zuschreibungen
- John D. Robert und Marjorie C. Caserio (1977) Grundprinzipien der organischen Chemie, zweite Auflage. W. A. Benjamin, Inc. In : Menlo Park, CA. ISBN 0-8053-8329-8. Dieser Inhalt ist unter den folgenden Bedingungen urheberrechtlich geschützt: „Sie erhalten die Erlaubnis zur individuellen, pädagogischen, forschungsbezogenen und nichtkommerziellen Reproduktion, Verbreitung, Anzeige und Aufführung dieser Arbeit in jedem Format.“